Кристаллические решетки
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию
.
Источник
Основные группы металлов в промышленности
Индустрия делит металлы на большие группы:
- Черные.
- Цветные легкие.
- Цветные тяжелые.
- Благородные.
- Редкоземельные и щелочные.
Черные металлы
В эту группу входят железо, марганец, хром и их сплавы. Группа также включает в себя стали, чугуны и ферросплавы. Эти вещества обладают хорошей электропроводностью и уникальными магнитными характеристиками.
Черные металлы покрывают до 90% мировой потребности в металлоизделиях.
Легкие цветные металлы
Отличаются низкой плотностью. Группа включает в себя алюминий, титан, магний. Эти реже встречаются, чем железо, и обходятся дороже в добыче руды и в производстве. Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.
Титан не вызывает отторжения со стороны иммунной системы и применяется в протезировании костной ткани.
Тяжелые цветные металлы
Это элементы с большим удельным весом, такие, как медь, олово, свинец, цинк и никель. Обладают хорошей электропроводностью.
Медь Олово Цинк Свинец Чистый никель
Они широко используются как катализаторы реакций, в изготовлении электроматериалов, в электронике, на транспорте – везде, где требуются достаточно прочные, упругие и коррозионностойкие материалы.
Благородные металлы
В эту группу входят золото, серебро, платина, а также редко встречающееся рутений, родий, палладий, осмий, иридий. Они обладают наибольшим удельным весом, высокой коррозионной устойчивостью и высокой электрической и тепловой проводимостью.
Золото и платина Серебро
На заре человечества золото, серебро и платина применялись как универсальный платежный инструмент и как средство накопления богатств. С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
Редкоземельные и щелочные
К редкоземельным относятся скандий, иттрий, лантан и еще 15 редких элементов. Эти элементы отличаются значительным удельным весом, высокой химической активностью и применяются в высокотехнологичных отраслях.
Иттрий Сканидий Лантан
К щелочным относятся литий, калий, натрий и другие. Все они отличаются малым удельным весом и исключительной химической активностью и при реакции с водой образуют щелочи, широко применяемы в быту и промышленности в составе мыла и других моющих средств.
Физические свойства меди:
| 204 | Радиус атома (вычисленный) | 145 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 132 пм |
| 207 | Радиус иона (кристаллический) | Cu + (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 140 пм |
| 209 | Электроны, Протоны, Нейтроны | 29 электронов, 29 протонов, 35 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 11-ая группа (по старой классификации – побочная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 306 | Энергия сродства атома к электрону | 119,235(4) кДж/моль (1,23578(4) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 8,96 г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), |
8,02 г/см 3 (при температуре плавления 1084,62 °C и иных стандартных условиях, состояние вещества – жидкость),
7,962 г/см 3 (при 1127 °C и иных стандартных условиях, состояние вещества – жидкость), 7,881 г/см 3 (при 1227 °C и иных стандартных условиях, состояние вещества – жидкость), 7,799 г/см 3 (при 1327 °C и иных стандартных условиях, состояние вещества – жидкость), 7,471 г/см 3 (при 1727 °C и иных стандартных условиях, состояние вещества – жидкость), 7,307 г/см 3 (при 1927 °C и иных стандартных условиях, состояние вещества – жидкость),
7,225 г/см 3 (при 2027 °C и иных стандартных условиях, состояние вещества – жидкость), 7,102 г/см 3 (при 2177 °C и иных стандартных условиях, состояние вещества – жидкость)
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Медь |
| 102 | Прежнее название | |
| 103 | Латинское название | Cuprum |
| 104 | Английское название | Copper |
| 105 | Символ | Cu |
| 106 | Атомный номер (номер в таблице) | 29 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, тяжёлый, цветной металл |
| 109 | Открыт | Известна с глубокой древности |
| 110 | Год открытия | 9000 г. до н.э. |
| 111 | Внешний вид и пр. | Пластичный металл золотисто-розового цвета (либо розового цвета при отсутствии оксидной плёнки) |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0068 % |
| 120 | Содержание в морях и океанах (по массе) | 3,0·10-7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 6,0·10-6 % |
| 122 | Содержание в Солнце (по массе) | 0,00007 % |
| 123 | Содержание в метеоритах (по массе) | 0,011 % |
| 124 | Содержание в организме человека (по массе) | 0,0001 % |
Дополнительные сведения:
| 402 | Температура плавления* | 1084,62 °C (1357,77 K, 1984,32 °F) |
| 403 | Температура кипения* | 2562 °C (2835 K, 4643 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 13,26 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 300,4 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,384 Дж/г·K (при 20 °C) |
| 410 | Молярная теплоёмкость | 24,44 Дж/(K·моль) |
| 411 | Молярный объём | 7,1 см³/моль |
| 412 | Теплопроводность | 401 Вт/(м·К) (при стандартных условиях), 401 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | 16,5 мкм/(М·К) (при 25 °С) |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | 0,000000001 мм.рт.ст. (при 672°C), 0,00000001 мм.рт.ст. (при 727°C), 0,0000001 мм.рт.ст. (при 787°C), 0,000001 мм.рт.ст. (при 857°C), 0,00001 мм.рт.ст. (при 934°C), 0,0001 мм.рт.ст. (при 1025°C), 0,001 мм.рт.ст. (при 1133°C), 0,01 мм.рт.ст. (при 1264°C), 0,1 мм.рт.ст. (при 1419°C), 1 мм.рт.ст. (при 1617°C), 10 мм.рт.ст. (при 1910°C), 100 мм.рт.ст. (при 2312°C) |
| 420 | Давление паров (Па) | 1 Па (при 1509 K), 100 кПа (при 2834 K) |
| 421 | Стандартная энтальпия образования ΔH | 0 кДж/моль (при 298 К, для состояния вещества – твердое тело), 338 кДж/моль (при 298 К, для состояния вещества – газ) |
| 422 | Стандартная энергия Гиббса образования ΔG | 0 кДж/моль (при 298 К, для состояния вещества – твердое тело) |
| 423 | Стандартная энтропия вещества S | 33,15 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело), 166,3 Дж/(моль·K) (при 298 К, для состояния вещества – газ) |
| 424 | Стандартная мольная теплоемкость Cp | 24,4 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело), |
Кристаллическая решётка меди:
500
| Кристаллическая решётка | ||
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-50-8 |
Примечание:
205* Эмпирический радиус атома меди согласно [1] и [3] составляет 128 пм.
206* Ковалентный радиус меди согласно [1] и [3] составляет 132±4 пм и 117 пм соответственно.
401* Плотность меди согласно [3] составляет 8,92 г/см 3 (при 0 °C и при нормальных условиях, состояние вещества – твердое тело).
402* Температура плавления меди согласно [3] и [4] составляет 1083,4 °С (1356,55 K, 1982,12 °F) и 1083 °С (1356,15 K, 1981,4 °F) соответственно.
403* Температура кипения меди согласно [3] и [4] составляет 2567 °С (2840,15 K, 4652,6 °F) и 2543 °C (2816,15 К, 4609,4 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) меди согласно [3] и [4] составляет 13,01 кДж/моль и 13 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) меди согласно [3] и [4] составляет 304,6 кДж/моль и 302 кДж/моль соответственно.
Источник
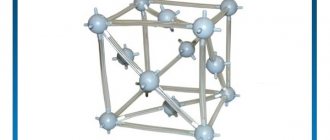
Кристаллическая решетка меди
Подскажите, как выглядит кристаллическая решетка меди? Охарактеризуйте валентные возможности атома меди (необходимо указать электронную формулу меди и число неспаренных электронов).
В виде простого вещества медь представляет собой металл красного цвета. Кристаллическая решетка меди гранецентрированная кубическая. Кристаллическая решетка представляет собой своего рода пространственный каркас, образованный пересекающимися прямыми линиями. В точках пересечения линий – узлах решетки – лежат центры частиц. Кристаллическая решетка меди – молекулярная. Это означает, что в её узлах находятся молекулы. Они связаны друг с другом межмолекулярными силами.
Рис. 1. Схематическое изображение кристаллической решетки меди.
Медь – металл, относится к элементам d-семейства. Электронная конфигурация меди выглядит следующим образом:
.
В кристаллах меди реализуется металлический тип химической связи. Металлической обычно называют связь между атомами металлов в твердом состоянии. В газовой фазе между атомами металлов имеет место обычная ковалентная неполярная связь. При образовании твердого вещества, так же как в любых кристаллах, образуются энергетические зоны – делокализованные молекулярные орбитали. В отличие от ионных кристаллов, энергетические зоны в металлических кристаллах значительно шире и даже могут перекрываться, что связано ч большой степенью перекрывания атомных орбиталей металлов и их высокими координационными числами.
Источник
Атом и молекула меди. Формула меди. Строение атома меди:
Медь (лат. Cuprum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Cu и атомным номером 29. Расположен в 11-й группе (по старой классификации – побочной подгруппе первой группы), четвертом периоде периодической системы.
Медь – металл. Относится к группе переходных металлов. Относится к тяжёлым и цветным металлам.
Медь обозначается символом Cu.
Как простое вещество медь при нормальных условиях представляет собой пластичный металл золотисто-розового цвета (либо розового цвета при отсутствии оксидной плёнки). Наряду с осмием, цезием и золотом, медь – один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов.
Молекула меди одноатомна.
Химическая формула меди Cu.
Электронная конфигурация атома меди 1s2 2s2 2p6 3s2 3p6 3d10 4s1. Потенциал ионизации (первый электрон) атома меди равен 745,48 кДж/моль (7,726380(4) эВ).
Строение атома меди. Атом меди состоит из положительно заряженного ядра (+29), вокруг которого по четырем оболочкам движутся 29 электронов. При этом 28 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку медь расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома меди – на s-орбитали находится один неспаренный электрон. В свою очередь ядро атома меди состоит из 29 протонов и 35 нейтронов.
Радиус атома меди (вычисленный) составляет 145 пм.
Атомная масса атома меди составляет 63,546(3) а. е. м.
Медь с давних пор широко используется человеком.
Медь, свойства атома, химические и физические свойства
1.1. Аморфные и кристаллические тела
В твердых телах атомы могут размещаться в пространстве двумя способами:
Аморфные вещества обладают формальными признаками твердых тел, т.е. они способны сохранять постоянный объем и форму. Однако они не имеют определенной температуры плавления или кристаллизации.
Внешние электронные орбиты атомов соприкасаются, так что плотность упаковки
атомов в кристаллической решетке весьма велика.
В кристаллитах соблюдаются ближний и дальний порядки. Это означает наличие упорядоченного расположения и стабильности как окружающих данный атом ближайших его соседей (ближний порядок
), так и атомов, находящихся от него на значительных расстояниях вплоть до границ зерен (
дальний порядок
).
Рис. 1.1. Расположение атомов в кристаллическом (а) и аморфном (б) веществе
Вследствие диффузии
отдельные атомы могут покидать свои места в узлах кристаллической решетки, однако при этом упорядоченность кристаллического строения в целом не нарушается.
Типы кристаллов металлов
Данная структура металла или его сплава характеризуется очень плотной упаковкой частиц. Ее обеспечивают ионы в узлах кристалла. Сами по себе решетки могут быть разных геометрических форм в пространстве.
- Объемноцентрическая кубическая решетка — щелочные металлы.
- Гексагональная компактная структура — все щелочноземельные, кроме бария.
- Гранецентрическая кубическая — алюминий, медь, цинк, многие переходные металлы.
- Ромбоэдрическая структура — у ртути.
- Тетрагональная — индий.
Чем тяжелее металл и чем ниже он располагается в периодической системе, тем сложнее его упаковка и пространственная организация кристалла. При этом металлическая химическая связь, примеры которой можно привести для каждого существующего металла, является определяющей при построении кристалла. Сплавы имеют очень разнообразные организации в пространстве, некоторые из них до сих пор еще не до конца изучены.
1.2. Основные типы кристаллических решеток
Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ
). Такой тип структуры называется
металлической связью
.
Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела.
объемно-центрированная кубическая (ОЦК)
гранецентрированная кубическая (ГЦК)
гексагональная плотноупакованная (ГП)
(6 атомов на ячейку)
Рис. 1.2. Основные типы кристаллических решеток металлов
Основу ОЦК-решетки составляет элементарная кубическая ячейка (рис. 1.2,б), в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы.
У ГЦК-решетки (рис. 1.2, в) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис. 1.2, г). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с
параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
У гексагональных решеток отношение параметра с
/
а
всегда больше единицы. Такую решетку имеют магний, цинк, кадмий, берилий, титан и др.
Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой. Она определяется такими показателями как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметры а
кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексагональной решеткой
а
лежит в пределах 0,228-0,398 нм, а
с
в пределах 0,357- 0,652 нм.
Параметры кристаллических решеток металлов могут быть измерены с помощью рентгеноструктурного анализа.
При подсчете числа атомов в каждой элементарной ячейке следует иметь в виду, что каждый атом входит одновременно в несколько ячеек. Например, для ГЦК-решетки, каждый атом, находящийся в вершине куба, принадлежит 8 ячейкам, а атом, центрирующий грань, двум. И лишь атом, находящийся в центре куба, полностью принадлежит данной ячейке.
Таким образом, ОЦК- и ГЦК-ячейки содержат соответственно 2 и 4 атома.
Под координационным числом
понимается количество ближайших соседей данного атома.
Рис. 1.3. Координационное число в различных кристаллических решетках для атома А:
В ОЦК решетке (рис. 1.3, а
) атом
А
(в центре) находится на наиболее близком равном расстоянии от восьми атомов, расположенных в вершинах куба, т. е. координационное число этой решетки равно 8 (К8).
В ГЦК решетке (рис. 1.3, б)
атом
А
(на грани куба) находится на наиболее близком равном расстоянии от четырех атомов /,
2, 3, 4,
расположенных в вершинах куба, от четырех атомов
5, 6, 7, 8,
расположенных на гранях куба, и, кроме того, от четырех атомов
9, 10, 11, 12,
принадлежащих расположенной рядом кристаллической ячейке. Атомы
9, 10, 11, 12
симметричны атомам 5,
6, 7, 8.
Таким образом, ГЦК решетки координационное число равно 12 (К12).
В ГПУ решетке при с/а =
1,633 (рис. 1.3, в) атом
А
в центре шестигранного основания призмы находится на наиболее близком равном расстоянии от шести атомов /,
2, 3, 4, 5, 6,
размещенных в вершинах шестигранника, и от трех атомов
7, 8, 9,
расположенных в средней плоскости призмы. Кроме того, атом
А
оказывается на таком же расстоянии еще от трех атомов
10, 11, 12,
принадлежащих кристаллической ячейке, лежащей ниже основания. Атомы
10, 11, 12
симметричны атомам
7, 8, 9.
Следовательно, для ГПУ решетки координационное число равно 12 (Г12).
Плотность упаковки представляет собой отношение суммарного объема, занимаемого собственно атомами в кристаллической решетке, к ее полному объему. Различные типы кристаллических решеток имеют разную плотность упаковки атомов. В ГЦК решетке атомы занимают 74 % всего объема кристаллической решетки, а межатомные промежутки («поры») 26 %. В ОЦК решетке атомы занимают 68 % всего объема, а «поры» 32 %. Компактность решетки зависит от особенностей электронной структуры металлов и характера связи между их атомами.
От типа кристаллической решетки сильно зависят свойства металла.
Виды химических связей в соединениях
Всего можно выделить 4 основных типа химических связей.
- Ковалентная неполярная. Образуется между двумя одинаковыми неметаллами за счет обобществления электронов, формирования общих электронных пар. В образовании ее принимают участие валентные неспаренные частицы. Примеры: галогены, кислород, водород, азот, сера, фосфор.
- Ковалентная полярная. Образуется между двумя разными неметаллами либо между очень слабым по свойствам металлом и слабым по электроотрицательности неметаллом. В основе также общие электронные пары и перетягивание их к себе тем атомом, сродство к электрону которого выше. Примеры: NH3, SiC, P2O5 и прочие.
- Водородная связь. Самая нестойкая и слабая, формируется между сильно электроотрицательным атомом одной молекулы и положительным другой. Чаще всего это происходит при растворении веществ в воде (спирта, аммиака и так далее). Благодаря такой связи могут существовать макромолекулы белков, нуклеиновых кислот, сложных углеводов и так далее.
- Ионная связь. Формируется за счет сил электростатического притяжения разнозаряженных ионов металлов и неметаллов. Чем сильнее различие по данному показателю, тем ярче выражен именно ионный характер взаимодействия. Примеры соединений: бинарные соли, сложные соединения — основания, соли.
- Металлическая связь, механизм образования которой, а также свойства, будут рассмотрены дальше. Формируется в металлах, их сплавах различного рода.
Существует такое понятие, как единство химической связи. В нем как раз и говорится о том, что нельзя каждую химическую связь рассматривать эталонно. Они все лишь условно обозначенные единицы. Ведь в основе всех взаимодействий лежит единый принцип — электронностатическое взаимодействие. Поэтому ионная, металлическая, ковалентная связь и водородная имеют единую химическую природу и являются лишь граничными случаями друг друга.
1.3. Кристаллографические направления и плоскости
Упорядоченность кристаллического строения в пространственной решетке позволяет выделить отдельные кристаллографические направления и плоскости.
Кристаллографическими плоскостями являются, например, плоскости граней кубов (рис. 1.4, б), а также их различные диагональные плоскости вместе с находящимися на них атомами (рис. 1.4, в, г). Для ГПУ-решеток кристаллографическими плоскостями могут быть плоскости оснований (рис. 1.2, г).
Для определения индекса какого-либо направления необходимо найти индекс ближайшего к данной точке отсчета атома, находящегося на данном направлении. Например, индекс ближайшего атома вдоль оси ОХ
обозначается цифрами 100 (рис. 1.4,а). Эт и цифры представляют собой координаты упомянутого атома относительно точки О, выраженные через количество параметров вдоль осей OX,
OY
и
OZ
соответственно.
Индексы направления ОХ и параллельных ему направлений обозначаются [100]. Соответственно направления OY
и
OZ
обозначаются [010] и [001]. Кристаллографические направления вдоль диагоналей граней
XOZ, XOY
и
YOZ
обозначают [101], [110] и [011]. Пользуясь указанной методикой, можно определить индекс любого направления. Например, индекс направления вдоль диагонали куба выразится так: [111].
Индексами плоскостей, параллельных плоскостям XOZ
и
YOZ,
окажутся выражения (010) и (100) (рис. 1.4, б). Индекс вертикальной диагональной плоскости куба выразится через (110), (рис. 1.2, в), а индекс наклонной плоскости, пересекающейся со всеми тремя осями координат на удалении одного параметра, примет вид (111) (см. рис. 1.4, г).
1.4. Анизотропия в кристаллах
Под анизотропией
понимается неодинаковость механических и других свойств в кристаллических телах вдоль различных кристаллографических направлений. Она является естественным следствием кристаллического строения, так как на различных кристаллографических плоскостях и вдоль различных направлений плотность атомов различна.
Например, в кубических решетках (см. рис. 1.2, б, в) по направлениям вдоль ребер насчитывается меньше атомов, чем вдоль диагоналей куба в ОЦК-решетке или диагоналей граней в ГЦК-решетке. На плоскостях, проходящих через грани ОЦК- и ГЦК-решеток, находится меньше атомов, чем на диагональных плоскостях.
Поскольку механические, физические и химические свойства вдоль различных направлений зависят от плотности находящихся на них атомов, то перечисленные свойства вдоль различных направлений в кристаллических телах должны быть неодинаковыми.
Анизотропия проявляется только в пределах одного монокристалла или зерна-кристаллита. В поликристаллических телах она не наблюдается из-за усреднения свойств по каждому направлению для огромного количества произвольно ориентированных друг относительно друга зерен. Поэтому реальные металлы являются квазиизотропными телами, т. е. псевдоизотропными.
Рис. 1.5. Элементарная ячейка решетки ОЦК
Сдвиг в кристалле происходит наиболее легко вдоль атомных плоскостей с наиболее плотной упаковкой атомов. Рассмотрим объемно-центрическую кубическую решетку (ОЦК) (рис. 1.5):
Рис. 1.6. Плоскости решетки ОЦК
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.
При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.
Рис. 3. Кристаллические ячейки составляют решётку.
1.5. Аллотропия металлов
Некоторые металлы, например, железо, титан, олово и др. способны по достижении определенных температур изменять кристаллическое строение, т. е. изменять тип элементарной ячейки своей кристаллической решетки. Это явление получило название аллотропии
или
полиморфизма
, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными.
На рис. 1.7 показано изменение свободной энергии
F
от температуры
t
для двух вариантов кристаллического строения железа: ОЦК (кривая
1
) и ГЦК (кривая
2).
В интервале температур 911-1392 о C железо имеет решетку ГЦК, так как при этом его свободная энергия меньше. При t 1392°С, у него должна быть решетка ОЦК, обладающая меньшей свободной энергией.
Значение знаний о кристаллическом строении металлов
Из вышеизложенного материала очевидно, что знания о тонкой структуре и строении позволяют спрогнозировать свойства материала и повлиять на них. И это позволяет делать наука химия. 9 класс общеобразовательной школы делает в процессе обучения упор на то, чтобы сформировать у учащихся четкое понятие о важном значении основополагающей логической цепочки: состав — строение — свойства — применение.
Сведения о кристаллическом строении металлов очень четко иллюстрирует эту зависимость и позволяет учителю наглядно объяснить и показать детям, насколько важно знать тонкую структуру, чтобы правильно и грамотно использовать все свойства.
Источник
1.6. Дефекты кристаллической решетки металла
Кристаллическая решетка, в которой отсутствуют нарушения сплошности и все узлы заполнены однородными атомами называется идеальной кристаллической решеткой металла.
В решетке реального металла могут находиться различные дефекты.
Все дефекты кристаллической решетки принято делить на точечные, линейные, поверхностные и объемные.
Точечные дефекты соизмеримы с размерами атомов. К ним относятся вакансии, т. е. незаполненные узлы решетки, межузельные атомы данного металла (рис 1.8), примесные атомы замещения, т. е. атомы, по диаметру соизмеримые с атомами данного металла и примесные атомы внедрения, имеющие очень малые размеры и поэтому находящиеся в междоузлиях (рис 1.9). Влияние этих дефектов на прочность металла может быть различным в зависимости от их количества в единице объема и характера.
Рис. 1.8. Схема образования пары вакансия-внедренный атом
Рис. 1.9. Примесные атомы внедрения и замещения
Линейные дефекты имеют длину, значительно превышающую их поперечные размеры. К ним относятся дислокации
, т. е. дефекты, образующиеся в решетке в результате смещений кристаллографических плоскостей.
Дислокации бывают двух видов.
Наиболее характерной является краевая дислокация
(рис. 1.10). Она образуется в результате возникновения в решетке так называемой полуплоскости или экстраплоскости.
Рис. 1.10. Схема краевой дислокации в идеальном кристалле
Нижний ряд экстраплоскости собственно и принято называть дислокацией.
Другим типом дислокации является винтовая дислокация
, которая представляет собой некоторую условную ось внутри кристалла, вокруг которой закручены атомные плоскости (рис.1.11).
Рис. 1.11. Схема винтовой дислокация
В винтовой дислокации, так же как в краевой, существенные искажения кристаллической решетки наблюдаются только вблизи оси, поэтому такой дефект может быть отнесен к линейным.
Дислокации обладают высокой подвижностью, поэтому существенно уменьшают прочность металла, так как облегчают образование сдвигов в зернах-кристаллитах под действием приложенных напряжений.
Дислокационный механизм сдвиговой пластической деформации
внутри кристаллов может привести к разрушению изделия. Таким образом, дислокации непосредственно влияют на прочностные характеристики металла.
На рис. 1.12 в виде кривой ABC
схематически показана зависимость прочности металла от плотности дислокаций. Точка
А
соответствует теоретической прочности металла, обусловленной необходимостью одновременного разрыва всех межатомных связей, проходящих через плоскость сдвига, в случае отсутствия дислокаций.
При увеличении количества дислокаций (см. участок АВ)
прочность резко снижается, так как на несколько порядков уменьшаются усилия, необходимые для осуществления сдвигов в зернах металла при его деформировании и разрушении.
Рис. 1.12. Зависимость предела прочности кристалла от плотности линейных дефектов(дислокаций). Кривая Одинга
При плотности дислокаций 10 6- 10 7 см-2 (точка В
на кривой), прочности минимальна, и на участке
ВС
происходит ее рост. Это объясняется тем, что с ростом плотности дислокаций их передвижение происходит не только по параллельным, но и по пересекающимся плоскостям, что существенно затрудняет процесс деформирования зерен.
Поэтому начиная с точки В
прочность металла возрастает.
Поверхностные дефекты
включают в себя главным образом границы зерен (рис.1.13). На границах кристаллическая решетка сильно искажена. В них скапливаются перемещающиеся изнутри зерен дислокации.
Из практики известно, что мелкозернистый металл прочнее крупнозернистого. Так как у последнего меньше суммарная протяженность (площадь) границ. То можно сделать вывод, что поверхностные дефекты способствуют повышению прочности металла. Поэтому создано несколько технологических способов получения мелкозернистых сплавов.
Рис.1.13. Структура границы двух соседних кристаллических зерен
Объемные дефекты
кристаллической решетки включают трещины и поры. Наличие данных дефектов, уменьшая плотность металла, снижает его прочность.
Кроме того, трещины являются сильными концентраторами напряжений, в десятки и более раз повышающими напряжения создаваемые в металле рабочими нагрузками. Последнее обстоятельство наиболее существенно влияет на прочность металла.