| Свинец | |
| Атомный номер | 82 |
| Внешний вид простого вещества | |
| Свойства атома | |
| Атомная масса (молярная масса) | 207,2 а. е. м. (/моль) |
| Радиус атома | 175 |
| Энергия ионизации (первый электрон) | 715,2 (7,41) кДж/моль () |
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 6p2 |
| Химические свойства | |
| Ковалентный радиус | 147 |
| Радиус иона | (+4e) 84 (+2e) 120 |
| Электроотрицательность (по Полингу) | 1,8 |
| Электродный потенциал | Pb←Pb2+ -0,126 В Pb←Pb4+ 0,80 В |
| Степени окисления | 4, 2 |
| Термодинамические свойства простого вещества | |
| Плотность | 11,3415 /³ |
| Молярная теплоёмкость | 26,65[1]/(·моль) |
| Теплопроводность | 35,3 /(·) |
| Температура плавления | 600,65 |
| Теплота плавления | 4,77 кДж/моль |
| Температура кипения | 2 013 |
| Теплота испарения | 177,8 кДж/моль |
| Молярный объём | 18,3 ³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 4,950 |
| Отношение c/a | n/a |
| Температура Дебая | 88,00 |
| Pb | 82 |
| 207,2 | |
| [Xe]4f145d106s26p2 | |
| Свинец | |
Свинец
— элемент главной подгруппы четвёртой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета.
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербско-хорватском, чешском, польском) свинец называется оловом. Слово с тем же значением, но похожее по произношению на «свинец», встречается только в языках балтийской группы: švinas (литовский), svins (латышский). Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber — водопроводчик (когда-то трубы зачеканивали мягким свинцом), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Казанова. Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Химические свойства свинца
Электронная формула: KLMN5s25p65d106s26p2, в соответствии с чем он имеет степени окисления +2 и +4. Свинец не очень активен химически. На металлическом разрезе свинца виден металлический блеск, постепенно исчезающий из-за образования тонкой плёнки РbО.
С кислородом образует ряд соединений Рb2О, РbО, РbО2, Рb2О3, Рb3О4. Без кислорода вода при комнатной температуре не реагирует со свинцом, но при большой температуре получают оксида свинца и водород при взаимодействии свинца и горячего водяного пара.
Оксидам РbО и РbО2 соответствуют амфотерные гидрооксиды Рb(ОН)2 и Рb(ОН)4.
При реакции Mg2Pb и разбавленной HCl получается небольшое количество РbН4. PbH4 — газозообразное вещество без запаха, которое очень легко разлагается на свинец и и водород. При большой температуре галогены образовывают со свинцом соединения вида РbХ2 (X — соответствующий галоген). Все эти соединения мало растворяются в воде. Могут быть получены галогениды и типа РbХ4. Свинец с азотом прямо не реагирует. Азид свинца Pb(N3)2 получают косвенным путём: взаимодействием растворов солей Рb (II) и соли NaN3. Сульфиды свинца можно получить при нагревании серы со свинцом, образуется сульфид PbS. Сульфид получают также пропусканием сероводорода в растворы солей Pb (II). В ряду напряжений Pb стоит левее водорода, но свинец не вытесняет водород из разбавленных HCl и H2SO4, из-за перенапряжения Н2 на Pb, а также на поверхности металла образуются плёнки трудно-растворимых хлорида РbCl2 и сульфата PbSO4, защищающие металл от дальнейшего действия кислот. Концентрированные кислоты типа H2SO4 и НCl при нагревании действуют на Pb и образуют с ним растворимые комплексные соединения состава Pb(HSO4)2 и Н2[РbCl4]. Азотная, а также некоторые органических кислоты (например, лимонная) растворяют свинец с получением солей Рb(II). По растворимости в воде соли свинца делятся на нерастворимые (напрммер, сульфат, карбонат, хромат, фосфат, молибдат и сульфид), малорастворимые (вроде, хлорид и фторид) и растворимые (к примеру,ацетат, нитрат и хлорат свинца). Соли Pb (IV) могут быть получены электролизом сильно подкисленных серной кислотой растворов солей Рb (II). Соли Pb (IV) присоединяют отрицательные ионы с образованием комплексных анионов, например, плюмбатов (РbО3)2- и (РbО4)4-, хлороплюмбатов (РbCl6)2-, гидроксоплюмбатов [Рb(ОН)6]2- и других. Концентрированные растворы едких щелочей при нагревании реагируют с Pb с выделением водорода и гидроксоплюмбитов типа Х2[Рb(ОН)4]. Еион (Ме=>Ме++e)=7,42 эВ.
Получение
Осн. источник Pb – сульфидные полиметаллич. руды. Обогащая руды (1–5% Рb) методом флотации, получают свинцовые концентраты (содержащие 40–75% Рb, 5–10% Zn, до 5% Сu, благородные металлы и Bi). Технология получения С. включает агломерирующий обжиг сульфидных концентратов, шахтную восстановит. плавку агломерата и рафинирование чернового С. При обжиге PbS окисляется кислородом воздуха, продуваемого в расплав, содержащий добавки флюсов (SiO2, CaCO3, Fe2O3): 2PbS+3О2=2РbО+2SO2. В готовом агломерате содержится 35–45% Рb и 1,2–3% S (в т. ч. в виде сульфатов). Агломерат смешивают с коксом и направляют на восстановит. плавку в шахтные печи, в которые подаётся воздух или воздушно-кислородная смесь. В печи протекает двухстадийная экзотермич. реакция (2PbS+3O2=2PbO+2SO2 и PbS+2РbО=3Рb+SO2), продукт которой – черновой С. (извлечение Рb достигает 90–94%). Отходы процесса плавки (шлаки) направляются на дальнейшую переработку для извлечения Zn. Образующаяся при шахтной плавке (и агломерации) пыль служит исходным сырьём для извлечения редких и рассеянных элементов. Черновой С. содержит 93–98% Рb и примеси: Сu (1–5%), Sb, As, Sn (0,5–3%), Bi (0,05–0,4%) и др. Очистку чернового С. производят пирометаллургич. или электролитич. способом. Объём мирового произ-ва С. ок. 9 млн. т/год.
Основные соединения свинца
Оксиды свинца
Оксиды свинца имеют преимущественно основный или амфотерный характер. Многие из них окрашены в красные, жёлтые, чёрные, коричневые цвета. На фотографии в начале статьи, на поверхности свинцовой отливки, в её центре видны цвета побежалости — это тонкая плёнка оксидов свинца, образовавшаяся из-за окисления горячего металла на воздухе.
Галогениды свинца
Халькогениды свинца
Халькогениды свинца — сульфид свинца, селенид свинца и теллурид свинца — представляют собой кристаллы чёрного цвета, которые являются узкозонными полупроводниками.
Соли свинца
Сульфат свинца Нитрат свинца Ацетат свинца
— свинцовый сахар, относится к очень ядовитым веществам. Ацетат свинца, или свинцовый сахар, Pb(CH3COO)2·3H2O существует в виде бесцветных кристаллов или белого порошка, медленно выветривающегося с потерей гидратной воды. Соединение хорошо растворимо в воде. Оно обладает вяжущим действием, но так как содержит ионы ядовитого свинца, то применяется как наружное в ветеринарии. Ацетат применяют также в аналитической химии, крашении, ситценабивном деле, как наполнитель шёлка и для получения других соединений свинца. Основной ацетат свинца Pb(CH3COO)2·Pb(OH)2 — менее растворимый в воде белый порошок — используется для обесцвечивания органических растворов и очистки растворов сахара перед анализом.
Косметика, водопровод, типографские литеры…
В Британском музее есть свинцовая статуэтка женщины из Египта, датируется она третьим тысячелетием до нашей эры. Это самый древний (официально) свинцовый предмет. Египтяне (более-менее состоятельные) считали неприличным выйти на улицу, не подкрасив глаза. Потому и рынок косметики был хорошо развит. Для подводки глаз использовали черный сульфид или белый карбонат свинца. Жировой основой служил гусиный жир. Вороной блеск древнеегипетских шевелюр зачастую достигался вульгарной окраской пастой из оксида свинца.
Великая Римская Империя
Вечный город оставил после себя вечные дороги (до сих пор некоторые вполне годны), вечное римское право (которое, несмотря на древний возраст, до сих пор изучают юристы), и акведуки. По ним с гор доставлялась для жителей вода. В разветвленной системе водопровода использовались свинцовые трубы.
Римляне уделяли водоснабжению огромное значение. Секст Юлий Фронтин, живший в первом веке н.э., написал целую книгу «О водопроводах».
Свинцовые трубы древнеримского водопровода с надписями
Вот пара цитат из нее:
«труба делается сворачиванием в круг свинцовой пластины в пять пальцев шириной.
…Все кураторы … до своего назначения побывали консулами, что указывает на высокий статус куратора вод».
Время, вперед!
С развитием типографского дела свинца требовалось все больше. Его применяли для изготовления типографских литер. Изобретение аккумуляторов и развитие автомобилестроения подхлестнули добычу металла. И бытовые, но нужные мелочи, вроде пигментов свинцовых соединений для красок до сих пор востребованы.
Папская булла 1637 года со свинцовой печатью
Так назвали…
Происхождение названия металла неявно до сих пор. В старину олово и свинец частенько путали, хотя просвещенные люди (тот же Плиний) различали их: Plumbum nigrum (свинец), Plumbum album (олово). Для англичан водопроводчик — plumber.
Познавательно: в Венеции была тюрьма Пьомби; ее еще называли Свинцовая. В ней сидел и из нее ухитрился удрать любовник всех времен и народов Казанова.
Во многих славянских языках нашего героя называют оловом. Хотя в старорусском это (свинець), словенском (svinec), на белорусском (свінец). А вот в языках Прибалтики названия похожи — svinas (литовский), svin (латышский).
Есть версия: слово однокоренное со словом «свин», свинья, чушка — слиток грязного металла. Рекомендуем: МАРГАНЕЦ — мечта сталелитейщиков
Применение свинца
Свинец в народном хозяйстве
Нитрат свинца
применяется для производства мощных смесевых взрывчатых веществ. Азид свинца применяется как наиболее широкоупотребляемый детонатор (инициирующее взрывчатое вещество). Перхлорат свинца используется для приготовления тяжелой жидкости (плотность 2,6 г/см³), используемой во флотационном обогащении руд, он иногда применяется в мощных смесевых взрывчатых веществах как окислитель. Фторид свинца самостоятельно, а так же совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока. Висмутат свинца, сульфид свинца PbS, иодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях. Хлорид свинца PbCl2 в качестве катодного материала в резервных источниках тока. Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников. Двуокись свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но так же на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и др.
Свинцовые белила
, основной карбонат Pb(OH)2•PbCO3, плотный белый порошок, — получается из свинца на воздухе под действием углекислого газа и уксусной кислоты. Использование свинцовых белил в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода H2S. Свинцовые белила применяют также для производства шпатлевки, в технологии цемента и свинцовокарбонатной бумаги. Арсенат и арсенит свинца применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика). Борат свинца Pb(BO2)2·H2O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора. Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония NH4Cl. Его применяют для приготовления мазей при обработке опухолей. Хромат свинца PbCrO4 известен как хромовый желтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат применяют в основном в производстве желтых пигментов. Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее ограниченного применения. В промышленности его используют в спичечном производстве, крашении и набивке текстиля, окраске рогов и гравировке. Сульфат свинца Pb(SO4)2, нерастворимый в воде белый порошок, применяют как пигмент в аккумуляторах, литографии, в технологии набивных тканей. Сульфид свинца PbS, чёрный нерастворимый в воде порошок, используют при обжиге глиняной посуды и для обнаружения ионов свинца. Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах. Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85-90 % Sn и 15-10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Соединения свинца используются в производстве красителей, красок, инсектицидов, стеклянных изделий и как добавки к бензину в виде тетраэтилсвинца (C2H5)4Pb (умеренно летучая жидкость, пары к-рой в малых концентрациях имеют сладковатый фруктовый запах, в больших-неприятный запах; Тпл = 130 °C, Ткип = 80°С/13 мм рт.ст.; плотн. 1,650 г/см³; nD2v = 1,5198; не раств. в воде, смешивается с орг. растворителями; высокотоксичен, легко проникает через кожу; ПДК = 0,005 мг/м³; ЛД50 = 12,7 мг/кг (крысы, перорально)) для повышения октанового числа.
Свинец в медицине
Экономические показатели
Цены на свинец в слитках (марка С1) в 2006 году составили в среднем 1,3—1,5 долл/кг.
Страны, крупнейшие потребители свинца в 2004 году, в тыс. тонн (по данным ILZSG):
| Китай | 1770 |
| ЕС | 1553 |
| США | 1273 |
| Корея | 286 |
Добыча и производство
По оценке Геологического бюро США запасы металла в мире достигают полутора миллиардов тонн. Основной их частью владеют страны:
- Китай;
- США;
- Россия;
- ЮАР;
- Перу;
- Канада;
- Мексика.
Годовое производство металла в мире составляет около 3 миллионов тонн. Дефицит свинца на этом рынке создает Китай. Его спрос на металл составляет около 45% мировой добычи.
Получение нашего серого героя происходит из минералов и из вторичного сырья (тонны аккумуляторов с отработавших срок машин).
3.7. Теплопроводность
Коэффициент теплопроводности λ обозначает количество тепла, передаваемого в единицу времени через единицу поверхности при единичном температурном градиенте, т. е. при перепаде температур в один градус на единицу длины стенки по нормали к тепловому потоку.
Размерность коэффициента теплопроводности: Вт/(м · К).
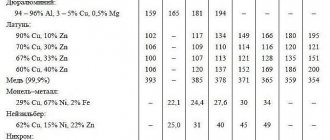
В табл. 3.7.1 приведены коэффициенты теплопроводности металлов и сплавов.
Для каждого значения λ указана температура, которой это значение соответствует. В тех случаях, когда такое указание отсутствует, данные относятся к комнатной температуре.
Таблица 3.7.1
Коэффициенты теплопроводности металлов и сплавов
Состав сплавов указан в массовых долях (кроме особо оговоренных случаев).
| Металл или сплав, масс. % | T, °С | λ, Вт/(м · К) |
| Алюминий 99 | 18 | 211 |
| 30 | 208,1 | |
| 100 | 205,2 | |
| 400 | 318,2 | |
| 600 | 422,9 | |
| Висмут | –186 | 10,47 |
| –77 | 10,76 | |
| 0 | 7,411 | |
| 100 | 6,866 | |
| 96 Bi + 3,5 Pb (объемн.) | 44 | 5,401 |
| 90 Bi + 3,5 Sn (объемн.) | 44 | 5,401 |
| 80 Bi + 20 Sb | 0 | 6,364 |
| 100 | 8,583 | |
| 50 Bi + 50 Sn | 12,5 | 23,45 |
| 50 Bi + 25 Pb + 25 Sn | 20 | 16,24 |
| 48 Bi + 26 Pb + 13 Sn + 13 Cd | 7 | 13,36 |
| Вольфрам | 0 | 160,4 |
| 2227 | 148,2 | |
| Железо | ||
| кованое чистое | 0 | 59,45 |
| 100 | 56,94 | |
| 99,92 (армко) | 20 | 73,27 |
| 100 | 67,41 | |
| Золото | 0 | 311,5 |
| 97 | 312,3 | |
| 90 Au + 10 Pd | 25 | 97,97 |
| 50 Au + 50 Pd | 25 | 36,01 |
| Иридий | 17 | 59,03 |
| Кадмий | 0 | 92,65 |
| 100 | 85,62 | |
| Калий | 5 | 97,97 |
| 20,7 | 97,13 | |
| 57,6 | 90,85 | |
| 62,9 K + 37,1 Na | 6,0 | 22,99 |
| 42,9 | 25,92 | |
| Кобальт (97,12 Co + 0,24 C + 1,4 Fe + 1,1 Ni + 0,14 Si) | 30 | 487,8 |
| Латунь | ||
| красная | 0 | 103 |
| 100 | 118,5 | |
| желтая | 0 | 85,45 |
| 100 | 106,3 | |
| Литий | 0 | 71,18 |
| 101,3 | 75,36 | |
| Магний | 0–100 | 157,4 |
| 92 Mg + 8 Al | 20–200 | 62,8–79,55 |
| 92 Mg + 8 Cu | 20–200 | 125,6–132,3 |
| 88 Mg + 10 Al + 2 Si | 20–200 | 121,4–133,1 |
| Марганец | 18 | 21,77 |
| Медь | –183 | 465,2 |
| 0 | 385,2 | |
| 100 | 385,2 | |
| 99,37 Cu + 0,63 P | 30 | 104,7 |
| 98,02 Cu + 1,98 P | 30 | 52,34 |
| 96 Cu + 3 Si + 1 Mn (эвердюр) | 20 | 33,08 |
| 84 Cu + 4 Ni + 12 Mn (манганин) | 18 | 21,73 |
| 100 | 26,42 | |
| 60 Cu + 40 Ni | 18 | 22,61 |
| 100 | 26,8 | |
| 54 Cu + 46 Ni | 18 | 20,26 |
| 89 Cu + 11 Zn | 18 | 115,1 |
| 87 Cu + 13 Zn | 18 | 126 |
| 82 Cu + 18 Zn | 18 | 131 |
| 68 Cu + 32 Zn | 18 | 108,9 |
| 62 Cu + 22 Zn + 15 Ni | 18 | |
| 52 Cu + 26 Zn + 22 Ni | 0 | 29,31 |
| 100 | 36,43 | |
| 95 Cu + 5 Al (бронза алюминиевая) | 20 | 82,48 |
| 90 Cu + 10 Sn | 20 | 41,87 |
| 75 Cu + 25 Sn (бронза оловянная) | 20 | 25,54 |
| 92,8 Cu + 5 Sn + 2 Zn + 0,15 P (бронза фосфористая) | 20 | 79,13 |
| Молибден | 17 | 144,9 |
| Натрий | 5,7 | 134,4 |
| 21,2 | 132,7 | |
| 88,1 | 120,6 | |
| Никель 99 | –160 | 54,01 |
| 18 | 58,62 | |
| Ni + (2÷3) Co | 300 | 52,75 |
| 79,5 Ni + 13 Cr + 6,5 Fe (никонель) | 70 | 15,07 |
| Олово | –170 | 81,64 |
| 0 | 64,06 | |
| 100 | 59,45 | |
| 91 Sn + 8,9 Zn | 44 | 65,73 |
| Палладий | 100 | 76,2 |
| 90 Pd + 10 Pt | 25 | 56,1 |
| 50 Pd + 50 Pt | 25 | 36,84 |
| 90 Pd + 10 Ag | 25 | 47,73 |
| 50 Pd + 50 Ag | 25 | 31,82 |
| Платина | –252,8 | 389,4 |
| –183 | 76,2 | |
| 0–200 | 69,92 | |
| 90 Pt + 10 Ir | 17 | 30,98 |
| 90 Pt + 10 Rh | 17 | 30,14 |
| 90 Pt + 10 Pd | 25 | 43,12 |
| Родий | 17 | 87,92 |
| Ртуть | ||
| твердая | –269,3 | 167,5 |
| –44,2 | 27,8 | |
| жидкая | 0 | 8,081 |
| 50 | 8,75 | |
| Свинец | 18 | 34,62 |
| 100 | 34,12 | |
| Серебро 99,9 | –160 | 417,8 |
| 0 | 458,9 | |
| 10–97 | 403,2 | |
| Серебро 99,98 | 18 | 421,2 |
| 100 | 415,3 | |
| 90 Ag + 10 Pd | 25 | 141,1 |
| 90 Ag + 10 Pt | 25 | 97,97 |
| 70 Ag + 30 Pt | 25 | 30,98 |
| Сталь | См. табл. 3.7.2 | |
| Сурьма | 0 | 18,42 |
| 0–30 | 17,58 | |
| 100 | 16,75 | |
| 70 Sb + 30 Bi | 0 | 9,797 |
| 100 | 11,76 | |
| 66,7 Sb + 33,3 Cd | 0 | 1,252 |
| 50 Sb + 50 Cd | 0 | 2,173 |
| Тантал | 17 | 54,43 |
| 1827 | 82,9 | |
| Цинк | –170 | 117,2 |
| 18 | 111 | |
| 100 | 109,7 | |
| 70 Zn + 30 Sn | 44 | 93,78 |
| Чугун | 18 | 45,64 |
| 100 | 45,22 | |
| Металл или сплав, масс. % | T, °С | λ, Вт/(м · К) |
В табл. 3.7.2–3.7.7 приведены коэффициенты теплопроводности некоторых сталей, чистых веществ в твердом состоянии, термоизоляционных, строительных и некоторых других материалов, жидкометаллических теплоносителей, чистых органических жидкостей и хладагентов в жидком состоянии.
Таблица 3.7.2
Коэффициенты теплопроводности λ (Вт/(м · К)) некоторых сталей
| Группа стали | Температура, °С | |||||||
| 100 | 200 | 300 | 400 | 500 | 600 | 700 | 800 | |
| Углеродистая: марка 15 | 54,4 | 50,2 | 46,1 | 41,9 | 37,7 | 33,5 | ||
| марка 30 | 50,2 | 46,1 | 41,9 | 37,7 | 33,5 | 29,3 | ||
| Молибденовая | 41,9 | |||||||
| Хромистая | 22,4 | 21,2 | 23,5 | 22 | ||||
| Хромомолибденовая: Х10С2М (ЭИ107) | 18,4 | 0 | 21,7 | 24,7 | 22 | |||
| 12 ХМ | 37,7 | 35,6 | 33,5 | |||||
| Хромоникелевая | 16,9 | 19,2 | 21,5 | 24,4 | 26,7 | 29,7 | 32,6 | 36,1 |
| Хромоникельвольфрамовая | 15,5 | 0 | 18,1 | 21,2 | 22 | |||
Таблица 3.7.3
Коэффициенты теплопроводности некоторых чистых веществ в твердом состоянии
| Название | Формула | T, °С | λ, Вт/(м · К) |
| Алюминия оксид: | Al2O3 | ||
| порошок | 46,8 | 0,678 | |
| плавленый | 650–1350 | 3,349 | |
| Графит (плотность 1580 кг/м3): | С | ||
| ¦оси | 50 | 44,17 | |
| + оси | 142 | 17,84 | |
| 555 | 116,8 | ||
| Графит (порошок, плотность 700 кг/м3) | С | 40 | 1,193 |
| Кадмия оксид (прессов. порошок) | CdO | 46,5 | 0,682 |
| Калия иодид | KI | 0 | 5,024 |
| Калия хлорид | KCl | 0 | 6,95 |
| Кобальта(III) оксид (прессов. порошок) | Со2О3 | 48,5 | 0,419 |
| Кремния карбид (карборунд) | SiC | 650–1350 | 15,57 |
| Кремния диоксид (кварц): | SiO2 | ||
| ¦оси | 0 | 13,61 | |
| 100 | 9,002 | ||
| + оси | 0 | 7,247 | |
| 100 | 5,581 | ||
| Магния оксид (прессов. порошок, плотность 797 кг/м3) | MgO | 47,6 | 0,607 |
| Меди(II) оксид (прессов. порошок) | CuO | 45,6 | 1,013 |
| Натрия хлорид | NaCl | 0 | 1,116 |
| Нафталин | С10Н8 | 0 | 0,377 |
| 1-Нафтол | С10Н8О | 35 | 0,293 |
| 2-Нафтол | С10Н8О | 35 | 0,335 |
| Никеля(III) оксид (прессов. порошок, плотность 1445 кг/м3) | Ni2O3 | 46,2 | 0,938 |
| Сера: | S | ||
| ромбическая | 0 | 0,293 | |
| пластическая | 20–100 | 0,264 | |
| Серебра бромид | AgBr | 0 | 1,03 |
| Серебра хлорид | AgCl | 0 | 1,089 |
Таблица 3.7.4
Коэффициенты теплопроводности термоизоляционных, строительных и некоторых других материалов
| Материал | T, °С | λ, Вт/(м · К) |
| Асбестовая ткань | 20 | 0,279 |
| Асбестовое волокно | 0 | 0,112 |
| 100 | 0,121 | |
| Асбестовый картон | 100 | 0,144 |
| Асфальт | 20 | 0,744 |
| Базальт | 20 | 2,175 |
| Бетон | 20 | 0,922 |
| Боксит | 600 | 0,557 |
| Войлок шерстяной | 40 | 0,073 |
| Гипс | 0 | 1,297 |
| Глина огнеупорная | 300–600 | 0,875–0,925 |
| Гранит | 20 | 3,419 |
| Дерево: | ||
| береза (10,8 % влажности), + волокнам | 29 | 0,172 |
| дуб (плотность 825 кг/м3), + волокнам | 15 | 0,209 |
| дуб (плотность 819 кг/м3), ¦ волокнам | 20 | 0,349 |
| Диатомитовая земля | 20 | 0,055 |
| Древесный уголь | 81 | 0,076 |
| Известняк | 0 | 2,07 |
| Известь глинистая | 20 | 3,256 |
| Каменный уголь | 20 | 0,186 |
| Картон гофрированный | 0,064 | |
| Кирпич: | ||
| изоляционный | 100 | 0,14 |
| огнеупорный | 200 | 1,006 |
| строительный | 20 | 0,233–0,291 |
| Клинкер | 30 | 0,163 |
| Кокс порошкообразный | 100 | 0,191 |
| Лед | 0 | 2,25 |
| –95 | 3,954 | |
| Магнезит | 1000 | 1,663 |
| Мрамор: | ||
| белый | 3,268 | |
| черный | 30 | 2,861 |
| Накипь котельная | 65 | 1,31–3,14 |
| Оникс | 30 | 2,34 |
| Опилки древесные | 20 | 0,07 |
| Парафин | 20 | 0,267 |
| Песок: | ||
| сухой | 20 | 0,326 |
| влажный | 20 | 1,13 |
| Песчаник (плотность 2259 кг/м3) | 40 | 1,84 |
| Портландцемент | 30 | 0,302 |
| Пробка гранулированная | 20 | 0,038 |
| Пробковая пластина | 30 | 0,042 |
| Резина мягкая | 20 | 0,167 |
| Сланец | 100 | 1,49 |
| Слюда | 0,582 | |
| Снег: | ||
| свежевыпавший | 0,105 | |
| уплотненный | 0,048 | |
| Стеклянная вата | 0 | 0,037 |
| Текстолит | 20 | 0,645–0,93 |
| Торфоплиты | 50 | 0,064 |
| Фарфор | 95 | 1,04 |
| Фибра (пластины) | 20 | 0,049 |
| Флюорит | 0 | 10,4 |
| Шерсть минеральная | 50 | 0,047 |
| Шлакобетон | 0,93 | |
| Шлаковая вата | 100 | 0,07 |
| Штукатурка | 20 | 0,779 |
| Хлопок (плотность 81 кг/м3) | 0 | 0,057 |
| Эбонит | 0 | 0,158 |
| Материал | T, °С | λ, Вт/(м · К) |
Таблица 3.7.5
Коэффициенты теплопроводности λ (Вт/(м · К)) некоторых жидкометаллических теплоносителей
| Теплоноситель | Температура, °С | ||||||||||
| 0 | 50 | 100 | 150 | 200 | 250 | 300 | 400 | 500 | 600 | 700 | |
| Висмут (Tпл = 271,3 °С; Tкип = 1560 °С) | 14,7 | 15,6 | 16,5 | 17,3 | 18,3 | ||||||
| Калий (Tпл = 63,6 °С; Tкип = 776 °С) | 46,5 | 46,4 | 45,9 | 44,9 | 43,4 | 39,5 | 34,9 | 30,9 | 28,3 | ||
| Литий (Tпл = 180 °С; Tкип = 1350 °С) | 46,1 | 46,3 | 46,6 | 47,1 | 47,6 | 48 | 48,5 | ||||
| Натрий (Tпл = 97,8 °С; Tкип = 900 °С) | 86,1 | 84,1 | 81,6 | 78,7 | 75,5 | 68,7 | 63,8 | 60,6 | 59,1 | ||
| Олово (Tпл = 231,9 °С; Tкип = 2720 °С) | 30,7 | 31,6 | 33,6 | 35,5 | 37,4 | 39,4 | |||||
| Ртуть (Tпл = –38,9 °С; Tкип = 356,6 °С) | 7,79 | 8,43 | 9,07 | 9,71 | 10,4 | 11 | 11,6 | 12,6 | 13,3 | ||
| Свинец (Tпл = 327,3 °С; Tкип = 1751 °С) | 15,1 | 15,5 | 15,9 | 17,7 | |||||||
| Сплав натрий—калий: 25 % Na + 75 % K (Tпл = 11 °С; Tкип = 784 °С) | 22,7 | 23,3 | 23,8 | 24,5 | 25,1 | 25,8 | 27,1 | 28,4 | 29,7 | 30,9 | |
| Сплав свинец—висмут: 44 % Pb + 55,5 % Bi (Tпл = 123,5 °С; Tкип = 1670 °С) | 11,2 | 11,7 | 12,2 | 12,7 | 13,7 | 14,7 | 15,8 | 16,7 | |||
Таблица 3.7.6
Коэффициенты теплопроводности чистых органических жидкостей
| Название | Формула | T, °С | λ, Вт/(м · К) |
| Анилин | С6H7N | 16,5 | 0,1774 |
| Ацетальдегид | С2H4O | 21 | 0,1712 |
| Ацетон | С3Н6О | 16 | 0,1902 |
| Бензол | С6Н6 | 16 | 0,1902 |
| Бромбензол | С6Н5Br | 20 | 0,1115 |
| 2-Бромбутан | C4H9Br | 12 | 0,1164 |
| 1-Бромпентан | С5H11Br | 18 | 0,0984 |
| 1-Бромпропан | С3Н7Br | 12 | 0,1076 |
| Бромэтан | С2Н5Br | 30 | 0,1198 |
| Бутан-1-ол | С4H10O | 20 | 0,1534 |
| Бутилацетат | С6Н12О2 | 20 | 0,1369 |
| Гексан | С6Н14 | 30–100 | 0,1376 |
| Гексан-1-ол | С6H14O | 30–100 | 0,1615 |
| Гептан | С7Н16 | 30 | 0,1404 |
| Гептан-1-ол | С7H16O | 70–100 | 0,1625 |
| Глицерин | С3Н8О3 | 20 | 0,2943 |
| Декан | С10Н22 | 30 | 0,1402 |
| Диизопропиловый эфир | С6Н14О | 20 | 0,1097 |
| Дифтордихлорметан (фреон-12) | СCl2F2 | 20 | 0,08248 |
| Дифторхлорметан (фреон-22) | СНClF2 | 20 | 0,09295 |
| Дихлорметан (хлористый метилен) | СН2Cl2 | 0 | 0,1218 |
| 1,2-Дихлорпропан | С3Н6Cl2 | 20–50 | 0,1254 |
| 1,2-Дихлорэтан (хлористый этилен) | С2Н4Cl2 | 20 | 0,1264 |
| Диэтиловый эфир | С4Н10О | 30 | 0,1375 |
| N,N-Диэтилэтанамин (триэтиламин) | С6Н15N | 20 | 0,121 |
| Изомасляная кислота | С4Н8О2 | 12 | 0,1424 |
| Изопропилацетат | С5Н10О2 | 20 | 0,1344 |
| 1-Изопропил-4-метилбензол (n-цимол) | С10Н14 | 30 | 0,1347 |
| 2-Изопропил-5-метилфенол (тимол) | С10H14O | 13 | 0,1311 |
| Иодбензол | С6Н5I | 30–100 | 0,1203 |
| 2-Иодбутан | С4Н9I | 12 | 0,08709 |
| 1-Иодпентан | С5H11I | 12 | 0,08499 |
| 1-Иодпропан | С3Н7I | 12 | 0,09211 |
| Иодэтан | С2Н5I | 30 | 0,111 |
| м-Крезол | С7Н8О | 20 | 0,1499 |
| n-Крезол | С7Н8О | 20 | 0,1444 |
| о-Ксилол | С8Н10 | –20÷80 | 0,1428 |
| м-Ксилол | С8Н10 | 25 | 0,1577 |
| Масляная кислота | С4Н8О2 | 12 | 0,1507 |
| Мезитилен | С11Н12 | 20 | 0,1359 |
| Метанол | СН4О | 20 | 0,2023 |
| Метилацетат | С3Н6О2 | 12 | 0,1612 |
| 3-Метилбутан-1-ол | С5H12O | 0 | 0,1478 |
| (3-Метилбутил)ацетат | С7Н14О2 | 20 | 0,1298 |
| 2-Метилпропан-1-ол | С4H10O | 20 | 0,1424 |
| 1-Метил-3-хлорбензол | С7Н7Сl | 20 | 0,1298 |
| Метилциклогексан | С7Н14 | 30 | 0,1278 |
| Муравьиная кислота | СН2О2 | 12 | 0,2713 |
| Нитробензол | С6Н5NO2 | 30–100 | 0,1636 |
| Нитрометан | СН3NO2 | 30 | 0,2153 |
| Нонан | С9Н20 | 30–100 | 0,1413 |
| Нонан-1-ол | С9H20O | 30–100 | 0,1681 |
| Октан | С8Н18 | 30 | 0,1452 |
| Октан-1-ол | С8H18O | 30–100 | 0,1663 |
| Олеиновая кислота | С18Н34О2 | 26,5 | 0,2309 |
| Пальмитиновая кислота | С16Н32О2 | 72,5 | 0,1715 |
| Пентан | С5H12 | 30 | 0,1349 |
| Пентан-1-ол | С5H12O | 30–100 | 0,1622 |
| Пентахлорэтан | С2НCl5 | 20 | 0,1254 |
| Пентилацетат | С7Н14О2 | 20 | 0,1292 |
| Пропан-1,2-диол | С3Н8О2 | 20–80 | 0,2009 |
| Пропан-1-ол | С3H8O | 12 | 0,1562 |
| Пропан-2-ол | С3H8O | 20 | 0,1408 |
| Проп-2-ен-1-ол | С3Н6O | 30 | 0,1798 |
| Пропилацетат | С5Н10О2 | 12 | 0,1369 |
| Пропилформиат | С4Н8О2 | 12 | 0,1537 |
| Пропионовая кислота | С3Н6О2 | 12 | 0,1633 |
| Стеариновая кислота | С18Н36О2 | 72,5 | 0,1601 |
| 1,1,2,2-Тетрафтор-1,2-дихлорэтан (фреон-114) | С2Cl2F4 | 30 | 0,0775 |
| Тетрахлорметан | СCl4 | 20 | 0,1034 |
| 1,1,2,2-Тетрахлорэтан | С2H2Cl4 | 20 | 0,1139 |
| Тетрахлорэтилен | ССl2=CCl2 | 20 | 0,1619 |
| Толуол | С7Н8 | 20 | 0,1349 |
| 1,1,2-Трифтор-1,2,2-трихлорэтан (фреон-113) | С2Cl3F3 | 30 | 0,09085 |
| Трихлорэтилен | СНCl=CCl2 | 20 | 0,1162 |
| Уксусная кислота | С2Н4О2 | 20 | 0,172 |
| Уксусный ангидрид | С4H6O3 | 21 | 0,2213 |
| Фтордихлорметан (фреон-21) | СНCl2F | 0,108 | |
| Фтортрихлорметан (фреон-11) | CCl3F | 20 | 0,09546 |
| Хлорбензол | C6H5Cl | 30–100 | 0,1447 |
| 2-Хлорбутан | C4H9Cl | 12 | 0,1164 |
| Хлорметан | СН3Сl | –15÷30 | 0,1925 |
| Хлороформ | СНСl3 | 20 | 0,103 |
| 1-Хлорпентан | С5H11Cl | 12 | 0,1185 |
| 1-Хлорпропан | С3Н7Cl | 12 | 0,1185 |
| Этанол | С2H6O | 20 | 0,1673 |
| Этилацетат | С4Н8О2 | 16 | 0,1491 |
| Этилбензол | С8Н10 | 20 | 0,1323 |
| Этиленгликоль | С2Н6О2 | 20 | 0,2611 |
| Название | Формула | T, °С | λ, Вт/(м · К) |
Таблица 3.7.7
Коэффициенты теплопроводности λ (Вт/(м · К)) некоторых хладагентов в жидком состоянии
| Хладагент | Формула | Температура, °С | ||||||
| –30 | –20 | –10 | 0 | 10 | 20 | 30 | ||
| Аммиак | NH3 | 0,57 | 0,57 | 0,558 | 0,547 | 0,518 | ||
| Дифтордихлорметан (фреон-12) | СCl2F2 | 0,106 | 0,101 | 0,097 | 0,092 | 0,087 | 0,083 | 0,078 |
| Серы диоксид | SO2 | 0,223 | 0,207 | 0,212 | 0,205 | 0,199 | 0,193 | |
| Углерода диоксид | СО2 | 0,151 | 0,14 | 0,128 | 0,116 | 0,093 | 0,07 | |
| Фтортрихлорметан (фреон-11) | CCl3F | 0,12 | 0,115 | 0,11 | 0,106 | 0,101 | 0,095 | 0,091 |
| Хлорметан | СН3Cl | 0,188 | 0,179 | 0,171 | 0,162 | 0,154 | ||