История использования алюминия в быту
В то время как немцы готовили на эмалированной посуде, а британцы использовали эту посуду для дезинфекции домов и больниц. Наполеон Бонапарт во Франции потребовал служащим разносить еду в алюминиевых тарелках, которые стоили дороже, чем золотые. Добытый металл продавался за шестьсот долларов за фунт, и в 1820-х годах Европейское дворянство готово было заменить некоторые золотые и серебряные столовые приборы на алюминиевые.
Однако алюминий быстро терял свой блеск. Добыча металла позволила сбить цену до $ 2,25 фунта в 1890 году. Несмотря на низкую цену, домохозяйки еще не знали о преимуществах приготовления пищи в алюминиевой посуде.
23 февраля 1886 года 22-летний изобретатель Чарльз Мартин Холл, экспериментировал с алюминием в лаборатории в Оберлин, штат Огайо. Записи блокнота Холла говорят, что он усовершенствовал процедуру недорогого производства алюминиевого соединения, которое могло быть использовано в посуде.
Изготовления Холла встретили грозное сопротивление. Домохозяйки не хотели отказываться от своих проверенных жестяных изделий. Крупные универмаги страны отказывались снабжаться новым продуктом, преимущества, которого звучали чересчур фантастическими, чтобы казаться правдой. Поворотный момент наступил весной 1903 года.
Один известный магазин в Филадельфии представил публичную демонстрацию по приготовлению еды в алюминиевой посуде. Сотни женщин с удивлением наблюдали, как профессиональный шеф-повар готовил яблочное повидло. Как только зрителям разрешили сделать шаг вперед и удостовериться в том, что ингредиенты не прилипли к кастрюле, заказы на алюминиевой посуду сразу посыпались.
К моменту смерти Холла в 1914 году его состоянии оценивалось на сумму 30 млн.долларов, он породил новую кухонную алюминиевую посуду, которая преобразовала американскую кухню.
Основные области применения алюминия
Данный конструкционный металл имеет широкое распространение. В частности именно с его использования начали свою работу авиастроение, ракетостроение, пищевая промышленность и изготовление посуды. Благодаря своим особенностям алюминий позволяет улучшить маневренность судов за счет меньшей массы.
Отдельно стоит упомянуть способность металла проводить ток. Такая особенность позволила сделать его главным конкурентом меди. Он активно применяется при производстве микросхем и в целом в области микроэлектроники.
Наиболее популярными сферами использования можно назвать:
- Авиастроение: насосы, двигатели, корпуса и прочие элементы;
- Ракетостроение: как горючий компонент для ракетного топлива;
- Судостроение: корпуса и палубные надстройки;
- Электроника: провода, кабели, выпрямители;
- Оборонное производство: автоматы, танки, самолеты, различные установки;
- Строительство: лестницы, рамы, отделка;
- Область ЖД: цистерны для нефтепродуктов, детали, рамы для вагонов;
- Автомобилестроение: бампера, радиаторы;
- Быт: фольга, посуда, зеркала, мелкие приборы.
Широкое распространение объясняется преимуществами металла, однако есть у него и существенный недостаток – это невысокая прочность. Чтобы минимизировать его, в металл добавляется медь и магний.
Микроскопическая структура
Характерные свойства металлов можно понять исходя из их внутренней структуры. Все они имеют слабую связь электронов внешнего энергетического уровня (другими словами, валентных электронов) с ядром. Результирующая разница потенциалов в проводнике приводит к лавинообразному движению электронов (так называемых электронов проводимости) в кристаллической решетке. Сочетание этих электронов часто называют электронным газом. В дополнение к электронам, фононы (колебания решетки) способствуют теплопроводности. Пластичность обусловлена небольшим энергетическим барьером для движения дислокаций и смещением кристаллографических плоскостей. Твердость может быть объяснена большим количеством структурных дефектов (межузловые атомы, вакансии и т.д.).
Благодаря небольшой отдаче электронов возможно окисление металла, что может привести к коррозии и дальнейшему ухудшению свойств. Способность металлов к окислению можно узнать из стандартного диапазона активности металлов. Этот факт подтверждает необходимость использования металлов в сочетании с другими элементами (сплав, важнейшим элементом которого является сталь), их сплавов и использования различных покрытий.
Для более корректного описания электронных свойств металлов следует использовать квантовую механику. Во всех твердых телах с достаточной симметрией энергетические уровни электронов отдельных атомов перекрываются и образуют разрешенные зоны, а зону, образованную валентными электронами, называют валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах очень широка и не все валентные электроны достаточны для ее полного заполнения.
Главной характеристикой такой частично заполненной зоны является то, что даже при минимальном приложенном напряжении в образце начинается реконструкция валентных электронов, т.е. протекающего электрического тока.
Такая же высокая подвижность электронов приводит к высокой теплопроводности и способности отражать электромагнитное излучение (что придает металлам характерный блеск).
Влияние алюминия на организм человека
Алюминий в медицине
Несмотря на то, что в больших количествах алюминий вреден для здоровья человека, он находит широкое применение в лечении ряда заболеваний.
На основе алюминия изготавливаются препараты, которые обладают обволакивающим, обезболивающим, адсорбирующим и антацидным действием. Антацидные свойства алюминия используются для снижения кислотности желудочного сока, поскольку он очень активно связывается с соляной кислотой. Показанием в данном случае может быть, например, гастрит с повышенной кислотностью (гиперацидный гастрит). Препараты алюминия находят как внутреннее, так и наружное применение.
Роль алюминия в организме человека.
Алюминий играет очень важную роль — он принимает участие в процессе регенерации (восстановления) эпителиальной и соединительной тканей, поддержания крепости костей, в образовании пептидов и фосфатных комплексов. Алюминий влияет на функцию околощитовидных желез, оказывает как активизирующее, так и тормозящее действие на пищеварительные ферменты. Человек употребляет алюминий с такими продуктами, как: овсяные хлопья, зерна ржи, зерна пшеницы, мука, горох,
рисовая крупа, картофель, киви, капуста, морковь, яблоки.
Недостаток алюминия в организме человека
Дефицит микроэлемента в организме – это настолько редкое явление, что вероятность его развития сводится к нулю.
С каждым годом количество алюминия в рационе человека стремительно возрастает.
Соединение поступает с продуктами питания, водой, пищевыми добавками (сульфатами), медикаментами, иногда – с воздухом. В медицинской практике за всю историю зафиксировано несколько единичных случаев недостаточности вещества в организме человека. Таким образом, актуальной проблемой XXІ века выступает скорее перенасыщение ежедневного меню элементом, чем развитием его недостаточности.
Несмотря на это, рассмотрим к каким последствиям приводит дефицит алюминия в организме.
- Общая слабость, потеря сил в конечностях.
- Замедление роста, развития детей и подростков.
- Нарушение координации движений.
- Разрушение клеток, тканей и потеря их функциональности.
Данные отклонения возникают, если человек регулярно не получает суточную норму алюминия (30-50 микрограмм). Чем скуднее рацион и меньше потребление соединения, тем интенсивнее проявляются симптомы и последствия нехватки.
Избыток алюминия опасен для здоровья
Излишек микроэлемента токсичен.
Повышенное содержание алюминия опасно для здоровья человека, поскольку снижается иммунитет, а порой возникают необратимые изменения в организме, которые резко сокращают продолжительность жизни.
Характерные признаки излишка микроэлемента: снижение гемоглобина, уменьшение числа эритроцитов в крови, кашель, потеря аппетита, запоры , нервозность, психические расстройства, нарушения речи, ориентации в пространстве, помутнение рассудка. провалы памяти, конвульсии.
Помните, алюминий относится к категории иммунотоксичных микроэлементов, поэтому для сохранения здоровья нужно ежедневно следить за количеством поступающего соединения в организм.
Если алюминий считается имунотоксичным элементом для организма человека, мы решили выяснить пути попадания алюминия в организм человека.
История использования железа в быту
Железо — металл, применение которого в промышленности и быту практически не имеет границ. Доля железа в мировом производстве металлов составляет около 95 %. Применение его, как и любого другого материала, обусловлено определенными свойствами.
Железо сыграло огромную роль в развитии человеческой цивилизации. Первобытный человек начал использовать железные орудия за несколько тысячелетий до нашей эры.
Железо не утратило своего значения и поныне. Это важнейший металл современной техники. Из-за низкой прочности железо практически не используют в чистом виде.
На основе железа создают материалы, способные выдерживать действие высоких и низких температур, вакуума и высоких давлений. Они успешно противостоят агрессивным средам, переменному напряжению и т. п.
Производство железа и его сплавов постоянно растет. Эти материалы универсальны, технологичны, доступны и в массе — дешевы.
Самыми распространенными сплавами железа являются сталь и чугун.
Нержавеющая сталь — очень популярный материал для предметов домашнего обихода, его использование охватывает все: от котлов до телевизоров. Это очень популярный материал для микроволновых печей, из которого обычно производят двери и внутреннюю панель, а затем покрывают светлой акриловой эмалью, чтобы обеспечить лучшую видимость. В последние годы стало довольно популярным использование кухонной техники из нержавеющей стали, в отличие от простого белого цвета. Речь идет о холодильниках, морозильниках, посудомоечных машинах, духовках, плитах, а также чайниках и тостерах.
Чугун – прочный, но непластичный металл. Из него изготавливают предметы сантехническое оборудование (ванны, трубы, раковины, кухонные мойки), посуду, лестницы, заборы, предметы домашнего интерьера.
Положение в периодической системе Менделеева. Строение атома железа
Название: Железо (ferrum) Порядковый номер: 26 Группа: VIII Период: 4
Атомная масса: 55,847 Электроотрицательность: 1,83 Характерные степени окисления: +2 ,+3
Атом железа состоит из положительно заряженного ядра (+26), внутри которого есть 26 протонов и 30 нейтронов, а вокруг, по четырем орбитам движутся 26 электронов.
Распределение электронов по орбиталям выглядит следующим образом: 1s22s22p63s23p63d64s2.
Нахождение металлов в природе
Металлы с низкой химической активностью (Cu, Ag, Au, Pt, Hg) встречаются в виде свободных включений в породах. Большинство металлов встречается в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические вещества. Для того, чтобы извлечь чистые металлы и использовать их дальше, необходимо отделить и очистить их от руд. При необходимости выполнять сплавы и другую обработку металлов. Это исследуется наукой металлургии, которая различает руды черных металлов (на основе железа) и цветных металлов (в них нет железа, всего около 70 элементов). Исключение составляют около 16 элементов: так называемые драгоценные металлы (золото, серебро и т.д.) и некоторые другие (например, ртуть, медь), которые присутствуют без примесей.
Они также присутствуют в небольших количествах в морской воде (1,05% — 0,12%), растениях и живых организмах (которые играют важную роль).
Таким образом, содержание некоторых металлов в земной коре следующее: алюминий — 8,2%, железо — 4,1%, кальций — 4,1%, натрий — 2,3%, магний — 2,3%, калий — 2,1%, титан — 0,56%.
Металлы встречаются в природе:
- в своем первоначальном состоянии: серебро, золото, платина, медь, иногда ртуть.
- в виде оксидов: магнетит Fe3O4, гематит Fe2O3 и др.
- в виде смешанных оксидов: Каолин АІ2О3 — 2SiO2 — 2H2O, алунит (Na,K)2O — АІО3 — 2SiO2 и др.
- различных солей:
- Сульфиды: PbS галенит, NgS киноварь,
- Хлориды: сильвинит KS1, NaCl-галогенит, сильвинит KSl-NaCl, карналлит KSl — MgSl2 — 6H2O,
- Сульфаты: барит Vaso4, ангидрид Ca8O4
- Фосфат: апатит Ca3(RO4)2,
- Карбонаты: мел, мрамор SASO3, магнезит MgSO3.
Большая часть алюминия сконцентрирована в алюмосиликатах, из которых наиболее распространены полевые шпаты. Их важнейшими представителями являются ортоклазовые минералы K [AlSi3O10], альбит Na [AlSi3O10] и анорит Ca [Al2Si2O10]. Очень распространены минералы слюдяной группы, например, мусковит Kal2[AlSi3O10][OH]2 и нефелин (Na, K)2[Al2Si2O8] (используются для производства оксида алюминия, содовых изделий и цемента). Среди других минералов наиболее часто используются бокситы Al2O3*nH2O и криолит Na3AlF6. Общим продуктом разрушения пород является каолин, который состоит в основном из глинистого минерала каолинита Al2O3*2SiO2*2H2O.
Большая часть кальция встречается в природе в виде месторождений известняка и мела, состоящих в основном из кальцитового минерала CaCO3 и мрамора. Среди других пород наиболее распространены доломит CaCO3*MgCO3, ангидрит CaSO4 и гипс CaSO4*2H2O, флюорит CaF2 и апатит 3Ca3(PO4)2*Ca(F, Cl)2. Кальций в значительных количествах содержится в различных силикатах, таких как CfO*3MgO*4SiO2 (асбест) и алюмосиликатах.
Магний в природе часто встречается в виде магнезита MgCO3 и доломита, силиката Mg2SiO4 (оливин), кайнита KCl*MgSO4*3H2O и карналлита KCl*MgCl2*6H2O. Природными соединениями щелочных металлов являются NaCl*KCl-Сильвинит, NaCl-Галогенит и Na2SO4*10H2O-Мирабилит.
Железо — самый распространенный металл в мире после алюминия. Это компонент многочисленных минералов, которые образуют скопления железных руд: Гематит Fe2O3, магнетит Fe3O4, гидрогеетит HFeO2*nH2O, сидерит FeCO3 и другие.
Время от времени встречается и местное железо метеоритного или земного происхождения.
Многие металлы часто сопровождают наиболее важные природные минералы: скандий является компонентом олова, вольфрама и кадмия в качестве примеси в цинковых рудах, ниобия и тантала в оловянных рудах. Железные руды всегда сопровождаются марганцем, никелем, кобальтом, молибденом, титаном, германием, ванадием.
Основные области применения железа
Под железом зачастую подразумевают вовсе не вещество как таковое, а низкоуглеродистую электротехническую сталь – так называется сплав металла по ГОСТ. Действительно чистое железо получить непросто, и используется оно исключительно для производства магнитных материалов.
Железо является ферромагнетиком, то есть, намагничивается в присутствии магнитного поля. Однако это его свойство сильно зависит от примесей и структуры металла. Магнитные свойства абсолютного чистого железа в 100–200 раз превышают аналогичные показатели технической стали. То же самое можно сказать о величине зерна: чем крупнее зерно, тем лучше магнитные свойства вещества. Имеет значение и механическая обработка, хотя ее влияние и не столь впечатляющее. Только такое железо применяют для получения всех магнитных материалов для электротехники и магнитоприводов.
Соединения
Все металлы, используемые в производстве, делят на цветные и черные. Черные – это сплавы железа, в частности, сталь и чугун, остальные – медные, никелевые, серебряные — относятся к цветным. На долю черной металлургии приходится 95% всех металлургических процессов. Разделяются черные сплавы таким образом:
Сталь – сплав железа с углеродом и другими ингредиентами, чья массовая доля не превышает 2,14%. Углерод придает стали пластичность и твердость. В состав могут входить также марганец, фосфор, сера и так далее; нержавеющая сталь используется в строительстве и машиностроении, где требуется более высокая, чем обычно стойкость к коррозии; жаропрочные сплавы «работают» в условиях высоких температур – турбины, магистрали отопления. Жаростойкие – не окисляются при высоких температурах, что важно для многих рабочих узлов в теплотехнике.
Чугун – сплав с углеродом, где допускается большее содержание элемента – до 4,3%. Причем чугуны отличаются по своим свойствам в зависимости от того, в каком виде сплав содержит углерод: если вещество вступило в реакцию с железом, получают белый чугун, если включено в виде графита – серый; износостойкий чугун применяется для изготовления насосных деталей, тормозов, дисков сцепления; жаростойкий применяется при сооружении доменных, мартеновских, термических печей; жаропрочный используется при сооружении газовых печей, при изготовлении компрессорного оборудования, дизельных двигателей.
Злейший враг железа и его сплавов это коррозия. Автомобиль давно перестал быть роскошью , а стал средством передвижения для большинства граждан. Сейчас огромное количество автомобилей разных производителей, разных марок, но все они изготовлены из сплавов на основе железа. Мы решили выяснить автомобили каких производителей меньше подвержены коррозии и тем самым меньше доставляют хлопот своим хозяевам.
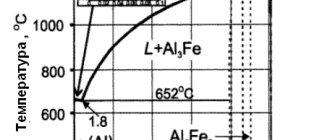
Сплав магния и наночастиц для сверхлегких самолетов
Разработанный на основе магния и кремния металл взял лучшие свойства от своих «родителей»: плотность и легкость — от магния, твердость — от кремния. Совместить эти качества в одном материале удалось благодаря особой технологии производства — карбидокремниевые наночастицы не смешиваются с магнием, а распыляются в него. Именно поэтому готовый металл прочный и пластичный, но одновременно устойчив к воздействию высоких температур.
Исследователи рассчитывают, что их изобретение найдет применение в самолето- и автомобилестроении, также материал планируют использовать в производстве медтехники и электроники.
Так выглядит поверхность нового металла под микроскопом.
Влияние железа на организм человека
Роль железа в организме
У железа очень много функций. Вот основные из них:
Транспортировка кислорода к тканям. Железо входит в состав гемоглобина — белка, из которого состоят красные кровяные тельца (эритроциты). Именно железо отвечает за захват кислорода, после чего эритроциты переносят его ко всем органам и системам организма.
Метаболизм. Железо в организме человека является составной частью многих ферментов и белков, которые необходимы для обменных процессов — разрушения и утилизации токсинов, холестеринового обмена, превращения калорий в энергию. Оно также помогает иммунной системе организма справляться с агрессорами.
Человек употребляет железо с такими продуктами, как: печень, креветки, яйца, гречневая крупа, яблоки, орехи, сыр, говядина, утка, пшеница.
Недостаток железа
Нет ничего удивительного в том, что недостаток железа отражается на внешности, здоровье и самочувствии.
При дефиците этого элемента кожа становится бледной и сухой, волосы — тусклыми и слабыми, а ногти — ломкими. В уголках губ возникают незаживающие язвочки, а на кистях рук и ступнях — очень болезненные трещины. По мере снижения количества железа в организме самочувствие ухудшается — пропадает аппетит, многие замечают дискомфорт при глотании. Иногда вкусы меняются самым странным образом, например, человеку очень хочется погрызть мел или пожевать бумагу.
Люди с нехваткой железа испытывают постоянный упадок сил — они даже просыпаются уставшими. Малейшие физические нагрузки вызывают сильную одышку — так сказывается недостаток кислорода. Другие типичные симптомы дефицита железа — головокружения и даже обмороки, сонливость, раздражительность, ухудшение памяти.
Для людей, страдающих нехваткой железа, типичны постоянные простуды и кишечные инфекции. Как мы уже говорили, железо принимает непосредственное участие в работе защитной системы организма, и при его дефиците иммунитет не может вовремя отражать атаки болезнетворных бактерий.
Наверняка многим эти симптомы покажутся очень знакомыми. Ничего удивительного: по статистике ВОЗ, примерно у 60% населения планеты отмечается недостаток железа в организме, а у 30% дефицит этого элемента так велик, что речь идет уже о железодефицитной анемии — состоянии, при котором значительно понижается уровень гемоглобина.
Практическая часть: алюминий
Пути попадания алюминия в организм человека:
алюминиевая посуда и препараты, содержащие ионы алюминия
Исследование наличия ионов алюминия в еде, приготовленной в алюминиевой посуде
Цель: Мы часто используем алюминиевую посуду, поэтому мы решили исследовать безопасность алюминевой посуды.
Опыт №1
Алюминий реагирует с водой, при этом выделяется водород и образуется нерастворимый гидроксид алюминия. 2Al + 6H2O = 2 Al(OH)3 ↓ + 3H2↑
В течении 15 минут кипятил воду в алюминиевой кастрюле, затем остудила раствор и проверила его прозрачность.
Наблюдения: Никаких изменений в пробе воды, которая кипятилась в алюминиевой посуде, не наблюдала. Проделывая этот опыт, я убедилась, что оксидная пленка на металле защищает его от взаимодействия с водой, так оксид алюминия в воде не растворяется и не реагирует с ней.
Опыт №2
Алюминий взаимодействует со щелочью, при этом образуется соль и выделяется водород.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Средство для мытья духовок и плит содержит в своём составе каустическую соду, то есть гидроксид натрия. При нанесения этого средства на алюминиевый предмет, достаточно быстро я увидел признаки реакции в виде выделяющегося газа.
Вывод: Если алюминий реагирует со щелочами, и в щелочной среде он переходит в раствор в виде солей, то приготовление и хранение пищи со щелочной реакцией среды приведет к тому, что он в виде иона он так же поступит в пищу.
Гидрофобный металл
Гидрофобные — отталкивающие воду материалы — сегодня не редкость. Однако все они по своей прочности вряд ли сравнятся с разработкой ученых из университета Рочестера. Им удалось создать гидрофобный металл. Для этого поверхность металла была обработана специальным лазером. Тончайшая гравировка придала материалу новые свойства: он, в буквальном смысле слова, отталкивает капли воды как резиновые мячики.
Сфер, где может пригодиться подобный материал, очень много. Это и самолетостроение — гидрофобный металл предотвратит обледенение воздушного судна, и кораблестроение — корпуса лайнеров будут менее подвержены коррозии.
Практическая часть: железо
Опыт «Исследование содержания железа в яблоках».
Сначала провожу опыт на красном яблоке. Разрезал красное яблоко пополам, рассмотрел поперечный срез красного яблока.
Через некоторое время одна из половинок яблока, не смазанная лимонным соком потемнела, а та, что была «защищена» лимонным соком, осталась белой.
Разрезал лимон. Одну половинку яблока смазал лимонным соком, а вторую половинку красного яблока положил на тарелку срезом вверх. То же самое, в той же последовательности проделал с зелёным яблоком. Положил обе половинки зелёного яблока на тарелку срезом вверх и стал наблюдать за изменениями.
Вывод. Потемнение происходит из-за окисления железа, которое содержится в яблоках, кислородом воздуха. Кислота, которая содержится в лимонном соке, защищает срез яблока от окисления и замедляет процесс окисления.
Я заметил, что срезы красного яблока почти совсем не потемнели, значит, железа в зелёных яблоках содержится больше и они полезнее.
Заключение
Наша жизнь немыслима без металлов. В нашей творческой работе, посвящённой железу и алюминию, я расширил свои знания об этих элементах, простых веществах металлах их свойствах и применении.
Роль железа и алюминия в развитии и становлении технической культуры человечества исключительно велика. Твёрдость, пластичность, ковкость сделали их незаменимым материалом для изготовления орудий труда и производства. Выглянув на улицу, мы видим сотни автомашин, каждая из которых сделана из железа. Из сплавов железа или алюминия изготавливают тросы, мосты, рельсы, трамваи, поезда, и наконец, самолёты. Везде металлы!… Ну и в нас самих есть эти металлы. Они используются для осуществления различных процессов в организме.
В нашей теоретической части мы охарактеризовали строение и свойства железа и алюминия, применение их в медицине и описали, что бывает при избытке и недостатке ионов этих элементов.
В результате проделанной работы мы сделали выводы:
Ионы железа и алюминия оказывают жизненно важное влияние на организм человека.
Ионы алюминия в большом количестве опасны для здоровья. Поэтому следует в алюминиевой посуде только готовить, а не хранить продукты питания. Не увлекаться употреблением таблеток от изжоги.
Ионы железа благоприятно влияют на организм человека. Поэтому необходимо употреблять продукты питания богатые железом. Такие как, хурма , яблоки, грецкие орехи.
Список использованной литературы
- Горынин И. В. и др. Алюминиевые сплавы. Применение алюминиевых сплавов. Справочное руководство. Москва «Металлургия», 1978 г.
- Хэтч Дж. Е. Алюминий. Свойства и физическое металловедение. Справочник. Москва, «Металлургия», 1989 г.
- Рабинович В. А., Хавин З. Я. Краткий химический справочник.
- Краткая химическая энциклопедия. «Советская энциклопедия», 1963 г.
- Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. «Химия», 1981 г.
- Венецкий С. И. Рассказы о металлах
- Беккерт М.. Железо. Факты и легенды.
Список литературы
- Эрочин Дж.М. Хими. Учебник / Дж.М. Эрочин. — М.: Издатель: Академия, 2003. — – 384 с.
- Иванова Р.Г. Химия: Учебник для 10 класса общеобразовательных школ. — 5 изд. / Р.Г. Иванова, А.А. Каверина — М.: Просвещение, 2002. — 174 с.
- Коровин Н.В. Общая химия / Н.В. Коровин. — М.: Издательский дом: Высшая школа, 2004. — 322 с.
- Реутов О.А. Органическая химия. В 4-х частях / О.А. Реутов, А.Л. Курц, К.П. Бутин — М.: Высшая школа, 2002. — 728 с.
- Савинкина М. А. Химия. Десятый класс. Учебник / М.А. Савинкина. — М.: Издатель: АСТ, 2003. — — 128 с.