Желе́зо – элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия). Металл средней активности, восстановитель.
Основные степени окисления – +2, +3
Простое вещество железо – ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
СТРУКТУРА
Две модификации кристаллической решетки железа
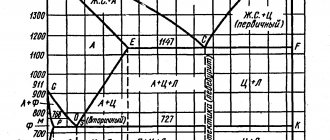
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация – γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а0 = 3,63), а низкотемпературная – α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86). В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С -а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С – аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) – д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла. В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей. При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
Состав и структура железа
Железо – типичный металл, причем химически активный. Вещество вступает в реакцию при нормальной температуре, а нагрев или повышение влажности значительно увеличивают его реакционноспособность. Железо корродирует на воздухе, горит в атмосфере чистого кислорода, а в виде мелкой пыли способно воспламениться и на воздухе.
Чистому железу присуща ковкость, однако в таком виде металл встречается очень редко. На деле под железом подразумевают сплав с небольшими долями примесей – до 0,8%, которому присущи мягкость и ковкость чистого вещества. Значение для народного хозяйства имеет сплавы с углеродом – сталь, чугун, нержавеющая сталь.
Железу присущ полиморфизм: выделяют целых 4 модификации, отличающиеся структурой и параметрами решетки:
- α-Fe – существует от нуля до +769 С. Имеет объемно-центрированную кубическую решетку и является ферромагнетиком, то есть, сохраняет намагниченность в отсутствие внешнего магнитного поля. +769 С – точки Кюри для металла;
- от +769 до +917 С появляется β-Fe. От α-фазы она отличается лишь параметрами решетки. Практически все физические свойства при этом сохраняются за исключением магнитных: железо становится парамагнетиком, то есть, способность намагничиваться оно утрачивает и втягивается в магнитное поле. Металловедение β-фазу как отдельную модификацию не рассматривает. Поскольку переход не влияет на значимые физические характеристики;
- в диапазоне от 917 до 1394 С существует γ-модификация, которой присуща гранецентрированная кубическая решетка;
- при температуре выше +1394 С появляется δ-фаза, для которой характерна объемно-центрированная кубическая решетка.
Кристаллографическая характеристика
Сингония кубическая
Класс гексоктаэдрический
Кристаллическая структура самородного железа – Объёмно-центрированная кубическая решетка (для низкотемпературной модификации)
Форма нахождения в природе
Облик кристаллов. Известны лишь микроскопически мелкие кристаллы феррита.
Двойники у самородного железа по (111) с плоскостью срастания (211), часто повторные.
Агрегаты.
Зерна, чешуйки, проволокообразные палочки, изогнутые ленты, вкрапленность в породах, иногда крупные сплошные выделения весом до нескольких тонн (феррит), часто в срастании с когенитом.
СВОЙСТВА
Железная руда
В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод. Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа – это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая – 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа – хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, – единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
Что такое железо?
С точки зрения промышленности, железо является главным соорудительным материалом в мире. Его использование повсеместно – от ручки двери до двигателей межпланетных ракет. Причинность подобной популярности проста – распространенность и дешевизна сырья, ведь железо находится на втором месте по доле в земной коре после алюминия. Символьное обозначение железа «Fe»? а его порядковый номер у Менделеева 26.
Важно: не путайте сталь и железо – это совсем разные термины. Железо является чистым химическим элементом, а сталь – сплав ферума и углерода.
Иногда железом в промышленности называют высококонцентрированный сплав с долевым содержанием примесей менее 0.7% от общей массы. В таком случае, физические свойства вещества почти не теряются. Большинство сплавов на основе железа относят к группе черных металлов.
| Преимущества железа | Недостатки металла |
| Сохранение свойств упругости при повышении прочности металла – это если речь о высококонцентрированных железных сплавах. | Слабая стойкость к коррозии. Проблему исправить можно, но себестоимость производства увеличивается. |
| Обилие ферритов дает возможность производить материалы на основе железа для любых бытовых и промышленных задач. При чем, смена свойств протекает даже с минимальными вкраплениями примесей. | Из-за накопления электричества, железо поддается коррозии электрохимического типа. По данной причине детали из железа необходимо защищать протекторами, катодами и прочими средствами защиты. |
| Легко поддается механической обработке, что увеличивает вариативность в отношении форм и видов изделий. | Удельный вес чистого железа делает конструкции из него крайне тяжелыми. |
| Магнитные свойства металла позволяют с него получать магнитоприводы. Высокая ковкость железа позволяет делать из него множество декоративных элементов. |
В чистой форме железо обладает хорошей пластичностью, что позволяет его легко ковать, но тяжело лить. Структура металла – это 5 фаз, у каждой из которых собственная кристаллическая структура и решеточные параметры. Детальнее в таблице ниже.
| Фаза | Особенности |
| α | Тип решетки – кубическая, объемно-центрированной формы. Устойчивость фаза – до 770 градусов по Цельсию. Физическая особенность – ферромагнетические свойства. |
| β | Существование фазы протекает при температурных границах от 770 до 918 градусов по Цельсию. Полное сохранение физических и химических свойств, кроме намагничивания. Железо становится парамагнетиком. Структура похожа на предыдущую фазу, но у решетки параметры незначительно отличаются. |
| γ | Температурные границы существования – от 918 градусов до 1395 градусов. Ключевое отличие – решетка кубического + гранецентрического типа. |
| δ | Имеется только нижняя температурная граница в 1395 градусов. Верхний предел отсутствует. Тип решеточной структуры – объемно-центрическая. |
| ε | У фазы не имеется четких температурных границ, но необходимое условие существования – высокое давление + подключение к чистому железу легирующих компонентов. Тип решетки – гексагоническая с плотным расположением кристаллов. |
Физические особенности железа напрямую зависят от чистоты вещества. Помимо полезных легирующих компонентов, что позитивно сказываются на свойствах металла, имеются и отрицательные элементы, способные ухудшить его характеристики. Примерами таковых может быть та же сера с фосфором, которые снижают показатели пластичности, взамен не предоставляя сплаву ничего из положительных свойств.
Базовые характеристики железа:
- вариативная плотность, зависящая от фазы пребывания металла. Обобщенный промежуток – от 7.4 до 7.9 грамма/кубический сантиметр;
- стойкость железа в чистом виде небольшая. Предел прочности у рядового технического железа – 299 МПа, но если речь о быстрорежущей стали, то здесь предел прочности возрастает до значения в 2.7 ГПа;
- чистое железо по шкале Мооса тянет на оценку в 4 балла;
- проводимость чистого ферума ниже нежели у алюминия/меди – 9.7*10^(-8);
- металл поддается ковке, но в чистом виде не поддается литью;
- низкая токсичность, но не биологическая инертность.
Усвоение железа человеческим организмом составляет всего ½ от получаемого, что делает металл для человека менее опасным, нежели другие элементы группы металлов. Главный вред окружающей среде несет не железо в чистом виде, а отходы во время производства – газы и выделяющиеся шлаки. Детальнее о производстве, тепловых характеристиках и областях применения будет рассказано далее.
10 самых крепких металлов в мире
Таблица температур плавления
Любому человеку, связанному с металлургической промышленностью, будь то сварщик, литейщик, плавильщик или ювелир, важно знать температуры, при которых происходит расплав материалов, с которыми он работает. В нижеприведенной таблице указаны точки плавления наиболее распространенных веществ.
Таблица температур плавления металлов и сплавов
| Название | T пл, °C |
| Алюминий | 660,4 |
| Медь | 1084,5 |
| Олово | 231,9 |
| Цинк | 419,5 |
| Вольфрам | 3420 |
| Никель | 1455 |
| Серебро | 960 |
| Золото | 1064,4 |
| Платина | 1768 |
| Титан | 1668 |
| Дюралюминий | 650 |
| Углеродистая сталь | 1100−1500 |
| Чугун | 1110−1400 |
| Железо | 1539 |
| Ртуть | -38,9 |
| Мельхиор | 1170 |
| Цирконий | 3530 |
| Кремний | 1414 |
| Нихром | 1400 |
| Висмут | 271,4 |
| Германий | 938,2 |
| Жесть | 1300−1500 |
| Бронза | 930−1140 |
| Кобальт | 1494 |
| Калий | 63 |
| Натрий | 93,8 |
| Латунь | 1000 |
| Магний | 650 |
| Марганец | 1246 |
| Хром | 2130 |
| Молибден | 2890 |
| Свинец | 327,4 |
| Бериллий | 1287 |
| Победит | 3150 |
| Фехраль | 1460 |
| Сурьма | 630,6 |
| карбид титана | 3150 |
| карбид циркония | 3530 |
| Галлий | 29,76 |
Помимо таблицы плавления, существует много других вспомогательных материалов. Например, ответ на вопрос, какова температура кипения железа лежит в таблице кипения веществ. Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
Плавление железа
Точкой плавления металла называют такую минимальную температуру, при которой он переходит из твердого состояния в жидкое. При этом в объеме он практически остается неизменным.
Железо входит в группу среднеплавких металлов. Железо начинает переходить в жидкое состояние лишь при температуре 1539 градусов. Это один из самых распространенных металлов, используемых в промышленности, особенно в автомобильной. Однако железо подвержено коррозии, то есть ржавчине, поэтому ему требуется специальная поверхностная обработка. Его необходимо покрывать краской или олифой, и не допускать попадание влаги.
Температура плавления железа
Температура плавления химически чистого железа составляет 1539 о С. Технически чистое железо, полученное в результате окислительного рафинирования, содержит некоторое количество растворенного в металле кислорода. По этой причине температура его плавления понижается до 1530 о С.
Температура плавления стали всегда ниже температуры плавления железа в связи с наличием в ней примесей. Растворенные в железе металлы (Mn, Cr, Ni. Co, Mo, V и др.) понижают температуру плавления металла на 1 – 3 о С на 1% введенного элемента, а элементы из группы металлоидов (C, O, S, P и др.) на 30 – 80 о С.
На протяжении большей части общей продолжительности плавки температура плавления металла изменяется главным образом в результате изменения содержания углерода. При концентрации углерода 0,1 – 1,2%, которая характерна для доводки плавки в сталеплавильных агрегатах, температуру плавления металла с достаточной для практических целей точностью можно оценить из уравнения
Теплота плавления железа
Теплота плавления железа составляет 15200 Дж/моль или 271,7 кДж/кг.
Температура кипения железа
Температура кипения железа в изданиях последних лет приводится равной 2735 о С. Однако, опубликованы результаты исследований, согласно которым температура кипения железа значительно выше (до 3230 о С).
Теплота испарения железа
Теплота испарения железа составляет 352,5 кДж/моль или 6300 кДж/кг.
Плотность железа
Плотность железапри 1550 – 1650 о С равна 6700 – 6800 кг/м 3 . При температуре кристаллизации плотность жидкого металла близка к 6850 кг/м 3 . Плотность твердого железа при температуре кристаллизации равна 7450 кг/м 3 , при комнатной температуре – 7800 кг/м 3 .
Из обычных примесей наибольшее влияние на плотность расплавов железа оказывают углерод и кремний, понижая ее. Поэтому обычного состава жидкий чугун имеет плотность 6200 – 6400 кг/м 3 , твердый при комнатной температуре – 7000 – 7200 кг/м 3 .
Источники:
- https://pressadv.ru/materialy/temperatura-kipeniya-zheleza-otvet.html
- https://chem.ru/zhelezo.html
- https://co-vally.ru/stanki/zhelezo-vikipediya-metall.html
- https://spk-kovka.ru/materialy/1-kakova-temperatura-kipeniya-zheleza.html
- https://wikimetall.ru/spravochnik/kakova-temperatura-kipenija-zheleza.html
ЗАПАСЫ И ДОБЫЧА
Железо – один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.
Железо
В земной коре железо распространено достаточно широко – на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало – в кислых и средних породах. Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты. Содержание железа в морской воде – 1·10−5-1·10−8 % В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3). Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс. Первый этап производства – восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха. Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
Свойства и характеристики железа
Железо – достаточно легкий, умеренно тугоплавкий металл, серебристо-серого цвета. Легко реагирует с разбавленными кислотами и поэтому считается элементом средней активности. На воздухе – сухом, металл постепенно покрывается пленкой оксида, которая препятствует дальнейшей реакции.
Но при самой небольшой влажности вместо пленки появляется ржавчина – рыхлая и неоднородная по составу. Ржавчина дальнейшей коррозии железа не препятствует. Однако физические свойства металла, а, главное, его сплавов с углеродом таковы, что, несмотря на низкую коррозийную стойкость, использование железа более чем оправдано.
Химический состав
Теллурическое железо содержит примеси никеля (Ni) 0,6-2%, кобальта (Со) до 0,3%, меди (Cu) до 0,4%, платины (Pt) до 0,1%, углерода. Самородное железо обычно содержит Ni в твердом растворе. Состав отдельных разновидностей точно не установлен, анализы в основном старые, выполнены на материале, не проверенном минераграфическим и рентгеновским изучением. Установлены незначительные примеси Со, Cu, S, С, Mn, Р, Pt, As, Ge, частью связанные, по-видимому, с механической примесью когенита; отмечалось наличие включений газов (СО и СО2).
Разновидности
Феррит- ferrite (Вернадский, 1912) – наиболее чистое, почти не содержащее Ni самородное железо. Аваруит – awaruite (Скей, 1885) 6 -(Ni, Fe). Самородное никель- железо с большим содержанием Ni (Ni : Fe от 4 : 1 до 2 : 1). Твердость. 5. Плотность 8,1. По блеску и цвету напоминает поликсен. В отраженном свете чисто белый, или светло-кремовый, изотропный, с высокой отражательной способностью. Назван по нахождению в заливе Аваруа (Новая Зеландия), где ассоциируется с золотом, платиной, касситеритом, хромитом, магнетитом. Встречается как вторичный минерал в перидотитах, подвергшихся серпентинизации, серпентинитах, трахитах, кварцевых порфирах. Близкие к аваруиту или идентичные с ним разновидности никель-железа земного происхождения, находимые в россыпях и в серпентинизированных перидотитах, описаны под названиями: джозефинит – josephinite (Мелвил, 1892), суэзит-souesite (Хофман, 1905), октиббегит – octibbehite (Тэйлор, 1857), катаринит – саtarinite (Дамур, 1877). Под названием бобровкита (Высоцкий, 1913) описано никель- железо (железо-никель), встреттенное в виде тонкочешуйчатых зерен вместе с платиной (поликсеном) в россыпях М. Бобровки (Урал). Содержит Ni 71,93, Fe 28,07, а также Со, Mn.
ПРОИСХОЖДЕНИЕ
Самородное железо
Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами. Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов – железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
Способы получения металла
Есть несколько способов получения железа:
- Прямые способы. Это производство губчатого железа в шахтных и тоннельных печах. Производство железной крицы во вращающихся печах. Возможно получение железа в реакторах кипящего слоя и химико-термический способ.
- Доменный процесс — распространенный метод. Железная руда и флюс восстанавливаются углеродом кокса, в результате получаем чугун. При надобности из чугуна удаляют примеси (фосфор, сера) и избытки углерода в мартеновских печах или в конвертерах. Легированную сталь получают в электрических печах (ЭПС).
- Химически чистое железо можно получить из раствора его солей с помощью электролиза.
Б. Железо метеоритное
Камасит – Kamacite – никелистое железо (6-9% Ni). Название камасит происходит от греческого -балка, стержень (Райхенбах,. 1861),
Синононим камасита -балочное железо, тэнита – ленточное железо (Райхенбах, 1861), эдмонсонит (Флайт, 1882). Плессит (Райхенбах, 1861)- тонкая смесь камасита и тэнита.
Тэнит – Taenite – никель-железо (до 48% Ni), тэнит – от Taivia -лента, полоса (Райхенбах, 1861).
Для тэнита состава Fe2Ni предложены названия: никдиферрит (Чирвинский,. 1928), ортотэнит (Бадхью, 1936) и чирвинит (Астапович, 1950); соединение такого- состава установлено в системе Fe-Ni. Метакамаситом названы метастабильная a-модификация пикелистого железа, и, кроме того, зернистая разновидность плессита (Оуэн, 1940) Метатэнит – тэнит с примесью камасита (Бадхыо, 1936).
Самородное железо космического происхождения слагает массу железных метеоритов. Встречается в большинстве каменных метеоритов. Образует:
а) сплошную массу метеорита;
б) губчатую массу, в которую погружены зерна оливина или других силикатов;
в) зерна и чешуйки, рассеянные в массе метеорита;
г) отдельные кристаллические- индивидуумы с многочисленными двойниковыми пластинками. Камасит и тэнит всегда находятся в тесном срастании. Для железных метеоритов из группы октаэдритов характерны системы пересекающихся полос, которые получили названия Видманштеттовых фигур: отдельные полосы состоят из камасита с каемками тэнита, между пересекающимися полосами находится плессит. Видманштеттовы фигуры возникают в результате распада твердого раствора γ -железа и никеля. В срастаниях камасита и тэнита плоскость ромбического додекаэдра (110) камасита параллельна плоскости октаэдра (111) тэнита, что объясняется их структурным сходством.
ПРИМЕНЕНИЕ
Кольцо из железа
Железо – один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства. Железо является основным компонентом сталей и чугунов – важнейших конструкционных материалов. Железо может входить в состав сплавов на основе других металлов – например, никелевых. Магнитная окись железа (магнетит) – важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п. Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса. Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей. Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат. Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве. Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах. Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) – Fe
| Молекулярный вес | 55.85 г/моль |
| Происхождение названия | возможно англо-саксонского происхождения |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
Добыча железа из полезных ископаемых
Руд, в которых присутствует железо, существует несколько. Однако, в качестве сырья для производства железа в промышленности используют в основном следующие:
- магнезитовую руду;
- гетитовую руду;
- гематитовую руду.
А также часто встречаются такие разновидности руды:
- леллингит;
- сидерит;
- марказит;
- ильменит;
- ярозит.
Существует еще минерал под названием мелантерит. Его используют преимущественно в фармацевтической промышленности. Из себя он представляет зелёного цвета хрупкие кристаллы, в которых присутствует стеклянный блеск. Из него производят лекарственные препараты, в составе которых имеется ферум.
Основным месторождением этого металла является Южная Америка, а именно Бразилия.
История открытия
Из школьного курса все помнят «железный век». Это период истории, когда человек впервые научился получать этот металл из руды. Железный век приходится на период с 9 по 7 век до нашей эры. Этот металл оказал огромное влияние на развитие людей того времени. По своим характеристикам он вытеснил смеси цветных металлов. Из него изготавливали орудия труда, оружие, доспехи, материалы для строительства и многое другое. Постепенно кузнецы начали смешивать его с другими металлами, чтобы получить новые материалы. Так появлялись новые сплавы.
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | железно-черный |
| Цвет черты | серый |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | несовершенная по {001} |
| Твердость (шкала Мооса) | 4,5 |
| Излом | в зазубринах |
| Прочность | ковкий |
| Плотность (измеренная) | 7.3 – 7.87 г/см3 |
| Радиоактивность (GRapi) | |
| Магнетизм | ферромагнетик |
Прочность металлов
Помимо способности перехода из твердого в жидкое состояние, одним из важных свойств материала является его прочность – возможность твердого тела сопротивлению разрушению и необратимым изменениям формы. Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа – Мега Паскалях.
Существуют следующие группы прочности металлов:
- Непрочные. Их сопротивление не превышает 50МПа. К ним относят олово, свинец, мягкощелочные металлы
- Прочные, 50−500МПа. Медь, алюминий, железо, титан. Материалы этой группы являются основой многих конструкционных сплавов.
- Высокопрочные, свыше 500МПа. Например, молибден и вольфрам.
Таблица прочности металлов
| Металл | Сопротивление, МПа |
| Медь | 200−250 |
| Серебро | 150 |
| Олово | 27 |
| Золото | 120 |
| Свинец | 18 |
| Цинк | 120−140 |
| Магний | 120−200 |
| Железо | 200−300 |
| Алюминий | 120 |
| Титан | 580 |