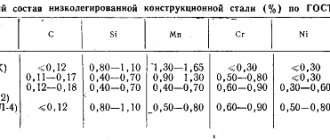
Предисловие
Таблица Менделеева или периодическая таблица химических элементов — это представленный в виде таблицы свод химических элементов, которые расположены по возрастанию атомного номера. В каждой ячейке таблицы Менделеева так же есть обозначение элемента, его атомная масса, принадлежность к определенной группе обозначенная цветом, а так же иногда указывается электронная конфигурация. Структура таблицы показывает периодических характер химических свойств элементов. Она имеет 7 строк, которые называются периодами, и столбцы, которые называются группами. Именно столбцы объединяют элементы со схожими химическими свойствами. Например, щелочные металлы, щелочно-земельные металлы, галогениды, благородные газы и т.д. Так же имеется четыре прямоугольные области, которые объединяют элементы со схожим электронным строением их атомов.
На данный момент открыто 118 химических элементов, которые завершили заполнение семи строк таблицы. Первые 94 элемента были найдены в природе, хотя некоторые в очень маленьких количествах, а вот остальные синтезированы искусственно в физических лабораториях или вообще при ядерных взрывах. В настоящее время ученые-физики продолжают попытки синтезировать 119 элемент и более тяжелые, теоретически возможность этих элементов была доказана ранее — они начнут восьмой ряд периодической таблицы Менделеева. Кроме того, все элементы имеют так называемые изотопы, которые так же в большом количестве были синтезированы в лабораториях и обнаружены в природе. Наиболее известный пример — тяжелая вода, где водород с атомным весом 1 заменяет его изотоп дейтерий (вес 2) или тритий (вес 3).
Структура периодической таблицы используется для нахождения взаимосвязи между свойствами различных элементов и их соединений, а так же для прогноза этих свойств в том числе еще не открытых соединений.
Первую известную таблицу Менделеев опубликовал в 1869 году, которая демонстрировала периодический характер свойств известных на тот момент элементов. Так же Менделеев дал предсказания по свойствам не открытых на тот момент элементов и большинство его предсказания оказались близки к верным. В последующем с открытием других элементов расширялись и теоретические знания, стали появляться всё более точные теоретические математические модели для объяснения и предсказания свойств элементов.
Современная таблица Менделеева теперь широко используется для анализа химических реакций и вообще широко используется как в химии так и физике. Однако, много споров ведется относительно того на сколько оптимален тот или иной вид таблицы (их несколько десятков), а так же размещения некоторых элементов.
Как была открыта медь
Такие металлы как медь, золото, серебро и олово были известны людям очень давно. Так как с медью легко работать, она использовалась древнейшими известными культурами уже 10000 лет назад. Пик популярности использования меди приходится начиная с 5 и заканчивая 3 тысячелетием до Нашей Эры. Это время в некоторых регионах принято называть «медным веком». Из этого металла изготавливались как орудия труда, так и украшения. На территории современного Ирана был найден медный кулон возраст которого приблизительно оценивается в 8700 год до Нашей Эры. Так же медь является первым металлом, который научились легировать с помощью олова и мышьяка до бронзы. В связи с этим открытием, которое произошло вероятно около 3 тысячелетия до Нашей Эры, началась так называемая эпоха «Бронзового века». Эта эпоха продлилась ориентировочно до первого тысячелетия до Нашей эры.
Затем производство меди и его обработка набирала уже значительные обороты. К началу новой эпохи мировое производство меди ориентировочно варьировалось в пределах 15 тонн в год. В первом тысячелетии Нашей Эры уже производились массивные сооружения из меди и его сплавов. В пример можно поставить бронзовую статую Будды храма Нара в Японии. По историческим сведениям ее отлили в 749 году. Для сооружения 16-ти метровой конструкции понадобилось 400 тонн сырья. Научное открытие самого металла можно присудить немецкому ученому Готфриду Осанну. Он изобрел порошковую металлургию, которую использовал на меди в 1830 году. В ходе своих испытаний он описал и определил атомный вес этого химического элемента.
Читайте: Никель как химический элемент таблицы Менделеева
Введение
Каждый химический элемент в таблице Менделеева имеет свой уникальный атомный номер (Z), который равен числу протонов в его атомном ядре. У каждого атома в ядре может быть разное число нейтронов и поэтому атом одного элемента может иметь разную массу — такие «варианты» одного атома отличающиеся по массе называют изотопами. Например, самые распространенные изотопы урана U235 и U238, но на самом деле изотопов известно восемь на данный момент с атомными массам от 233 до 240. Изотопы в таблице не разделяются, в ней указывается самый распространенный природный изотоп или для атомов, которые стабильных изотопов не имеют, указывается наиболее стабильный (долгоживущий).
В общепринятой периодической таблице (см. выше) химические элементы указываются в порядке возрастания атомного номера Z. Новая строка (период) начинается тогда, когда начинает заполняться новая электронная оболочка атома.
Столбцы (группы) определяются электронной конфигурацией атома. Элементы с одинаковым чистом электронов на валентном электронном уровне попадают в одни и те же группы. Элементы находящиеся в одной группе как правило имеют схожие химические свойства.
Первые 94 элемента встречаются в природе в свободном и связанном виде либо только в виде составе соединений, остальные же синтезированы в лабораториях. Некоторые элементы, например, франций (Fr) был зафиксирован только в виде излучения (получено всего 300 тыс. атомов). Другие элементы выше 94 получены так же в очень малых количествах.
Расшифровка таблицы Менделеева: как пользоваться
В статье рассмотрена расшифровка таблицы Менделеева, с помощью которой можно быстро в ней разобраться. Из таблицы Менделеева можно почерпнуть огромное количество информации о каждом химическом элементе. Ее можно использовать на ЕГЭ, если уметь грамотно ей пользоваться.
- Периодическая система Менделеева систематизирует элементы и их свойства. В ней все элементы упорядочены с учетом их атомного числа и повторяющихся химических свойств.
- Периодический закон: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Расшифровка обозначений элементов
Каждому химическому элементу в таблице отведена одна клеточка, в которой указаны символ и название элемента, порядковый номер и относительная атомная масса.
Расшифровка обозначений элементов таблицы Менделеева:
- Обозначение: одной или двумя латинскими буквами.
- Порядковый номер элемента или атомный номер равен числу протонов в его ядре. Обычно пишется в левом верхнем углу.
- Относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учетом их содержания в природе. Поэтому обычно она является дробным числом.
- Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число.
- Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
- Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
- Электронная конфигурация —
формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы. - Чтобы узнать количество нейтронов в ядре элемента, необходимо из относительной атомной массы (массового числа) вычесть порядковый номер.
Элементы периодической таблицы Менделеева
Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
- Металлы обладают хорошей электро- и теплопроводностью, способны отражать яркий свет, имеют высокую температуру плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Неметаллы встречаются в природе в трех состояниях: газ (например, водород), жидкость (например, бром) и твердые вещества (например, фосфор). Он не способны проводить тепло и электричество. Имеют более низкую температуру плавления в сравнении с металлами, более хрупкие и ломкие. Могут иметь разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Металлоиды имеют смешанные свойства металлов и неметаллов (например, кремний). Они имеют среднюю тепло- и электропроводность. Различаются между собой по температуре плавления, плотности, цвету и форме. Внешний вид может быть схож с металлами или неметаллами.
Расшифровка групп и периодов таблицы Менделеева
В таблице химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы.
Периоды — это горизонтальные ряды в таблице. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней. Номер периода, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода.
Закономерности периодов:
- Металлические свойства убывают, неметаллические и окислительные -возрастают. Каждый период начинается активным металлом и заканчивается инертным газом.
- Уменьшается атомный радиус.
- Увеличивается электроотрицательность.
Группы — это столбцы. Элементы во всех группах имеют одинаковое электронное строение внешних электронных оболочек. В каждой группе на внешнем энергетическом атома одинаковое число электронов, то есть номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей. Поэтому номер группы часто совпадает с валентностью элементов. Например, номер группы совпадает с валентностью s-элементов и с наибольшей возможной валентностью p-элементов.
Закономерности групп:
- Металлические свойства увеличиваются, неметаллические и окислительные- убывают.
- Увеличивается радиус атома элементов в рамках одной группы.
- Уменьшается электроотрицательность.
Атомное число показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Валетность
— это свойство элементов образовывать химические связи. То есть это
количество химических связей, которые образует атом иличисло
атомов, которое может присоединить или заместить атом данного элемента. Валентность бывает: постоянная и переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность: — Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами. — Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 вычесть № группы, в которой находится вещество.
Расшифровка периодов и групп периодической таблицы Менделеева
Каждый элемент имеет свой порядковый (атомный) номер, располагается в определённом периоде и определённой группе.
Периоды
- Малые периоды: первый, второй и третий периоды. В них содержится соответственно 2, 8 и 8 элементов;
- Большие периоды: остальные элементы. В четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент.
В таблице 7 периодов. В каждом содержится определённое число элементов: 1-й период — 2 элемента (малый период), 2-й период — 8 элементов (малый период), 3-й период — 8 элементов (малый период), 4-й период — 18 элементов (большой период), 5-й период — 18 элементов (большой период), 6-й период — 32 элемента (18+14) (большой период), 7-й период — 32 элемента (18+14) (большой период).
Группы и подгруппы
- Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов.
- Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
В Периодической таблице может использоваться разное обозначение групп. Поэтому согласно такому обозначению бывает разная расшифровка групп таблицы менделеева:
- 18 групп, пронумерованных арабскими цифрами.
- 8 групп, пронумерованных цифрами с добавлением букв A или B. Группы A — это главные подгруппы. Группы B — это побочные подгруппы в больших периодов. Это только металлы. IA, VIIIA — по 7 элементов; IIA — VIIA — по 6 элементов; IIIB — 32 элемента (4+14 лантаноидов +14 актиноидов); VIIIB — 12 элементов; IB, IIB, IVB — VIIB — по 4 элемента. Римский номер группы, как правило, показывает высшую валентность в оксидах (но для некоторых элементов не выполняется).
Элементы с порядковыми номерами 58–71 (лантаноиды) и 90–103 (актиноиды) вынесены из таблицы и располагаются под ней. Это элементы IIIB группы. Лантаноиды относятся к шестому периоду, а актиноиды — к седьмому.
Элементы главной подгруппы
1 группа главная подгруппа элементов (IA) — щелочные металлы.Это мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним электроном на внешней оболочке и прекрасно вступают в реакцию. Литий Li (3), Натрий Na (11), Калий K (19), Рубидий Rb (37), Цезий Cs (55), Франций Fr (87).
2 группа главная подгруппа (IIА) -щелочноземельными металлами.Имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах. Кальций Ca (20), Стронций Sr (38), Барий Ba (56), Радий Ra (88).
3 группа главная подгруппа (IIIА).Все элементы данной подгруппы, за исключением бора, металлы. Главную подгруппу составляют составляют бор, алюминий, галлий, индий и таллий. На внешнем электронном уровне элементов по три электрона. Они легко отдают эти электроны или образуют три неспаренных электрона.
4 группа главная подгруппа (IVА) . Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы).
5 группа главная подгруппа (VA). Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
6 группа главной подгруппы (VIA) . Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства.
7 группа главная подгруппа (VIIA) — галогены . (F, Cl, Br, I, At). Имеют семь электронов на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
8 группа главная подгруппа (VIIIA) — инертные (благородные) газы. (He, Ne, Ar, Kr, Xe, Rn, Og). У них полностью заполнен внешний электронный уровень. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными». У инертных газов есть способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Элементы побочной подгруппы
Элементы побочных подгрупп кроме лантаноидов и актиноидов — переходные металлы. Твёрдые (исключение жидкая ртуть), плотные, обладают характерным блеском, хорошо проводят тепло и электричество.
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
3 группа побочная подгруппа (IIIB) шестого и седьмого периодов — лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
- Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
- Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Неметаллы
Правый верхний угол таблицы до инертных газов -неметаллы. Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе.
Кислородные и водородные соединения
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения. Существует 8 форм кислородных соединений: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где R — элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют 4 формы водородных соединений: RH4, RH3, RH2, RH. Характер соединений: RH — сильнокислый; RH2 — слабокислый; RH3 — слабоосновный; RH4 — нейтральный.
Металлы, металлоиды и неметаллы
По своим физико-химическим свойствам все элементы можно разделить на три основные категории — металлы, металлоиды и неметаллы.
Металлы — это как правило блестящие высоко теплопроводные твёрдые вещества способные плавиться при нагревании и образовывать друг с другом сплавы, а так же образовывать ионные и ковалентные соединения с неметаллами.
Неметаллы — это как правило бесцветные либо цветные твёрдые, жидкие или газообразные вещества. Неметаллые образуют соединения друг с другом при помощи ковалентных связей.
Металлоиды — это вещества, которые могут проявлять в определенных условиях как металлические свойства, так и неметаллические.
Металлы и неметаллы могут быть дополнительно классифицированы на подкатегории, которые видны в таблице в строках слева направо. Так металлы подразделяются на химически очень активные щелочные металлы, чуть менее активные щелочно-земельные, характерные переходные металлы и химически достаточно инертные постпереходные металлы.
Неметаллы подразделяются на многоатомные неметаллы, при этом они ближе к металлоидам т.к. иногда проявляют металлические свойства, на галогениды и инертные газы. Доля неметаллов среди всех элементов небольшая — их 19 из 118 известных элементов.
На самом же деле такое подразделение даже внутри каждой категории весьма условно и на этих условных границах есть большое «перекрытие». Например, бериллий относится к щелочно-земельным элементам, но его амфотерность и склонность образовывать ковалентные соединения позволяют относить его к постпереходным металлам. Радон относится к благородным газам, но образует ряд ионных соединений характерных для металлов. Поэтому существуют и другие типы разделения элементов на группы, например, по минералогическим признакам или кристаллическим структурам соединений.
Щелочные и щелочно-земельные металлы
Эти две категории очень похожи друг на друга, но щелочно-земельные металлы менее химически активны. Все они образуют основные оксиды. Для них характерна низкая механическая прочность, все щелочные металлы легко режутся ножом, очень высокая химическая активность (например, калий, и тем более рубидий могут воспламеняться прямо на воздухе, а с водой реагировать со «взрывом» — реакиция идет настолько быстро, что раздаётся хлопок). Магний и бериллий более твёрдые и гораздо менее реакционно способные, поэтому они используются иногда в чистом виде или в виде сплавов (магний-алюминиевый сплав очень важен в авиационной отрасли, например).
Где и как добывают медь
Как становится понятно из текста выше, такой химический элемент как медь использовался уже с древнейших времен. И добыча этого элемента уже осуществлялась еще до Нашей эры. Медь является третьим металлом по применению после железа и алюминия. Вся добытая медная руда до 1900 года составляет менее 5% от всей руды извлеченной из недр Земли. В 2008 году добыча меди превысила порог в 15 миллионов тонн в год. На сегодняшний день эта цифра готовится превысить отметку в 20 миллионов тонн. Ведущими производителями меди являются Чили, Перу, Китай, США, Конго, Австралия, Замбия, Индонезия, Мексика и Россия.
Процесс получения самой меди выглядит следующим образом. Вначале медный камень Cu2S извлекается из медного гравия CuFeS2. Для этого гравий обжигают с добавлением кокса, а оксиды железа зашлаковывают кремнеземом. Шлак из силиката железа плавает на поверхности и может быть легко слит. Медный камень, оставшийся на дне, затем перерабатывается в черновую медь. Эта процедура обычно осуществляется в два этапа. На первом этапе образовавшийся сульфид железа обжигается до оксида железа и связывается с кварцевым шлаком, который в последующем выливается. На втором этапе две трети медного камня окисляется до оксида. После этого оксид меди реагирует с оставшимся сульфидом в результате чего появляется черновая медь.
Черновая медь имеет чистоту порядка 98%, а оставшиеся 2% приходятся на примеси железа, цинка, серебра и золота. Очистка черновой меди осуществляется методом электролитического рафинирования в серной кислоте. В ходе этой реакции железо и цинк растворяются в виде катионов, а благородные металлы осаждаются на дне. Чистота меди на выходе этого процесса составляет 99,99%.
Читайте: Кобальт как химический элемент таблицы Менделеева
Переходные металлы
У этой группы очень широкий спектр физических и химических свойств. Например, температура плавления у ртути -38,8 ºC, а у иттрия 1795 ºC. Так же в очень широком диапазоне находится твёрдость, плотность, химическая активность (например, благородный металл золото очень химически инертен, а цинк наоборот весьма реакционно способен и по этому показателю ближе к щелочно-земельным элементам). Металлы этой группы — основа всех промышленных производств и сфер жизни. Они применяются во всех отраслях промышленности — от конструкционных материалов до микроэлектронной промышленности.
Галогены
Группа VIIA(17). Атомы элементов этой группы обычно получают по одному электрону, т.к. на внешнем электронном слое находится по пять элементов и до «полного комплекта» как раз не хватает одного электрона.
Наиболее известные элементы этой группы: хлор (Cl) — входит в состав соли и хлорной извести; йод (I) — элемент, играющий важную роль в деятельности щитовидной железы человека.
Электронная конфигурация:
- F — 1s22s22p5;
- Cl — 1s22s22p63s23p5;
- Br — 1s22s22p63s23p64s23d104p5
Подробнее о галогенах см. Атомы элементов VII группы: общая характеристика…
Неметаллы (реакционные)
При нормальных условиях бор, углерод, фосфор, сера, селен — твёрдые вещества различных цветов. Каждое их них имеет различные формы кристаллической решетки (аллотропные модификации), например красный, желтый, черный, белый фосфор, которая очень сильно влияет на их химическую активность (например, графит гораздо менее активен обычного угля) и физические свойства (алмаз самое твердое вещество в природе и это прозрачный материал, а графит хрупкий, мягкий, непрозрачный).
Азот и кислород — газы. При этом азот достаточно химически инертен, кислород напротив является очень активным окислителем.
Галогениды имеют разные физические свойства (фтор, хлор — газы, бром — жидкость, иод — твердое вещество). Астат получен только в крайне малых количествах как и теннессин, их свойства изучены плохо. Химически галогениды — очень сильные окислители (фтор самый сильный в Таблице Менделеева). С металлами образуют как правило соли с ионной решеткой, а с водородом очень сильные кислоты. С неметаллами так же образуют множество многоатомных соединений как правило с ковалентными связями.
Формулировка периодического закона химических элементов
Русский ученый составлял наброски таблицы около 20 лет, пытаясь подобрать верную закономерность в их размещении. Отметив концепцию цикличности, он превратил её в периодический закон, изложив свое понимание правила:
«Свойства элементов, как и формируемых ими простых и сложных веществ, предполагают периодическую зависимость от их атомного веса».
Развитие науки в течение 20-го столетия несколько видоизменило закон: на смену термину «атомный вес» пришел «заряд ядра атома», вместо «простых и сложных веществ» — «веществ и соединений», к элементам добавилось определение «химическим».
Неметаллы (инертные газы)
Крайне химически пассивные вещества. Первое соединение ксенона XePtF6 было синтезировано в 1962 году, а соединения неона и гелия до сих пор неизвестны. Тем не менее инертные газы играют огромную роль в различных отраслях промышленности, медицине, при подводных погружениях и т.д.
P.S.: Интересно, что название «Таблица Менделеева» известна в основном только в России, а в остальном мире она называется чаще всего просто «Периодическая таблица».
P.P.S.: Статья будет дополняться и корректироваться.
Интересные факты
Так как применение меди очень широкое, соответственно и интересных фактов связанных с медью достаточно. Стоит начать с того, что цена на чистую медь на мировом рынке не такая уж и маленькая. В 2014 году 1 тонна меди на мировом рынке оценивалась в 7000 американских долларов. В связи с такой высокой ценой увеличилось количество краж медных предметов. Например в Германии железнодорожная кампания Deutsche Bahn AG понесла убытков на 14 миллионов евро из-за воровства медных заземляющих железнодорожных кабелей.
Еще одним интересным моментом является то, что первые изобретенные человеком зеркала изготавливались именно из меди. Медь натиралась(полировалась) до такой степени, пока не было видно отбражение на поверхности меди. Так же в области применения стоит отметить, что большая часть монет произведенных по всему миру содержит в своем составе медь. Еще одним интересным фактом является то, что медь как железо и алюминий могут подвергаться вторичной переработке без потери своих свойств.
Так же можно отметить и биологическую составляющую меди. В больших количествах она является токсичной, а в малых — неотъемлемая часть существования организма человека. В различных состояниях в человеческом организме содержится около 150 мг меди. Суточная доза потребления меди является нормальной для человека весом 75 кг равной 2 мг.