Алюминий
Алюминий вошел в промышленное и бытовое применение относительно не так давно. На пересечении XIX – XX было освоено производство этого металла в промышленных масштабах.
Все дело в том, что началось производство множества товаров, в которых алюминий широко применялся, например, при строительстве катеров, железнодорожных вагонов и пр.
Кстати, именно тогда был показан широкой публике автомобиль с кузовом, выполненным из алюминия.
Анодированный алюминий
Состав и структура алюминия
Алюминий – это самый распространенный в земной коре металл. Его относят к легким металлам. Он обладает небольшой плотностью и массой. Кроме того, у него довольно низкая температура плавления. В то же время он обладает высокой пластичностью и показывает хорошие тепло- и электропроводные характеристики.
Кристаллическая решетка алюминияСтруктура алюминия
Предел прочности чистого алюминия составляет всего 90 МПа. Но, если в расплав добавить некоторые вещества, например, медь и ряд других, то предел прочности резко вырастает до 700 МПа. Такого же результат можно достичь, применяя термическую обработку.
Алюминий, обладающий предельно высокой чистотой – 99,99% производят для использования в лабораторных целях. Для применения в промышленности применяют технически чистый алюминий.
При получении алюминиевых сплавов применяют такие добавки, как – железо и кремний.
Они не растворяются в расплаве алюминия, а из добавка снижает пластичность основного материала, но в то же время повышает его прочность.
Внешний вид простого вещества
Структура этого металла состоит из простейших ячеек, состоящих из четырех атомов. Такую структуру называют гранецентрической.
Проведенные расчеты показывают, что плотность чистого металла составляет 2,7 кг на метр кубический.
Свойства и характеристики
Алюминий – это металл с серебристо-белой поверхности. Как уже отмечалось, его плотность составляет 2,7 кг/м3. Температура составляет 660°C.
Его электропроводность равняется 65% от меди и ее сплавов. Алюминий и бо́льшая часть сплавов из него стойко воспринимает воздействие коррозии. Это связано с тем, что на его поверхности образуется оксидная пленка, которая и защищает основной материал от воздействия атмосферного воздуха.
В необработанном состоянии его прочность равна 60 МПа, но после добавления определенных добавок она вырастает до 700 МПа. Твердость в этом состоянии достигает 250 по НВ.
Алюминий хорошо обрабатывается давлением. Для удаления наклепа и восстановления пластичности после обработки алюминиевые детали подвергают отжигу, при этом температура должна лежать в пределах 350°C.
Получение алюминиевого расплава, как и многих других материалов, происходит после того, как к исходному металлу подвели тепловую энергию. Она может быть подведена как непосредственно в него, так и снаружи.
Температура плавления алюминия напрямую зависит от уровня его чистоты:
- Сверхчистый алюминий плавится при температуре 660, 3°C.
- При количестве алюминия 99,5% температура плавления составляет 657°C.
- При содержании этого металла в 99% расплав можно получить при 643°C.
Алюминиевый расплавПроцесс получения алюминия
Алюминиевый сплав может включать в свой состав различные вещества, в том числе и легирующие. Их наличие приводит к снижению температуры плавления.
Например, при наличии большого количества кремния, температура может понизиться до 500°C. На самом деле понятие температуры плавления относят к чистым металлам.
Сплавы не обладают какой-то постоянной температурой плавления. Этот процесс происходит в определенном диапазоне нагрева.
В материаловедении существует понятие – температура солидус и ликвидус.
Первая температура обозначает ту точку, в которой начинается плавление алюминия, а вторая, показывает, при какой температуре, сплав будет окончательно расплавлен. В промежутке между ними сплав будет находиться в кашеобразном состоянии.
Уменьшение температуры
Перед тем как приступать к плавке металла, можно выполнить определенные операции, которые позволят снизить температуру плавления. Например, иногда расплаву подвергают алюминиевый порошок. В порошкообразном состоянии металл начинает плавиться несколько быстрее.
Но при такой обработке возникает реальная опасность того, что при взаимодействии с кислородом, который содержится в атмосфере алюминиевый порошок, начнет окисляться с большим выделением тепла и образования оксидов металла, этот процесс происходит при температуре 2300 градусов.
Главное, в этот момент плавления не допустить контакта расплава и воды. Это приведет к взрыву.
Относительно низкая температура плавления алюминия позволяет проводить эту операцию в домашних условия.
Надо сразу отметить, что в качестве сырья в домашней мастерской использовать порошкообразную смесь слишком опасно. Поэтому в качестве сырья применяют или чушки, или нарезанную проволоку.
Если к будущему изделию нет особых требований по качеству, то для плавления можно использовать все, что изготовленного из этого металла.
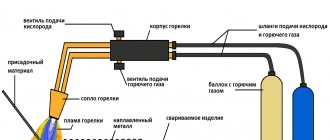
Плавка алюминия в самодельном горне
При этом не особо важно, будет сырье покрыто краской или нет. Когда происходит плавление алюминия, все посторонние вещества просто выгорят и будут удалены вместе со шлаком.
Для получения качественного результата плавки необходимо использовать материалы, которые называют флюсами. Они призваны решать задачу по связыванию и удалению из расплава посторонних примесей и загрязнений.
Домашний мастер, решивший в домашних условиях выполнять плавление алюминия должен отдавать себе отчет в том, что это довольно опасный процесс. И поэтому без применения средств защиты не обойтись.
В частности, должны быть использованы перчатки, фартук, очки. Дело в том, что температура расплава лежит в пределах 600 градусов.
Поэтому имеет смысл использовать средства защиты, которые применяют сварщики.
Использование средств защиты при плавке алюминия
Кстати, при плавлении алюминия и использовании очищающих химикатов необходимо защищать органы дыхания от продуктов их сгорания.
Выбор формы для литья
При выборе формы для отливки алюминия домашний мастер должен понимать, а для какой цели он обрабатывает алюминий. Если будущая отливка будет предназначена для использования в качестве припоя, то использовать, какие-то специальные формы, нет необходимости. Для этого можно использовать металлический лист, на котором можно остудить расплавленный металл.
Но если возникает необходимость получения даже простой детали, то мастер должен определиться с типом формы для литья.
Форму можно изготовить из гипса. Для этого, гипс в жидком состоянии заливают в обработанную маслом форму. После того, как начнет застывать, в него устанавливают литейную модель. Для того, чтобы в форму можно было залить расплавленный металл необходимо сформировать литник.
Для этого в форму устанавливают цилиндрическую деталь. Формы бывают разъемные и нет. Процесс изготовления разъемной формы усложняется тем, что модель будет находиться в двух полуформах. После застывания их разделяют, удаляют модель и соединяют снова. Форма готова к работе.
Кокиль для литья алюминия
Для получения качественных отливок целесообразно использовать металлические формы (кокили), но изготавливать их целесообразно только в заводских условиях.
Классификация
Большинство продуктов горения являются отравляющими веществами. Поэтому, говоря об их классификации, будет правильным ознакомить вас со следующим термином:
Классификация опасности веществ по степени воздействия на организм – это установление (ранжирование) уровней опасности веществ по их поражающему и повреждающему воздействию на организм человека и (или) животного. Более подробно о данной классификации читайте в материале по ссылке >>
Также ознакомьтесь с познавательным материалом по теме:
Алюминий при нагревании выделяет
Алюминий – горючий металл, атомная масса 26,98; плотность 2700 кг/м 3 , температура плавления 660,1 °С; температура кипения 2486 °С; теплота cгopания —31087 кДж/кг. Алюминиевая стружка и пыль могут загораться при местном действии малокалорийных источников зажигания (пламени спички, искры и др.).
При взаимодействии алюминиевого порошка, стружки, фольги с влагой образуется оксид алюминия и выделяется большое количество тепла, приводящее к их самовозгоранию при скоплении в кучах. Этому процессу способствует загрязненность указанных материалов маслами. Выделение свободного водорода при взаимодействии алюминиевой пыли с влагой облегчает ее взрыв.
Температура самовоспламенения образца алюминиевой пыли дисперсностью 27 мкм 520 °С; температура тления 410 °С; нижний концентрационный предел распространения пламени 40 г/м 3 ; максимальное давление взрыва 1,3 МПа; скорость нарастания давления: средняя 24,1 МПа/с, максимальна 68,6 МПа/с.
Предельная концентрация кислорода, при которой исключается воспламенение аэровзвеси электрической искрой, 3% объема. Осевшая пыль пожароопасна. Температура самовоспламенения 320 °С. Алюминий легко взаимодействует при комнатной температуре с водными растворами щелочей и аммиака с выделением водорода.
Смешивание алюминиевого порошка с щелочным водным раствором может привести к взрыву. Энергично реагирует со многими металлоидами. Алюминиевая стружка горит, например, в броме, образуя бромид алюминия. Взаимодействие алюминия с хлором и бромом происходит при комнатной температуре, с йодом — при нагревании. При нагревании алюминий соединяется с серой.
Если в пары кипящей серы всыпать порошок алюминия, то алюминий загорается. Сильно измельченный алюминий вступает в реакцию с галоидированными углеводородами; присутствующий в небольшом количестве хлорид алюминия (образующийся в процессе этой реакции) действует как катализатор, ускоряя реакцию, в ряде случаев приводящую к взрыву.
Такое явление наблюдается при нагревании порошка алюминия с хлористым метилом, четыреххлористым углеродом, смесью хлороформа и четыреххлористого углерода до температуры около 150 °С.
Алюминий в виде компактного материала не взаимодействует с четыреххлористым углеродом. Смешивание алюминиевой пыли с некоторыми хлорированными углеводородами и спиртом приводит к самовозгоранию смеси.
Смесь алюминиевого порошка с оксидом меди, оксидом серебра, оксидом свинца и особенно диоксидом свинца горит со взрывом. Смесь нитрата аммония, алюминиевого порошка с углем или нитросоединениями — взрывчатое вещество.
Средства тушения: сухой песок, глинозем, магнезитовый порошок, асбестовое одеяло. Применять воду и огнетушители запрещается.
В чистом виде алюминий в природе не встречается, потому что очень быстро окисляется кислородом воздуха с образованием прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
Алюминий и его сплавы являются наиболее распространенными среди цветных металлов материалами и находят все более широкое применение в транспорте, строительстве, упаковке, электротехнике и производстве предметов быта. Благодаря уникальному комплексу свойств они успешно выдерживают конкуренцию со стороны других конструкционных материалов, таких как сталь, бетон, дерево, пластмассы, стекло и др.
К сожалению, в России — одном из крупнейших мировых производителей первичного алюминия — использование алюминия для этих целей существенно отстает от уровня развитых стран. Из произведенного в прошлом году 3,76 млн. т алюминия только немногим более 600 тыс. т было использовано в виде изделий для внутреннего потребления в стране. Причин этому несколько.
В первую очередь низкий спрос на алюминиевую продукцию в России обусловлен значительным спадом промышленного производства.
Однако немаловажную роль сыграло имевшее в советское время подчинение потребления нуждам военно-промышленного комплекса и, как следствие, недостаточная до настоящего времени осведомленность производителей и потребителей гражданской промышленной продукции о свойствах алюминия, его сплавов и их преимуществах перед другими материалами.
Отсюда и ошибочные представления у многих, например, о токсичности или излишне высокой стоимости алюминия, невысокой коррозионной стойкости или недостаточной механической прочности его сплавов и др. А эти стереотипы создают препятствие применению алюминия в изделиях, сооружениях и машинах.
С очередным мифом мы столкнулись, знакомясь с материалами «круглого стола» по проблеме «Вентилируемые фасады: «за» или «против» [1]. В ходе дискуссии там были высказаны опасения в части применения для этих целей алюминия: мол «…алюминиево-магниевые сплавы горят… и специалисты-материаловеды, работающие в авиации, это прекрасно знают…».
Наш почти сорокалетний опыт работы в авиационной промышленности, связанный с плавлением, литьем и горячей обработкой давлением практически всех марок алюминиевых деформируемых сплавов позволяет судить об ошибочности этого утверждения.
Известно, что горение — это высокотемпературное окисление, характеризующееся высокой скоростью процесса и выделением значительного количества тепла. Поэтому представления о горючести алюминия и его сплавов прежде всего связаны с большим сродством алюминия к кислороду. Из рис.
1 [2]следует, что алюминий отличается от меди и железа значительно более высокой теплотой окисления. Его окисел очень стабилен и плохо восстанавливается. Это свойство широко используется в металлургии, где алюминий применяют в качестве раскислителя.
Отметим, что разница в сродстве к кислороду предопределила хронологию применения этих металлов человечеством.
В бронзовом веке сначала использовали самородную медь, а затем стали получать ее сплавы с оловом, раздувая горн легкими через трубки. Для получения железа потребовалось уже восстановление руды древесным углем в сыродутных печах.
И только с появлением электричества стало возможным разорвать прочную связь кислорода и алюминия и начать производство этого легкого металла.
Известно, что при нагреве мелко раздробленного алюминия он энергично сгорает на воздухе
При этом выделяется 31 кДж энергии на 1 г окислившегося алюминия, это чуть меньше тепла, образуемого при сгорании 1 л природного газа. Чем дисперснее частицы алюминия, тем меньшая необходима температура нагрева.
Так, алюминиевый порошок, смешанный с выделяющими кислород веществами, начинает интенсивно гореть при температуре воспламенения 250–300 0С. Это широко используется в пиротехнике и производстве ракетного топлива.
Распыленный же в воздухе алюминиевый порошок с размерами частиц менее 100 мкм способен образовывать взрывчатую смесь при комнатной температуре.
Действие на организм человека
Степень токсичности веществ связана с их физической и химической природой. Взаимодействуя с организмом, продукты горения вызывают патологические синдромы.
Международная классификация болезней десятого пересмотра МКБ-10 определяет отравление продуктами горения кодом Т59 – «Токсическое действие других газов, дымов и паров».
По механизму действия на человека отравляющие компоненты в составе дыма делятся на пять групп.
- Вещества, которые вызывают поражение кожного покрова и слизистой оболочки. Симптомы такого отравления продуктами горения – зуд, жжение кожи и её воспаление, боль в области глаз, век, слезотечение, кашель. Примеры – пары дёгтя, сернистый газ, формальдегид.
- Продукты горения, которые вызывают острые ингаляционные отравления. Пострадавшие жалуются на одышку, кашель. При осмотре обращает на себя внимание частое дыхание, синюшность. При высокой концентрации токсичного газа может произойти остановка дыхания. Так, признаки отравления продуктами горения ПВХ могут проявиться через несколько часов. Ингаляционные отравления вызывает хлор, аммиак, оксид азота.
- Продукты горения с образованием токсичных веществ, которых называют «ядами крови». Связывая гемоглобин, они нарушают доступ кислорода к тканям и запускают патологические реакции, охватывающие весь организм. Примеры – угарный газ, диоксид азота.
- Продукты горения, для которых органом-мишенью является нервная система. Это бензол, сероводород.
- Ферментные яды, которые воздействуют на тканевое дыхание, блокируя процессы активации кислорода. Это сероводород, синильная кислота.
Многие токсины, образующие в продуктах горения «универсальны», так как вызывают поражение сразу нескольких систем организма.
Как из оксида алюминия получить алюминий? Химические формулы
По характеру горения металлов их делят на две группы: летучие и нелетучие. Летучие металлы обладают относительно низкими температурами фазового перехода — температура плавления менее 1000 К, температура кипения не превышает 1500 К. К этой группе относятся щелочные металлы (литии, натрий, калий и др.) и щелочноземельные (магний, кальций).
Температуры фазового перехода нелетучих металлов значительно выше. Температура плавления, как правило, выше 1000 К. а температура кипения — больше 2500 К (табл. 1). Механизм горения металлов во многом определяется состоянием их окисла. Температура плавления летучих металлов значительно ниже температуры плавления их окислов.
При этом последние представляют собой достаточно пористые образования.
При поднесении источника зажигания к поверхности металла происходит его испарение и окисление. При достижении концентрации паров, равной нижнему концентрационному пределу, происходит их воспламенение.
Зона диффузионного горения устанавливается у поверхности, большая доля тепла перелается металлу, и он нагревается до температуры кипения. Образующиеся пары, свободно диффундируя через пористую окисную пленку, поступают в зону горения.
Кипение металла вызывает периодическое разрушение окисной пленки, что интенсифицирует горение.
Продукты горения (окислы металлов) диффундируют не только к поверхности металла, способствуя образованию корки окисла, но и в окружающее пространство, где, конденсируясь, образуют твердые частички в виде белого дыма. Образование белого плотного дыма является визуальным признаком горения летучих металлов.
У нелетучих металлов, обладающих высокими температурами фазового перехода, при горении на поверхности образуется весьма плотная окисная пленка, которая хорошо сцепляется с поверхностью металла.
В результате этого скорость диффузии паров металла через пленку резко снижается и крупные частицы, например, алюминия и бериллия, гореть не способны. Как правило, пожары таких металлов имеют место в том случае, когда они находятся в виде стружки, порошков и аэрозолей.
Их горение происходит без образования плотного дыма. Образование плотной окисной пленки на поверхности металла приводит к взрыву частицы.
Это явление особенно часто наблюдается при движении частицы в высокотемпературной окислительной среде, связывают с накоплением паров металлов под окисной пленкой с последующим внезапным ее разрывом. Это, естественно, приводит к резкой интенсификации горения.
Основными параметрами их горения являются время воспламенения и сгорания. Из теории диффузионного горения следует, что время сгорания частицы металла tг пропорционально квадрату ее диаметра do. Экспериментальные данные показывают, что фактическая зависимость несколько отличается от теоретической. Так, для алюминия tг
Повышение концентрации кислорода в атмосфере интенсифицирует горение металла. Частички алюминия диаметром (53 ÷ 66) 10 -3 мм в атмосфере, содержащей 23% кислорода, сгорают за 12,7·10 -3 с, а при повышении концентрации окислителя до 60% — за 4,5·10 -3 с.
Однако для пожарно-технических расчетов большой интерес представляет не время сгорания частицы металла, а скорость распространения пламени по потоку взвеси частиц металла в окислителе. В табл.
2 приведены экспериментальные данные по скорости распространения пламени и массовой скорости выгорания взвеси частиц диаметрами менее 10 -2 мм и 3·10 -2 мм алюминия в воздухе при различном коэффициенте избытка воздуха.
Получение сульфата алюминия
Как получить сульфат алюминия из оксида алюминия?
Способ включен в школьную программу восьмых и девятых классов.
Сульфат алюминия — это соль вида Al2(SO4)3. Представлена может быть в виде пластинок или порошка.
Это вещество может разлагаться на оксиды алюминия и серы при температуре от 580 градусов. Сульфат используется для очистки воды от мельчайших частиц, очень полезен в пищевой, бумажной, тканевой и других отраслях производства. Он широко доступен благодаря своей низкой цене. Очистка воды происходит из-за некоторых особенностей сульфата.
Дело в том, что загрязняющие частицы имеют вокруг себя двойной электрический слой, а рассматриваемый реагент является коагулянтом, который, при проникновении в электрическое поле частиц, вызывает сжатие слоев и нейтрализует заряд частиц.
Теперь о самом методе. Чтобы получить сульфат, нужно смешать оксид и серную (не сернистую) кислоту.
Выходит реакция взаимодействия глинозема с кислотой:
Al2O3+3H2SO4=Al2(SO4)3+H2O
Вместо оксида можно добавить сам алюминий или его гидроксид.
В промышленности для получения сульфата используют уже известную из третьей части этой статьи руду — боксит. Ее обрабатывают серной кислотой и получают «загрязненный» сульфат алюминия. В боксите содержится гидроксид, а реакция в упрощенном виде выглядит так:
3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O
Горение – алюминий
Массовая скорость испарения пггф материала в режиме кипения определяется скоростью поступления тепла из зоны горения, которая пропорциональна разности температур горения Тг и кипения Тк.
Поскольку Тт в рассматриваемой области давлений почти не изменяется, а Тк увеличивается с увеличением давления, то разность Тг-Тк уменьшается с ростом давления и вместе с этим уменьшается скорость газификации ( испарения) металла тгф а ( Тг-ТК) / ЬИСЯ.
Таким образом, при увеличении давления происходит приближение зоны горения к поверхности металла и парофазное горение может прекратиться.
Следовательно, при горении алюминия существует область давлений, в которой механизм горения алюминия контролируется скоростью его испарения, и в этой области происходит постепенный переход от парофазного горения при наличии кипения к горению в отсутствие кипения, при котором могут преобладать реакции на поверхности металла. [31]
Близкая к этому значению температура горения алюминия приводится в работах [ 11, с. Температуре 3533 К по формуле (1.15), описывающей кривую кипения, соответствует давление р 3 22 МПа. Отсюда ясно, что при давлениях, больших 3 22 МПа. [33]
Получение оксида алюминия
Про глинозем выше сказано много, но до сих пор не описано, как получить оксид алюминия. Формула — Al2О3.
А нужно всего-навсего сжечь алюминий в кислороде. Горение — процесс взаимодействия О2 и другого вещества.
Простейшее уравнение реакции выглядит следующим образом:
4Al + 3О2 = 2Al2О3
Оксид не растворяется в воде, но он хорошо растворим в криолите при высокой температуре.
Свои химические свойства оксид проявляет при температуре от 1000°С. Именно тогда он начинает взаимодействовать с кислотами и щелочами.
В естественных условиях корунд является единственный устойчивой вариацией вещества. Корунд очень твердый, с плотностью примерно 4000 г/м3. Твердость этого минерала по шкале Мооса — 9.
Оксид алюминия — амфотерный оксид. Легко преобразовывается в гидроксид (см. выше), а превратившись, сохраняет все свойства своей группы с преобладанием основных.
Амфотерные оксиды — это оксиды, которые могут проявлять как основные (свойства оксидов металлов), так и кислотные (оксидов неметаллов) свойства в зависимости от условий.
К амфотерным оксидам, исключая оксид алюминия, относятся: оксид цинка (ZnO), оксид бериллия (ВеО), оксид свинца (PbO), оксид олова (SnO), оксид хрома (Cr2О3), оксид железа (Fe2О3) и оксид ванадия (V2О5).
Пожары класса D: горят ли металлы?
Фраза «горение металлов» у многих вызывает недоумение. Люди далекие от вопросов пожарной безопасности уверены, что металлы не горят. Однако это не совсем так. Некоторые металлы способны не просто гореть, но даже самовоспламеняться.
Основные опасности, которые несут в себе разные металлы:
- Алюминий – легкий электропроводный металл с довольно низкой температурой плавления (660°С), в связи с чем при пожаре может произойти разрушение алюминиевых конструкций. Но самым опасным является алюминиевый порошок, который несет в себе угрозу взрыва и может гореть.
- Кадмий и многие другие металлы под воздействием высоких температур выделяют токсичные пары. Поэтому тушение горящих металлов следует производить в защитных масках.
- Щелочные металлы (натрий, калий, литий) вступают в реакцию с водой, образуя при этом водород и количество теплоты, необходимой для его воспламенения.
- Чугун в виде порошка при воздействии высоких температур или огня может взорваться. Искры от чугуна могут спровоцировать возгорание горючих материалов, находящихся вблизи.
- Сталь, которая не считается горючим металлом, также может загореться, если она находится в порошкообразном состоянии или в виде опилок.
- Титан – прочный металл, основной элемент стальных сплавов. Плавится он при высоких температурах (2000°С) и в больших конструкциях или изделиях не горит. Но маленькие детали из титана вполне могут воспламениться.
- Магний – один из главных элементов в легких сплавах, придающий им пластичность и прочность. Гореть могут хлопья и порошок магния. Твердый магний также может воспламениться, но только если его нагреть до температуры выше 650°С.
Как видно, гореть способны в основном измельченные металлы в виде порошка, стружки, опилок. Помимо указанных опасностей, металлы могут также стать причиной травм, ожогов и увечий людей.
Тушение пожаров классаD
Продукты горения (сгорания)
Продукты горения – это вещества (газообразные, жидкие или твердые вещества) и соединения, образующиеся в результате сложного физико-химического процесса горения веществ (материалов).
Под продуктами горения чаще всего понимают дым, токсичные продукты горения, сажу и другие.
Продукты горения сухой травы
Знание свойств и количества продуктов горения необходимо для расчета теплоты сгорания , температуры горения и других показателей, используемых для оценки пожаровзрывоопасности веществ (материалов), объектов с наличием этих веществ (материалов).