Свойства атома углерода:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 12,0096-12,0116 а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p2 |
| 203 | Электронная оболочка | K2 L4 M0 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 67 пм |
| 205 | Эмпирический радиус атома | 70 пм |
| 206 | Ковалентный радиус* | 76 пм |
| 207 | Радиус иона (кристаллический) | C4+ 29 (4) пм, 30 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 170 пм |
| 209 | Электроны, Протоны, Нейтроны | 6 электронов, 6 протонов, 6 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 2 |
| 212 | Группа в периодической таблице | 14-ая группа (по старой классификации – главная подгруппа 4-ой группы) |
| 213 | Эмиссионный спектр излучения |
Применение
Графит используется в карандашной промышленности. Также его используют в качестве смазки при особо высоких или низких температурах.
Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин. Кроме этого, ограненные алмазы — бриллианты используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств, бриллиант неизменно является самым дорогим драгоценным камнем. Исключительно высокая теплопроводность алмаза (до 2000 Вт/м•К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая цена (около 50 долларов/грамм) и сложность обработки алмаза ограничивают его применение в этой области. В фармакологии и медицине широко используются различные соединения углерода— производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей)— для лечения кожных заболеваний; радиоактивные изотопы углерода— для научных исследований (радиоуглеродный анализ).
Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент.
Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод— основа жизни. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа пожирают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возврашением в атмосферу, либо захоронением в виде угля или нефти.
Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ)— один из важнейших источников энергии для человечества.
Химические свойства углерода:
| 300 | Химические свойства | |
| 301 | Степени окисления | -4 , -3 , -2 , -1 , 0 , +1, +2, +3, +4 |
| 302 | Валентность | II, IV |
| 303 | Электроотрицательность | 2,55 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1086,45 кДж/моль (11,2602880(11) эВ) |
| 305 | Электродный потенциал | |
| 306 | Энергия сродства атома к электрону | 121,7763(1) кДж/моль (1,2621226(11) эВ) – углерод 12C, 121,7755(2) кДж/моль (1,2621136(12) эВ) – углерод 13C |
Нахождение в природе
Содержание углерода в земной коре 0,1% по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых— антрацит (94—97% С), бурые угли (64—80% С), каменные угли (76—95% С), горючие сланцы (56—78% С), нефть (82—87% С), горючих природных газов (до 99% метана), торф (53—56% С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046% СО2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18%). В организм человека углерод поступает с пищей (в норме около 300 г в сутки). Общее содержание углерода в организме человека достигает около 21% (15кг на 70кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина) Кругооборот углерода в природе включает биологический цикл, выделение СО2 в атмосферу при сгорании ископаемого топлива, из вулканических газов, горячих минеральных источников, из поверхностных слоев океанических вод и др. Биологический цикл состоит в том, что углерод в виде СО2 поглощается из тропосферы растениями. Затем из биосферы вновь возвращается в геосферу: с растениями углерод попадает в организм животных и человека, а затем при гниении животных и растительных материалов— в почву и в виде СО2— в атмосферу.
В парообразном состоянии и в виде соединений с азотом и водородом углерод обнаружен в атмосфере Солнца, планет, он найден в каменных и железных метеоритах.
Большинство соединений углерода, и прежде всего углеводороды, обладают ярко выраженным характером ковалентных соединений. Прочность простых, двойных и тройных связей атомов С между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают существования огромного числа углеродсодержащих соединений, изучаемых органической химией.
Физические свойства углерода:
| 400 | Физические свойства | |
| 401 | Плотность* | 1,8-2,1 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – аморфный углерод, 2,267 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – графит, 3,515 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – алмаз |
| 402 | Температура плавления | |
| 403 | Температура кипения | |
| 404 | Температура сублимации | 3642 °C (3915 K, 6588 °F) – графит |
| 405 | Температура разложения | 1000 °C (1273 K, 1832 °F) – алмаз. Продукты разложения алмаза – графит |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл) | |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип) | 715 кДж/моль (сублимация) |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 8,517Дж/(K·моль) – графит, 6,155 Дж/(K·моль) – алмаз |
| 411 | Молярный объём | 5,314469 см³/моль – графит, 3,42 см³/моль – алмаз |
| 412 | Теплопроводность | 119-165 Вт/(м·К) (при стандартных условиях) – графит, 900-2300 Вт/(м·К) (при стандартных условиях) – алмаз |
| 413 | Коэффициент теплового расширения | 0,8 мкм/(М·К) (при 25 °С) – алмаз |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | 4326,85 °C (4600 К, 7820,33 °F), 10,8 МПа |
| 419 | Давление паров (мм.рт.ст.) | 0,000000001 мм.рт.ст. (при 1591 °C) — графит, 0,00000001 мм.рт.ст. (при 1690 °C) — графит, 0,0000001 мм.рт.ст. (при 1800 °C) — графит, 0,000001 мм.рт.ст. (при 1922 °C) — графит, 0,00001 мм.рт.ст. (при 2160 °C) — графит, 0,0001 мм.рт.ст. (при 2217 °C) — графит, 0,001 мм.рт.ст. (при 2396 °C) — графит, 0,01 мм.рт.ст. (при 2543 °C) — графит, 0,1 мм.рт.ст. (при 2845 °C) — графит, 1 мм.рт.ст. (при 3214 °C) — графит, 10 мм.рт.ст. (при 3496 °C) — графит, 100 мм.рт.ст. (при 4373 °C) — графит |
| 420 | Давление паров (Па) | |
| 421 | Стандартная энтальпия образования ΔH | 0 кДж/моль (при 298 К, для состояния вещества – твердое тело) – графит, 717 кДж/моль (при 298 К, для состояния вещества – газ) – графит, 1,828 кДж/моль (при 298 К, для состояния вещества – твердое тело) – алмаз |
| 422 | Стандартная энергия Гиббса образования ΔG | 0 кДж/моль (при 298 К, для состояния вещества – твердое тело) – графит, 2,833 кДж/моль (при 298 К, для состояния вещества – твердое тело) – алмаз |
| 423 | Стандартная энтропия вещества S | 5,74 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело) – графит, 158 Дж/(моль·K) (при 298 К, для состояния вещества – газ) – графит, 2,368 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело) – алмаз |
| 424 | Стандартная мольная теплоемкость Cp | 8,54 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело) – графит, 20,8 Дж/(моль·K) (при 298 К, для состояния вещества – газ) – графит, 6,117 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело) – алмаз |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | Диамагнитный материал |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | -1,4·10-5 – графит |
| 430 | Удельная магнитная восприимчивость | -6,2·10-9 – графит |
| 431 | Молярная магнитная восприимчивость | -5,9·10-6 см3/моль (при 298 K) – графит, -6,0·10-6 см3/моль (при 298 K) – алмаз |
| 432 | Электрический тип | Проводник – графит, диэлектрик – алмаз |
| 433 | Электропроводность в твердой фазе | 0,1·106 См/м – графит |
| 434 | Удельное электрическое сопротивление | 7,837 мкОм·М (при 20 °C) – графит |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | 5,46-6,4 эВ (при 300 K) – алмаз, 5,4 эВ (при 0 K) – алмаз |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | 1-2 – графит, 10 – алмаз |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | 17500 м/с (при 20°C, состояние среды — кристаллы, ось L100) – алмаз, 12800 м/с (при 20°C, состояние среды — кристаллы, ось S100) – алмаз, 18600 м/с (при 20°C, состояние среды — кристаллы, ось L111) – алмаз, 11600 м/с (при 20°C, состояние среды — кристаллы, ось S110) – алмаз |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | 1050 ГПа — алмаз |
| 450 | Модуль сдвига | 478 ГПа – алмаз |
| 451 | Объемный модуль упругости | 442 ГПа – алмаз |
| 452 | Коэффициент Пуассона | 0,1 – алмаз |
| 453 | Коэффициент преломления | 2,417 (при стандартных условиях для линии D, длина волны которой приближенно равна 0,5893 μ) – алмаз белый |
Теплопроводность и коэффициент теплопроводности. Что это такое
Так что же такое теплопроводность? С точки зрения физики теплопроводность
– это молекулярный перенос теплоты между непосредственно соприкасающимися телами или частицами одного тела с различной температурой, при котором происходит обмен энергией движения структурных частиц (молекул, атомов, свободных электронов).
Можно сказать проще, теплопроводность
– это способность материала проводить тепло. Если внутри тела имеется разность температур, то тепловая энергия переходит от более горячей его части к более холодной. Передача тепла происходит за счет передачи энергии при столкновении молекул вещества. Происходит это до тех пор, пока температура внутри тела не станет одинаковой. Такой процесс может происходить в твердых, жидких и газообразных веществах.
На практике, например в строительстве при теплоизоляции зданий, рассматривается другой аспект теплопроводности, связанный с передачей тепловой энергии. В качестве примера возьмем “абстрактный дом”. В “абстрактном доме” стоит нагреватель, который поддерживает внутри дома постоянную температуру, скажем, 25 °С. На улице температура тоже постоянная, например, 0 °С. Вполне понятно, что если выключить обогреватель, то через некоторое время в доме тоже будет 0 °С. Все тепло (тепловая энергия) через стены уйдет на улицу.
Чтобы поддерживать температуру в доме 25 °С, нагреватель должен постоянно работать. Нагреватель постоянно создает тепло, которое постоянно уходит через стены на улицу.
Коэффициент теплопроводности
Количество тепла, которое проходит через стены (а по научному – интенсивность теплопередачи за счет теплопроводности) зависит от разности температур (в доме и на улице), от площади стен и теплопроводности материала, из которого сделаны эти стены.
Для количественной оценки теплопроводности существует коэффициент теплопроводности материалов. Этот коэффициент отражает свойство вещества проводить тепловую энергию. Чем больше значение коэффициента теплопроводности материала, тем лучше он проводит тепло.
Если мы собираемся утеплять дом, то надо выбирать материалы с небольшим значением этого коэффициента. Чем он меньше, тем лучше. Сейчас в качестве материалов для утепления зданий наибольшее распространение получили утеплители из минеральной ваты, и различных пенопластов.
Набирает популярность новый материал с улучшенными теплоизоляционными качествами – Неопор.
Коэффициент теплопроводности материалов обозначается буквой ? (греческая строчная буква лямбда) и выражается в Вт/(м2*К). Это означает, что если взять стену из кирпича, с коэффициентом теплопроводности 0,67 Вт/(м2*К), толщиной 1 метр и площадью 1 м2.
, то при разнице температур в 1 градус, через стену будет проходить 0,67 ватта тепловой энергии. Если разница температур будет 10 градусов, то будет проходить уже 6,7 ватта. А если при такой разнице температур стену сделать 10 см, то потери тепла будут уже 67 ватт.
Подробней о методике расчета теплопотерь зданий можно посмотреть здесь.
Следует отметить, что значения коэффициента теплопроводности материалов указываются для толщины материала в 1 метр. Чтобы определить теплопроводность материала для любой другой толщины, надо коэффициент теплопроводности разделить на нужную толщину, выраженную в метрах.
В строительных нормах и расчетах часто используется понятие “тепловое сопротивление материала”. Это величина обратная теплопроводности. Если, на пример, теплопроводность пенопласта толщиной 10 см – 0,37 Вт/(м2*К), то его тепловое сопротивление будет равно 1 / 0,37 Вт/(м2*К) = 2,7 (м2*К)/Вт.
Коэффициент теплопроводности материалов
Ниже в таблице приведены значения коэффициента теплопроводности для некоторых материалов применяемых в строительстве.
| Материал | Коэфф. тепл. Вт/(м2*К) |
| Алебастровые плиты | 0,470 |
| Алюминий | 230,0 |
| Асбест (шифер) | 0,350 |
| Асбест волокнистый | 0,150 |
| Асбестоцемент | 1,760 |
| Асбоцементные плиты | 0,350 |
| Асфальт | 0,720 |
| Асфальт в полах | 0,800 |
| Бакелит | 0,230 |
| Бетон на каменном щебне | 1,300 |
| Бетон на песке | 0,700 |
| Бетон пористый | 1,400 |
| Бетон сплошной | 1,750 |
| Бетон термоизоляционный | 0,180 |
| Битум | 0,470 |
| Бумага | 0,140 |
| Вата минеральная легкая | 0,045 |
| Вата минеральная тяжелая | 0,055 |
| Вата хлопковая | 0,055 |
| Вермикулитовые листы | 0,100 |
| Войлок шерстяной | 0,045 |
| Гипс строительный | 0,350 |
| Глинозем | 2,330 |
| Гравий (наполнитель) | 0,930 |
| Гранит, базальт | 3,500 |
| Грунт 10% воды | 1,750 |
| Грунт 20% воды | 2,100 |
| Грунт песчаный | 1,160 |
| Грунт сухой | 0,400 |
| Грунт утрамбованный | 1,050 |
| Гудрон | 0,300 |
| Древесина – доски | 0,150 |
| Древесина – фанера | 0,150 |
| Древесина твердых пород | 0,200 |
| Древесно-стружечная плита ДСП | 0,200 |
| Дюралюминий | 160,0 |
| Железобетон | 1,700 |
| Зола древесная | 0,150 |
| Известняк | 1,700 |
| Известь-песок раствор | 0,870 |
| Ипорка (вспененная смола) | 0,038 |
| Камень | 1,400 |
| Картон строительный многослойный | 0,130 |
| Каучук вспененный | 0,030 |
| Каучук натуральный | 0,042 |
| Каучук фторированный | 0,055 |
| Керамзитобетон | 0,200 |
| Кирпич кремнеземный | 0,150 |
| Кирпич пустотелый | 0,440 |
| Кирпич силикатный | 0,810 |
| Кирпич сплошной | 0,670 |
| Кирпич шлаковый | 0,580 |
| Кремнезистые плиты | 0,070 |
| Латунь | 110,0 |
| Лед 0°С | 2,210 |
| Лед -20°С | 2,440 |
| Липа, береза, клен, дуб (15% влажности) | 0,150 |
| Медь | 380,0 |
| Мипора | 0,085 |
| Опилки – засыпка | 0,095 |
| Опилки древесные сухие | 0,065 |
| ПВХ | 0,190 |
| Пенобетон | 0,300 |
| Пенопласт ПС-1 | 0,037 |
| Пенопласт ПС-4 | 0,040 |
| Пенопласт ПХВ-1 | 0,050 |
| Пенопласт резопен ФРП | 0,045 |
| Пенополистирол ПС-Б | 0,040 |
| Пенополистирол ПС-БС | 0,040 |
| Пенополиуретановые листы | 0,035 |
| Пенополиуретановые панели | 0,025 |
| Пеностекло легкое | 0,060 |
| Пеностекло тяжелое | 0,080 |
| Пергамин | 0,170 |
| Перлит | 0,050 |
| Перлито-цементные плиты | 0,080 |
| Песок 0% влажности | 0,330 |
| Песок 10% влажности | 0,970 |
| Песок 20% влажности | 1,330 |
| Песчаник обожженный | 1,500 |
| Плитка облицовочная | 1,050 |
| Плитка термоизоляционная ПМТБ-2 | 0,036 |
| Полистирол | 0,082 |
| Поролон | 0,040 |
| Портландцемент раствор | 0,470 |
| Пробковая плита | 0,043 |
| Пробковые листы легкие | 0,035 |
| Пробковые листы тяжелые | 0,050 |
| Резина | 0,150 |
| Рубероид | 0,170 |
| Сланец | 2,100 |
| Снег | 1,500 |
| Сосна обыкновенная, ель, пихта (450…550 кг/куб.м, 15% влажности) | 0,150 |
| Сосна смолистая (600…750 кг/куб.м, 15% влажности) | 0,230 |
| Сталь | 52,0 |
| Стекло | 1,150 |
| Стекловата | 0,050 |
| Стекловолокно | 0,036 |
| Стеклотекстолит | 0,300 |
| Стружки – набивка | 0,120 |
| Тефлон | 0,250 |
| Толь бумажный | 0,230 |
| Цементные плиты | 1,920 |
| Цемент-песок раствор | 1,200 |
| Чугун | 56,0 |
| Шлак гранулированный | 0,150 |
| Шлак котельный | 0,290 |
| Шлакобетон | 0,600 |
| Штукатурка сухая | 0,210 |
| Штукатурка цементная | 0,900 |
| Эбонит | 0,160 |
Источник: https://www.econel.ru/teploprovodnost/
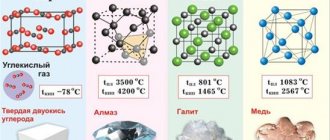
Кристаллическая решётка углерода:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-графит |
| 512 | Структура решётки | Гексагональная |
| 513 | Параметры решётки | a = 2,46 Å, c = 6,71 Å |
| 514 | Отношение c/a | 2,73 |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
| 521 | Кристаллическая решётка #2 | Алмаз |
| 522 | Структура решётки | Кубическая алмазная |
| 523 | Параметры решётки | a = 3,567 Å |
| 524 | Отношение c/a | |
| 525 | Температура Дебая | 1860 K |
| 526 | Название пространственной группы симметрии | Fd_ 3m |
| 527 | Номер пространственной группы симметрии | 225 |
Примечание:
201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
206* Ковалентный радиус углерода согласно [1] составляет для sp3 – 77 пм, для sp2 – 73 пм, sp – 69 пм, согласно [3] составляет 77 пм.
401* Плотность графита согласно [3] составляет 2,25 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело).
410* Молярная теплоемкость графита согласно [3] составляет 8,54 Дж/(K·моль).
История
Углерод в виде древесного угля применялся в древности для выплавки металлов. Издавна известны аллотропные модификации углерода — алмаз и графит.
На рубеже XVII—XVIII вв. возникла теория флогистона, выдвинутая Иоганном Бехером и Георгом Шталем. Эта теория признавала наличие в каждом горючем теле особого элементарного вещества — невесомого флюида — флогистона, улетучивающегося в процессе горения. Так как при сгорании большого количества угля остается лишь немного золы, флогистики полагали, что уголь — это почти чистый флогистон. Именно этим объясняли, в частности, «флогистирующее» действие угля, — его способность восстанавливать металлы из «известей» и руд. Поздние флогистики, Реомюр, Бергман и другие, уже начали понимать, что уголь представляет собой элементарное вещество. Однако впервые таковым «чистый уголь» был признан Антуаном Лавуазье, исследовавшим процесс сжигания в воздухе и кислороде угля и других веществ. В книге Гитона де Морво, Лавуазье, Бертолле и Фуркруа «Метод химической номенклатуры» (1787) появилось название «углерод» (carbone) вместо французского «чистый уголь» (charbone pur). Под этим же названием углерод фигурирует в «Таблице простых тел» в «Элементарном учебнике химии» Лавуазье.
В 1791 году английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокалённым мелом, в результате чего образовывались фосфат кальция и углерод. То, что алмаз при сильном нагревании сгорает без остатка, было известно давно. Ещё в 1751 год германский император Франц I согласился дать алмаз и рубин для опытов по сжиганию, после чего эти опыты даже вошли в моду. Оказалось, что сгорает лишь алмаз, а рубин (окись алюминия с примесью хрома) выдерживает без повреждения длительное нагревание в фокусе зажигательной линзы. Лавуазье поставил новый опыт по сжиганию алмаза с помощью большой зажигательной машины и пришёл к выводу, что алмаз представляет собой кристаллический углерод. Второй аллотроп углерода — графит — в алхимическом периоде считался видоизменённым свинцовым блеском и назывался plumbago; только в 1740 г. Потт обнаружил отсутствие в графите какой-либо примеси свинца. Шееле исследовал графит (1779) и, будучи флогистиком, счёл его сернистым телом особого рода, особым минеральным углём, содержащим связанную «воздушную кислоту» (СО2) и большое количество флогистона.
Двадцать лет спустя Гитон де Морво путём осторожного нагревания превратил алмаз в графит, а затем в угольную кислоту.
Происхождение названия
В XVII—XIX веках в русской химической и специализированной литературе иногда применялся термин «углетвор» (Шлаттер, 1763; Шерер, 1807; Севергин, 1815); с 1824 года Соловьёв ввёл название «углерод». Соединения углерода имеют в названии часть карбо(н)
— от лат. carbō (род. п.
carbōnis
) «уголь».