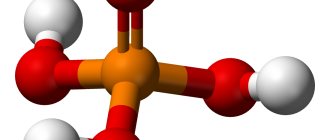
Свойства фосфорной кислоты
Физические свойства
Фосфорная кислота самая устойчивая при комнатной температуре фосфорных кислот. Кроме ортофосфорной кислоты H3PO4 существует метафосфорная кислота HPO3, пирофосфорная H4P2O7, трифосфорная H3P3O9 и тетрафосфорная H4P4O12. Последние три намного сильнее ортофосфорной кислоты (K1 = 7 ⋅ \cdot ⋅ 10-3).
| Свойство | Описание |
| Внешний вид | Бесцветная жидкость в водном растворе, в чистом виде – гигроскопичные кристаллы |
| Молярная масса, г/моль | 98,0 |
| Плотность при 20°С, г/см3 | 1,83 |
| Температура плавления, °С | +42,35 |
| Температура кипения, °С | 213 (разл.) |
Химические свойства
В водных растворах фосфорная кислота диссоциирует на ионы:
H3PO4 ⇄ \rightleftarrows ⇄ H+ + H2PO4-, ⇄ \rightleftarrows ⇄ 2H+ + HPO42- ⇄ \rightleftarrows ⇄ 3H+ + PO43-.
Константы диссоциации
K1 = 7,1·10-3,
K2 = 6,2·10-8,
K3 = 5,0·10-13.
При комнатной температуре фосфорная кислота реагирует лишь с активными металлами, оксидами и гидроксидами:
6Li + 2H3PO4 = 2Li3PO4 + 3H2↑,
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O,
3KOH + H3PO4 = K3PO4 + 3H2O.
При нагревании она более активна:
3Zn + 2H3PO4 = 2Zn3(PO4)2 ↓+ 3H2↑,
Fe2O3 +2H3PO4 = 2FePO4↓+ 3H2O.
Фосфорная кислота разлагается при нагревании:
4H3PO4 = 2H4P2O7 + 2H2O.
Фосфорная кислота вступает в реакцию с хлорной кислотой, образуя соли фосфорила:
H3PO4 + HClO4= P(OH)4ClO4.
Поэтому можно считать фосфорную кислоту амфотерным гидроксидом фосфора (V) с преобладанием кислотных свойств.
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Получение
Лабораторные способы получения
Фосфорную кислоту в лабораторных условиях получают из оксида фосфора (V):
P2O5 + 3H2O = 2H3PO4.
Реакция протекает бурно, поэтому ее лучше получать таким способом в промышленности.
Можно получить фосфорную кислоту из фосфатов действием соляной или серной кислоты:
Na3PO4 + 3HCI = 3NaCI + H3PO4.
Наконец, можно подвергнуть гидролизу хлорид фосфора (V):
2PCl5+ 8H2O = 2H3PO4 + 10HCl.
Получение в промышленности
В промышленности наиболее чистую фосфорную кислоту получают термическим способом, для чего фосфор сжигают:
4P +5O2 = 2P2O5.
Фосфорный ангидрид взаимодействует с водой слишком бурно, поэтому фосфорный ангидрид смешивают с нагретой до 200°С фосфорной кислотой в концентрации 50-60%. Полученную кислоту разводят и частично запускают вновь в процесс.
Есть экстракционный метод получения фосфорной кислоты непосредственно из руд, например, из апатита:
Ca5(PO4)3F + 5H2SO4 + n H3PO4 + 3H2O = (n+3) H3PO4+ 5CaSO4·H2O + HF.
Применение
Кислота ортофосфорная применяется во многих областях, начиная от промышленности до лечения зубов. Средство используется умельцами как флюс при пайке, для очистки поверхности металла от ржавчины. Жидкость применяется:
- для научных исследований в молекулярной биологии;
- как катализатор процессов органического синтеза;
- для создания антикоррозионных покрытий металлов;
- при производстве огнеупорных пропиток для дерева.
Вещество находит применение:
- в нефтяной промышленности;
- при изготовлении спичек;
- для производства кинопленки;
- с целью защиты от коррозии;
- для осветления сахарозы;
- при изготовлении лекарств;
- в холодильных установках как связующее вещество в составе фреона;
- при механической обработке для полировки, очистки металлов;
- в текстильной отрасли при производстве тканей, имеющих огнезащитную пропитку;
- как компонент при получении химических реактивов;
- в ветеринарии для лечения мочекаменной болезни у норок;
- как составляющая для грунтовки по металлу.
В пищевой промышленности
Широкое распространение получило применение фосфорной кислоты при изготовлении продуктов питания. Она зарегистрирована в реестре пищевых добавок под кодом Е338. При употреблении с допустимыми количествами вещество считается безопасным. Полезными являются такие свойства препарата:
- предотвращение прогоркания;
- регулирование кислотности;
- продление срока годности;
- сохранение вкусовых характеристик;
- усиление действия антиоксидантов.
Кислота ортофосфорная как подкислитель, разрыхлитель, антиоксидант находит применение в хлебопечении, мясной, молочной промышленности. Используется при производстве кондитерских изделий, сахара. Вещество придает продуктам кисловатый, горьковатый вкус. Добавка Е338 входит в состав:
- плавленых сыров;
- сдобы;
- газированных напитков – «Пепси-кола», «Спрайт»;
- колбас;
- булок;
- молока;
- детского питания;
- мармелада;
- тортов.
Исследования показали, что злоупотребление продуктами, содержащими ортофосфорные соединения, особенно газированными напитками, может привести к появлению проблем со здоровьем. Не исключено:
- вымывание из организма кальция, что может спровоцировать образование остеопороза;
- нарушение кислотно-щелочного баланса – добавка способна увеличивать его кислотность;
- появление заболеваний ЖКТ;
- обострение гастрита;
- разрушение эмали зубов;
- развитие кариеса;
- появление рвоты.
В непищевой промышленности
Применение ортофосфорной кислоты можно наблюдать во многих сферах производства. Часто это связано с химическими свойствами продукта. Препарат применяется для изготовления:
- комбинированных, фосфорных минеральных удобрений;
- активированного угля;
- фосфорных солей натрия, аммония, марганца;
- огнезащитных красок;
- стекла, керамики;
- синтетических моющих средств;
- огнеупорных связующих компонентов;
- негорючего фосфатного пенопласта;
- гидрожидкостей для авиационной промышленности.
- Чем лечить грибок ногтей на руках
- Симптомы свиного гриппа у человека
- Как варить гороховый суп правильно, пошаговые рецепты с фото
В медицине
Стоматологи применяют ортофосфорный состав для обработки внутренней поверхности коронки. Это помогает во время протезирования улучшить ее сцепление с зубом. Вещество используется фармацевтами для приготовления лекарств, зубного цемента. В медицине применение ортофосфорного соединения связано со способностью протравливать эмаль зуба. Это необходимо при случае использования для пломбирования адгезивных материалов второго, третьего поколения. Важные моменты – после травления поверхность необходимо:
- промыть;
- просушить.
Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
Способы получения фосфатов
Получают кислоты с металлами, оксидами металлов, гидроксидами (см. Химические свойства ортофосфорной кислоты)
Физические свойства фосфатов
Н3РO4 является 3х-основной кислотой, поэтому образует 3 типа солей:
| Анион соли | Название | Растворимость в воде | Примеры солей |
| PO43- | Фосфат (ортофосфат) | большинство нерастворимы (кроме фосфатов щелочных металлов и аммония) | Na3РO4; Са3(РO4)2 |
| HPO42- | Гидрофосфат | растворимы | Na2НРO4; СаНРО4 |
| Н2РO4— | Дигидрофосфат | очень хорошо растворимы | NaH2PO4; Са(Н2РO4)2 |
Химические свойства фосфатов
- Имеют свойства, характерные для солей.
- Соли щелочных металлов подвержены гидролизу:
Na3РO4 + Н2О = Na2HPO4 + NaOH
- Характерная особенность ортофосфатов – отношение к прокаливанию: однозамещенные соли переходят в метафосфаты, двухзамещенные – в пирофосфаты, из трехзамещенных изменяются только соли аммония:
NaH2PO4 = NaPO3 + H2O
Na2HPO4 = Na4P2O7 + H2O
(NH4)3PO4 = 3NH3 + H2O
Фосфорные удобрения
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
При достаточном количестве фосфора растения быстро растут и хорошо плодоносят. Внесение фосфорных удобрений благоприятствует росту корневой системы растения и повышению урожайности. В связи с этим такие удобрения важны при выращивании овощных, зерновых и плодово-ягодных культур.
В таблице ниже приведены основные виды фосфорных удобрений.
Категории V группа (азот, фосфор), НЕОРГАНИЧЕСКАЯ ХИМИЯ
Levsha1988 › Блог › Химичим с цинком и ржавчиной.
Результат применения этого дела на кузове ОКИ Давно хотел попробовать гальванику. Электролизом осаждать цинк на черных металлах. В быту пригодится, да и изучить стойкость к коррозии. Есть наборы для оцинковки в продаже, но они дорогие, за таких мелких 2 пузырька и пары причендалов отдавать деньги. искать еще где продается. Пробуем составить это дело самим:
На авторынке купил электролит для аккумуляторов. Это серная кислота с дистиллированной водой. Концентрация довольно велика. Далее взял кучку севших но не потекших солевых батареек. Это самые дешевые батарейки. Достал из них цинк, нарезал тонкими полосками и опустил в серную кислоту. Поставил в водяную баню. Пошла реакция (фото). Растворял пока пузырьки шли, потом кислота выработалась, по идее насытившись растворенным цинком.
Но, как оказалось полученный раствор сульфата цинка непроканал. Забиваем на это. Засыпаем содой и сливаем в банку с шлаком.
Покупаем в магазине радиодеталей паяльную кислоту, с содержанием цинка. Состав- хлорид цинка. Цинк растворенный уже в соляной кислоте. Там цинка завались. Стоит в местном магазине литр — 400 руб. Литра хватит на оч много. Сразу, там же покупаю ортофосфорную кислоту. Тоже является паяльной кислотой. 50 мл. достаточно. Делаем 2 электрода.
Нужен будет источник питания. Тут главное условие — возможность регулировки силы тока. У меня есть самопальный источник от 0 до 24 вольт и стабилизацией тока 0 до 10 ампер. Ниже приведу пару вариантов и схему простейшего регулятора тока, если источника под рукой нету.
К электроду которым чисти подключаем + источника. К очищаемому объекту -. Ставим напряжение 12-15 вольт и отсечку тока в 1.5-2 ампера. Пропитываем войлок электрода ортофосфорной кислотой. И начинаем водить по ржавчине. Начинает шипеть, БП показывает что ток пошел (1.5-2 А). Выделение водорода и активность кислоты- отколупывает и растворяет ржу, которая засела в порах и ржа остается на войлоке. Электрод нужно часто полоскать в воде, и снова пропитывать в свежей ортофосфорной кислоте, т.к то что в руке начинает растворяться, и осаждаться на маховике. а это нам пока не надо.
Капал воду, вода так и осталась каплями. По голой стали она растекается, а тут как бы собирается, как будто жирная поверхность. Вот еще пара примеров оцинкованных железяк.
Комментарии 33
А если растворить предварительно цинк в ортофосфорной кислоте, а не соляной, будет тот же эффект?
подскажите?может ли паяльная кислота(с цинком которая) разъедать лак автомобиля?
Здравствуйте. Подскажите а как лампу от поворотника приколхозить, не могу сообразить к каким проводам подключать её. Ведь минусовая клема на корпусе остается? Спасибо
Лампочку в разрыв плюсового провода к которому подключен электрод. Т.е. последовательно.
Респект, за отчет, только вопрос не лучьше сначала малым током, а после повысить и поверхность будет матовая, и грунт ляжет на него.
В принципе идея кстати. Надо будет попробовать.
Да ты там осторожней с испарениями, используй вытяжку и противогаз, т.к. при реакции соляной кислоты ицинка образ сорнистый ангидрид пдк 0,5 надышишся и отеклегких заработать можно!) ну не дай божЕ.
откуда сернистый ангидрид в соединении соляной кислоты? вы б еще сказали чистый хлор выделяется.)) он же не сернистую кислоту использовал. и не фульфит, и даже не гидросульфит цинка, и не медь. сернистого газа и в реакции серной кислоты нет. валентность не та))) единственное чего стоит бояться это водород.
Оксид фосфора (III), триоксид фосфора (P2O3)
Способы получения оксида фосфора (III)
- Р2О3 образуется при горении фосфора в недостатке кислорода или его медленном окислении:
4Р + 3О2 = 2Р2О3
Физические свойства оксида фосфора (III)
При комнатной температуре Р2О3 — белая воскообразная масса с неприятным запахом. Легко испаряется, его Тпл = 23,5°С
Пары существует в виде димеров Р4О6.
!Очень ядовит
Химические свойства оксида фосфора (III)
- Р2О3 как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
Р2О3 + ЗН2О =2H3PO3
- Реакция диспропорционирования происходит очень бурно при растворении Р2О3вгорячей воде:
2Р2О3 + 6Н2О = РН3 + ЗH3PO4
- При взаимодействии Р2О3 с щелочами образуются соли фосфористой кислоты:
Р2О3 + 4NaOH = 2Na2HPO3 + Н2О
- При взаимодействии с окислителями P2O3 проявляет восстановительные свойства:
Окисление кислородом воздуха:
Р2О3 + О2 = Р2О5
Окисление галогенами:
Р2О3 + 2Cl2 + 5Н2О = 4HCl + 2H3PO4
Требования к упаковке и правила обращения с веществом
На таре, в которую расфасовывается кислота, обязательно должно быть обозначение “Опасно”, “Едкая жидкость”.
Хранить и транспортировать добавку разрешено в такой упаковке:
- полиэтиленовые канистры;
- стеклянные бутыли;
- контейнеры и автоцистерны из нержавеющей стали, которая прошла специальную обработку;
- пластиковые кубы.
Сами емкости для удобства помещают в полиэтиленовые барабаны или дощатые ящики, внутри которых должен быть мягкий наполнитель во избежание повреждения упаковки.
Попадание вещества на кожу или слизистые, в глаза или в дыхательные пути может вызывать ожоги, тошноту, рвоту, головокружение и нарушение целостности тканей. В таком случае необходимо незамедлительно обратиться за врачебной помощью.
Кислота является опасной в обращении, поэтому работать с ней можно только вдали от открытых источников огня, в хорошо вентилируемом помещении.
Обязательно наличие защитной спецодежды: перчаток, респиратора, очков, ботинок и костюма для работы с опасными веществами.
Применение от ржавчины
Преобразователь ржавчины на основе ортофосфорной кислоты создает на поверхности защитный слой, оберегающий от коррозии при дальнейшем использовании. Особенность применения соединения – безопасность для металла при нанесении. Существует несколько способов выполнить удаление ржавчины ортофосфорной кислотой, зависящих от размера повреждения:
- травление с погружением в ванну, иную емкость;
- многократное нанесение на металл состава пульверизатором, валиком;
- покрытие поверхности предварительно обработанной механической очисткой.
Ортофосфорное соединение производит преобразование ржавчины в фосфаты железа. Состав можно использовать для промывки и очистки:
- изделий металлопроката;
- скважин;
- поверхностей трубопроводов;
- парогенераторов;
- систем водоснабжения, отопления;
- змеевиков;
- бойлеров;
- водонагревателей;
- теплообменников;
- котлов;
- деталей машин и механизмов.
Техника безопасности при работе с кислотой
Ортофосфорное соединение относится к классу опасных веществ, требует соблюдения осторожности. Работы с составом должны проводиться в специальном помещении, оснащенном приточно-вытяжной вентиляцией, вдали от источников огня. Недопустимо отсутствие средств индивидуальной защиты:
- респиратора;
- перчаток;
- специальной одежды;
- нескользящих ботинок;
- очков.
Опасно попадание ортофосфорного состава на кожу, в глаза, вредно вдыхание горячих паров. Это может вызвать ожог, головокружение, рвоту, кашель. При экстренных случаях нужно:
- снять одежду, на которую попало вещество;
- промыть место поражения проточной водой;
- вызвать врача;
- наложить свободную повязку;
- разлитую жидкость нейтрализовать щелочью.