О том, какая кислота самая сильная, спорили не одно поколение химиков. В разные времена это звание получала азотная, серная, соляная кислота. Некоторые считали, что сильнее плавиковой кислоты соединения быть не может. В последнее время получены новые соединения с сильными кислотными свойствами. Может быть, именно среди них имеется самая сильная кислота в мире? В этой статье рассмотрены характеристики наиболее сильных стойких кислот нашего времени и даны их краткие химические характеристики.
Свойства кислот
Все кислоты обладают некоторыми химическими свойствами, которые можно назвать общими для данного класса химических соединений.
- Способность взаимодействовать с металлами, выделяя при этом водород.
- Способность взаимодействовать с основаниями, выделяя при этом соли.
- Способность менять цвет индикаторов – например, вызывать покраснение лакмусовой бумаги.
Во всех вышеназванных свойствах проявляется еще одно «умение» любой известной кислоты – это способность отдавать атом водорода, заменяя его на атом другого химического вещества или молекулу какого-либо соединения. Именно эта способность характеризует «силу» кислоты и степень ее взаимодействия с остальными химическими элементами.
Последствия и профилактика
Отравление кислотами часто заканчивается летальным исходом. При вовремя начатом лечении возможен благоприятный прогноз, но во многих случаях человек остается инвалидом. Действие всех кислот негативно сказывается на состоянии пищеварительного тракта, страдает мозг и нервная система.
Избежать интоксикации возможно при соблюдении осторожности во время работы с кислотами. Токсичные вещества нельзя оставлять в местах, доступных для детей и животных. При использовании токсичных соединений надевают защитную одежду, глаза скрывают за очками, на руках присутствуют перчатки.
Самая страшная и опасная кислота не доступна для простого обывателя. Однако в лабораториях важно соблюдать осторожность при использовании подобных веществ. При возникновении признаков отравления, требуется срочно обратиться в медицинское учреждение.
Суперкислота
Слово «суперкислота» введен в химический словарь в 1927 году, с легкой руки знаменитого химика Джеймса Конанта.
Эталоном крепости этого химического соединения является концентрированная серная кислота. Химическое вещество или какая-либо смесь, превышающая показатель кислотности концентрированной серной кислоты, называется суперкислотой. Значение сверхкислоты определяется ее способностью придавать положительный электрический заряд любому основанию. За базовый параметр для определения кислотности принят соответствующий показатель H2SO4 . Среди кислот сильного действия наблюдаются вещества с довольно необычными названиями и свойствами.
Концентрация вещества
Зачастую химикам приходится решать задачи на определение количества чистой кислоты, находящейся в растворе, в процентах. В таких случаях искомым значением является концентрация.
Это величина, позволяющая определять количественный состав жидкого химического вещества. К примеру, для того, чтобы узнать, сколько чистой серной кислоты находится в разбавленном растворе, необходимо небольшое количество смеси налить в мерный стакан, взвесить и определить искомое значение по таблице плотности. Указанная таблица используется при вычислениях, так как плотность неразрывно связана с концентрацией.
Известные сильные кислоты
Самые известные кислоты из курса неорганической химии — это йодоводородная (HI), бромоводородная (HBr), соляная (HCl), серная (H2SO4) и азотная (HNO3) кислоты. Все они обладают большим показателем кислотности и способны реагировать с большинством металлов и оснований. В этом ряду самой сильной кислотой является смесь азотной и соляной кислоты, получившая название «царская водка». Формула самой сильной кислоты этого ряда — HNO3+3 HCl. Это соединение способно растворять даже драгоценные металлы – такие, как золото и платину.
Как ни странно, плавиковая кислота, которая представляет собой соединение водорода самым сильным галогеном – фтором, в претенденты на звание «Самая сильная кислота в химии» так и не попала. Единственной особенностью этого вещества является способность растворять стекло. Поэтому хранят такую кислоту в полиэтиленовой таре.
В чем опасность H2SO4?
Это соединение без цвета и запаха, получаемое путем сжигания серы или богатых ею руд, последующим окислением сернистого газа в безводный серный и его поглощением водой.
Реагент растворяется в воде в любых соотношениях и при этом выделяет значительное количество тепла. Поэтому во избежание разбрызгивания необходимо приливать данный реактив в воду, а не наоборот.
Соединение разрушающе действует на животные и растительные ткани, поглощая из них жидкость и вызывая их обугливание. Оно способно растворять большинство металлов с образованием сернокислых солей, но слабо воздействует на свинец. За короткое время сжигает хлопок, сахар, шерстяные и деревянные материалы. Вызывает очень глубокие ожоги кожных покровов и слизистых оболочек.
Сильные органические кислоты
Претенденты на титул «Самая сильная кислота в органической химии» — муравьиная и уксусная кислоты. Муравьиная кислота является самой сильной в гомологическом ряду предельных кислот. Свое название она получила из-за того, что некоторая часть ее содержится в выделениях муравьев.
Уксусная кислота чуть слабее муравьиной, но спектр ее распространения гораздо шире. Она часто встречается в соках растений и образуется при окислении различной органики.
Последние разработки в области химии позволили синтезировать новое вещество, способное конкурировать с традиционными органическими веществами. Трифторметансульфокислота имеет показатель кислотности выше, чем у серной. При этом CF3SO3H является стабильной гигроскопичной жидкостью с установленными физико-химическими свойствами при нормальных условиях. На сегодня титул «Самая сильная органическая кислота» может быть присвоен этому соединению.
Многие могут подумать, что степень кислотности не может быть значительно выше показателя серной кислоты. Но в последнее время ученые синтезировали ряд веществ, у которых параметры кислотности в несколько тысяч раз превышают значения серной кислоты. Аномально высокими значениями кислотности обладают соединения, получаемые при взаимодействии протонных кислот с кислотами Льюиса. В научном мире они называются: комплексные протонные кислоты.
Сколько кислоты может убить человека?
Сколько ядовитой кислоты требуется, чтобы получить отравление или наступила смерть? Сильные кислоты незамедлительно проявляют реакцию, поэтому в отдельных случаях достаточно маленькой капли либо одного вдоха.
Количество кислоты, способной спровоцировать отравление, зависит от возраста человека, его физического состояния, иммунной системы, способности организма к сопротивлению вредным веществам. У детей отравление развивается быстрее, чем у взрослых из-за ускоренного обмена веществ. Точную дозировку способен установить медицинский работник.
Магическая кислота
Да. Все правильно. Магическая кислота. Так и называется. Магическая кислота является смесью фтороводорода или фтор сульфороновой кислоты с пентафлоридом сурьмы. Химическая формула этого соединения представлена на рисунке:
Такое странное название магическая кислота получила на рождественской вечеринке химиков, которая произошла в начале 1960 годов. Один из сотрудников исследовательской группы Дж. Олаха показал забавный фокус, растворив восковую свечу в этой удивительной жидкости. Эта одна из самых сильных кислот нового поколения, но вещество, которое превзойдет ее по силе и кислотности, уже синтезировано.
Классификация кислот по составу
Кислоты можно разделить на кислородсодержащие и бескислородные. Не трудно догадаться, что бескислородные не содержат атомов кислорода, а кислородсодержащие — содержат. Кислородсодержащие кислоты образованы соответствующими оксидами, а бескислородные образованы прямым взаимодействием простых веществ.
Таб. Примеры бескислородных и кислородсодержащих кислот, образованных одним и тем же неметаллом
| Бескислородные | Кислородсодержащие |
| HCl | HClO4 |
| H2S | H2SO3 |
| HBr | HBrO |
| HI | HIO2 |
Самая сильная кислота в мире
Carborane acid – карборановая кислота, которая является на сегодняшний день самой сильным соединением в мире. Формула самой сильной кислоты выглядит таким образом: H(CHB11Cl11).
Этот монстр был создан в 2005 году в Калифорнийском университете при тесном сотрудничестве с Новосибирским институтом катализа СО РАН.
Сама идея синтеза возникла в головах ученых вместе с мечтой о новых, невиданных доселе молекулах и атомах. Новая кислота в миллион раз сильнее серной, при этом она совершенно не агрессивна, и самая сильная кислота легко может храниться в стеклянной бутылке. Правда, со временем стекло все-таки растворяется, а при повышении температуры скорость такой реакции значительно увеличивается.
Такая удивительная мягкость обусловлена высокой стабильностью нового соединения. Как и все химические вещества, относящиеся к кислотам, карборановая кислота легко вступает в реакцию, отдавая свой единственный протон. При этом основание кислоты является настолько стабильным, что химическая реакция дальше не идет.
Сильные и слабые реагенты
Если реагент в водном растворе полностью распадается на ионы, то есть диссоциирует, то оно является сильным, поскольку слабые химические соединения никогда не растворяются до конца.
Кроме того, отличить слабую кислоту можно посредством измерения её проводимости. Сильные соединения являются хорошими электролитами. Сильные основания при попадании в воду также распадаются. Следует отметить, что основания также называют гидроксидами или гидроокисями.
Существует специальные перечни слабых и сильных кислот и оснований. Таблица, приведённая ниже, также может использоваться для классификации реагентов.
| Сильная кислота | Слабая кислота | Сильное основание | Слабое основание |
| HCI соляная или хлороводородная | HF фтороводородная | NaOH гидроокись натрия | Mg(OH)2 гидроокись магния |
| HBr бромоводородная | CH3COOH уксусная | KOH гидроокись калия | Fe(OH)2 гидроокись железа (II) |
| HI йодоводородная | H2SO3 сернистая | Ca(OH)2 гидроокись кальция | Zn(OH)2 гидроокись цинка |
| HNO3 азотная | H2S сероводородная | Ba(OH)2 гидроокись бария | NH4OH гидроокись аммония |
| HClO4 хлорная | HNO2 азотистая | LiOH гидроокись лития | Fe(OH)3 гидроокись железа (III) |
| H2SO4 серная | H2SiO3 кремниевая |
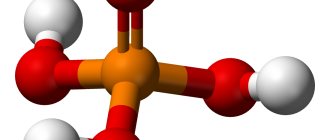
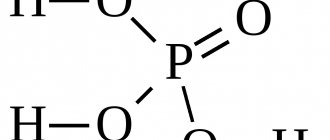
А также следует отметить, что кислородсодержащая угольная (H2CO3) и ортофосфорная (H3PO4) или фосфорная кислоты — слабые. К сильным же необходимо добавить хромовую, которая является средней по силе.
Кроме того, нужно учитывать, что современная химия позволяет учёным создавать новые соединения. В связи с этим список кислот, как сильных, так и слабых, постоянно пополняется.
Химические свойства карборановой кислоты
Новая кислота – отличный донор протона Н+. Именно это и определяет силу этого вещества. Раствор карборановой кислоты содержит больше ионов водорода, чем любая другая кислота в мире. В химической реакции SbF5 — пентафторид сурьмы, связывает илон фтора. При этом высвобождаются новые и новые атомы водорода. Поэтому карборановая кислота и является сильнейшей в мире – взвесь протонов в ее растворе больше аналогичного показателя серной кислоты в 2×1019 раз.
Однако кислотное основание этого соединения потрясающе стабильно. Молекула этого вещества состоит из одиннадцати атомов брома и такого же количества атомов хлора. В пространстве эти частицы образуют сложную, геометрически правильную фигуру, которую называют икосаэдром. Такое расположение атомов является наиболее устойчивым, и это объясняет стабильность карборановой кислоты.
Водородный показатель
При проведении диссоциирующих реакций важно правильно определить уровень кислотности воды. Для его количественного выражения применяется величина pH, называющаяся силой, весом или потенциалом водорода. Она позволяет измерить активность ионов водорода. Если уровень pH превышает 7, то у вещества присутствуют кислотные свойства, если же этот показатель меньше 7, то свойства являются основными.
Способы определения
Результаты химических реакций, в которых участвует любое вещество, напрямую зависят от уровня его кислотности. А потому химики всегда измеряют этот показатель.
Существует несколько методов определения pH:
- Инструментальный способ. В этом случае применяется pH-метр. Этот прибор трансформирует концентрацию протонов в какой-либо жидкости в электрический сигнал.
- Индикаторы. Это вещества, изменяющие оттенок цвет в зависимости от показателя pH. Использование различных индикаторов позволяет получить довольно точные данные об уровне кислотности.
- Соль. Соль представляет собой соединение ионов, которое полностью диссоциирует в слабом водном растворе. Для определения кислотно-щелочных свойств соляного раствора, прежде всего, нужно установить и изучить свойства ионов, находящиеся в растворе.
Буферный раствор
Буферным раствором называется вещество, отличающееся наличием постоянной концентрации ионов водорода.
При добавлении сильной кислоты или такого же основания в небольших дозах эти растворы сохраняют изначальный уровень кислотности.
Для приготовления такой смеси нужно смешать слабое кислое вещество или основание с соответствующей солью.
При изготовлении буферного раствора необходимо учитывать следующие факторы:
- Интервал уровня кислотности, в котором вещество станет эффективным.
- Ёмкость раствора, то есть какой объём сильного кислотного соединения или основания можно добавить в смесь, не изменив её pH.
- При соединении веществ не должно быть реакций, способных повлиять на состав раствора.
Значение карборановой кислоты
Самая сильная кислота в мире принесла своим создателям заслуженные награды и признание в научном мире. Хотя все свойства нового вещества до конца не изучены, уже становится ясным, что значение этого открытия выходит за рамки лабораторий и научно-исследовательских институтов. Карборановую кислоту можно использовать в качестве мощного катализатора при различных промышленных реакциях. Кроме этого, новая кислота может взаимодействовать с наиболее упрямыми химическими веществами – инертными газами. В настоящее время ведутся работы, допускающие возможность вступления в реакцию ксенона.
Несомненно, удивительные свойства новых кислот найдут свое применение в самых различных областях науки и техники.
Лечение при отравлении ядом
До приезда врачей пострадавшему допустимо оказать первую помощь. При отравлении не обойтись без квалифицированной помощи, но некоторые действия способны облегчить состояние пациента.
Рекомендуем: Снежноягодник белый: ядовитое или нет растение
Что делать:
- Если причиной отравления стал газ, то пациента выводят либо выносят на свежий воздух;
- Человека кладут на горизонтальную поверхность, обеспечивают ему полный покой;
- Запрещено промывать желудок, это способно привести к повторному ожогу пищевода;
- На область живота кладут лед, подобное действие поможет остановить внутреннее кровотечение;
- Нельзя давать человеку таблетки и питье, чтобы не спровоцировать негативные последствия.
Классификация кислот по основности
Кислоты могут отдать столько водорода, сколько имеется в их составе (в большинстве случаев, есть исключения). Если может отдать максимум один водород – то кислота относится к одноосновным, если может отдать максимум два протона водорода – то двухосновная и так далее.
Например:
HCl ↔ H+ + Cl‒(одноосновная)
H2SO4 ↔ 2H+ + SO42‒(двухосновная)
H3PO4 ↔ 3H+ + PO43- (трехосновная/многоосновная)
Таб. Примеры кислот с разной основностью
| Одноосновные (один водород) | Двухосновные (два водорода) | Многоосновные (три и более протона водорода) |
| HNO3 | H2S | H3PO4 |
| HF | H2SiO3 | H3BO3 |
| HBrO | H2CO3 | H4P2O7 |
Диссоциация воды
Диссоциация — это распад вещества на составляющие молекулы. Свойства кислоты или основания зависят от равновесия, которое присутствует в воде:
H2O + H2O ↔ H3O+(р-р) + OH-(р-р) Kc = [H3O+][OH-]/[H2O]2 Константа равновесия воды при t=25°: Kc = 1.83⋅10-6, также имеет место следующее равенство: [H3O+][OH-] = 10-14, что называется константой диссоциации воды. Для чистой воды [H3O+] = [OH-] = 10-7, откуда -lg[H3O] = 7.0.
Данная величина (-lg[h3O]) называется pH — потенциал водорода. Если pH < 7, то вещество имеет кислотные свойства, если pH > 7, то вещество имеет основные свойства.
Как можно получить отравление
Синильная кислота является очень токсичной. При попадании в организм человека признаки отравления появляются достаточно быстро. Попасть в организм это вещество может с продуктами, которые её содержат, а также с той продукцией, которая подвергалась обработке цианидами.
Больше всего этого ядовитого вещества содержится в миндальных орехах. Общее количество может доходить до 3%. Человеку достаточно съесть небольшую горсть миндаля, чтобы получить отравление. Помимо этого, такое опасное вещество содержится в косточках ягод и некоторых фруктов. Больше всего кислоты содержат:
- персик – до 2,8%;
- абрикос – до 1,6%;
- слива – до 0,95%;
- вишня – около 0,8%;
- яблоко – приблизительно 0,6%.
В миндальных зёрнышках и ядрышках фруктов синильная кислота присутствует не в чистом виде, а в форме гликозида амигдалина. Именно это вещество придаёт специфический привкус и аромат орешкам. Попав в организм человека, амигдалин распадается на три составляющие, одной из которых и выступает синильная кислота. В особенности богат таким веществом горький миндаль, поэтому взрослым можно кушать такой продукт в небольших количествах, а детям его вообще кушать нельзя.
Симптомы отравления синильной кислотой
Кислота, попадая в кровь, образует соединение с кислородом эритроцитов, блокируя его отщепление и отдачу тканям. В итоге в крови резко повышается концентрация кислорода, а в ткани и органы от не поступает, развивается их гипоксия.
В первую очередь и в наибольшей степени страдает самый деликатный орган – мозг. Все его жизненно важные центры угнетаются, что приводит к угнетению органов и систем, весь организм быстро выходит из строя. Внешние признаки отравления синильной кислотой:
- Насыщенная розовая окраска кожи и слизистых оболочек,
- Головокружение, головная боль, потеря равновесия, онемение губ, расширение зрачков,
- Учащение пульса, загрудинные боли,
- Учащение дыхания, нехватка воздуха,
- Тошнота, рвота,
- Горечь во рту и привкус металла, учащенные позывы на дефекацию.
От пострадавшего при отравлении синильной кислотой при дыхании ощущается характерный запах горького миндаля.
В тяжелых случаях отравления тахикардия сменяется замедлением пульса, быстро возникает потеря сознания, паралич дыхательного центра, развиваются судороги. Если не оказана помощь, смерть наступает в течение 2-3 минут.
Реакции с разбавленной азотной кислотой
Разбавленная азотная кислота реагирует с металлами, расположенными левее и правее водорода. В ходе реакции с активными металлами образуется аммиак, который сразу же растворяется и взаимодействует с нитрат-анионом, образуя еще одну соль. С металлами средней активности кислота реагирует с выделением молекулярного азота. С малоактивными реакция протекает с выделением оксида 2-валентного азота. Чаще всего образуется несколько продуктов восстановления серы в одной реакции. Примеры реакций предложены в графическом приложении ниже.