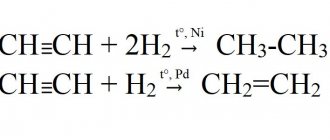Углеводороды, содержащие тройную связь, называются алкинами. К алкинам часто применяют название ацетилены по названию первого члена гомологического ряда. Они образуют гомологический ряд с общей формулой CnH2n-2. По номеклатуре IUPAC названия алкинов образуют путем замены окончания «-ан» в названии соответствующего алкана окончанием «-ин»:
Соответствующие алкинам одновалентные радикалы называются алкинил
,
пропаргил
.
HC≡C–CH2–
В ряду ацетиленов наблюдается структурная изомерия положения тройной связи в углеродной цепи и изомерия алкильных радикалов, связанных с алкинилом.
Пентин-2
В промышленности ацетилен применяется весьма широко и разработан способ его получения термолизом метана
или гидрированием углерода при 3000 °С:
Реакцию проводят, используя электрическую дугу между угольными электродами в токе водорода, т.к. время нагревания должно быть очень коротким во избежание обратного процесса разложения ацетилена на элементы.
Существует также карбидный способ получения некоторых ацетиленов:
Эта реакция представляет собой фактически гидролиз ацетиленидов, которыми по сути являются карбиды металлов.
Среди лабораторных способов получения ацетиленов можно отметить разнообразные реакции элиминирования, среди которых чаще всего используют дегидрогалогенирование виц-
дигалогенидов
Следует иметь в виду, что в щелочной среде алкины склонны к перегруппировкам с миграциейй тройной связи:
Поэтому для элиминирования рекомендуется использовать амид натрия в жидком аммиаке. В этих условиях образуются в основном терминальные ацетилениды, причем в качестве исходных можно применять и гем-
дигалогениды:
Другие способы синтеза подразумевают превращения одних алкинов в другие, они будут рассмотрены ниже.
Атомы углерода в ацетилене имеют sp-гибридизацию и соединены между собой одной s- и двумя p-связями. Поэтому молекула ацетилена линейна (валентный угол 180°). Длина связи СºС составляет 121 пм (для сравнения – в этане 154 пм, в этилене 134 пм), длина связи С-Н – 106 пм (в этане 110 пм, в этилене 107 пм).
Энергия тройной углерод-углеродной связи равна 833 кДж/моль, что меньше, чем суммарная величина энергии для трех σ-связей (339х3=1017 кДж/моль) и комбинации одной σ- и двух π-связей (339 + 2 · 272 = 883 кДж/моль). Это можно рассматривать как результат взаимного отталкивания связывающих электронов трех связей, которые вынуждены быть сближенными в пространстве. Молекулу ацетилена можно представить себе в виде цилиндра, образованного орбиталями π-связей, из торцов которого выходят σ-связи С-Н. Атомы водорода имеют более короткую связь с С-атомами, чем в алкенах и алканах, потому что углеродный атом в гибридном состоянии sp
наиболее электроотрицателен. Причина укорочения связи С-Н в алкинах по сравнению с алкенами и алканами состоит в том, что
sp
-орбиталь, как имеющая больший вклад s-характера (50%), изначально лежит ниже по энергии, чем
sp2
– (33.3%) и
sp3
– (75%) орбитали. Это приводит к увеличению прочности С-Н-связи в ацетиленах (энергия гомолитической диссоциации 502 кДж/моль) относительно прочности С-Н-связей в алканах и алкенах (414 кДж/мол и 439 кДж/моль соответственно). Ацетиленовый протон в значительной степени дезэкранирован, поскольку электронная пара смещена к атому углерода в большей мере, чем к таковым в гибридных состояниях sp 2 и sp 3 . Можно рассматривать sp-атом углерода как более электроотрицательный, чем углерод в других валентных состояниях.
Две вырожденные ВЗМО ацетилена (Е = -1088,6 кДж/моль) лежат ниже, чем ВЗМО этилена (Е = -963 кДж/моль).
Исходя из этих представлений, можно объяснить основные свойства ацетиленов:
– характерными для ацетиленов являются реакции электрофильного и нуклеофильного присоединения;
– терминальным алкинам свойственная повышенная С-Н-кислотность (более высокая, чем в алканах и алкенах).
Основным промышленным способом получения ацетилена является электро- или термокрекинг метана, пиролиз природного газа и карбидный метод.
Карбидный метод (промышленный способ)
Прокаливанием в электрических печах смеси оксида кальция с коксом при 1800—2000°С получают карбид кальция:
При действии на полученный карбид воды образуется гидроксид кальция и ацетилен:
Пиролиз углеводородов (промышленный способ)
Суть способа заключается в пропускании над специальной огнеупорной насадкой смеси природного газа с воздухом, который сгорая поднимает температуру до 1500 °C. Затем на насадке происходит пиролиз метана:
Читать также: Cjx2 2508 контактор схема подключения
Крекинг природного газа (промышленный способ)
Метод заключается в пропускании метана между двумя металлическими электродами с огромной скоростью. Температура 1500—1600°С. С химической точки зрения метод аналогичен методу пиролиза, отличаясь лишь технологическим и аппаратным исполнением.
В этом методе используется частичное окисление метана благодаря использованию теплоты, образующейся при его сгорании:
Метод прямого синтеза
Углерод напрямую взаимодействует с водородом при очень высоких температурах:
Этот метод имеет чисто историческое значение (получение ацетилена в 1863 году М. Бертло).
Электролиз солей непредельных карбоновых кислот
В 1864 году Кекуле получил ацетилен электролизом фумарата и малеата натрия:
Аналогично получается ацетилен и из акрилата натрия.
Этот метод носит чисто историческое значение.
Дегидрогалогенирование галогеналканов и галогеналкенов (лабораторный способ)
Реакция дегидрогалогенирования проводят действием сильного основания на дигалогеналканы:
В качестве дегидрогалогенирующего агента удобно использовать амид натрия в жидком аммиаке:
Получение Ацетилена
В лаборатории ацетилен получают действием воды на карбид кальция.
CaC2+ 2 Н2О = С2Н2↑ + Са(ОН)2
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения:
Учись учиться, не учась!
10080 – | 7747 – или читать все.
91.146.8.87 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock! и обновите страницу (F5)
очень нужно
Бесцветный газ, слаборастворимый в воде, несколько легче атмосферного воздуха, относящийся к классу алкинов и представляющий собой ненасыщенный углерод называют ацетиленом. В его структуре все атомы имеют между собой тройную связь. Это вещество закипает при температуре — 830 °С. Формула ацетилена говорит о том, что в его состав входят только углерод и водород.
Ацетилен – это опасное вещество, которое при неаккуратном обращении с ним может взорваться. Именно поэтому для хранения этого вещества используют специально оснащенные емкости. Газ при соединении с кислородом горит, и температура может достигать 3150 °С.
Получение ацетилена
Ацетилен можно получить в лабораторных и промышленных условиях. Для получения ацетилена в лаборатории достаточно на карбид кальция (это его формула — СаС2) капнуть небольшое количество воды. после этого начинается бурная реакция выделения ацетилена. Для ее замедления допустимо использовать поваренную соль (формула NaCl).
В промышленных условиях все несколько сложнее. Для производства ацетилена применяют пиролиз метана, а так же пропана, бутана. В последнем случае формула ацетилена будет содержать большое количество примесей.
Карбидный способ производства ацетилена обеспечивает производство чистого газа. Но, такой метод получения продукта должен быть обеспечен большим количеством электроэнергии.
Пиролиз не требует большого количества электричества, все дело в том, что для производства газа, необходимо выполнить нагрев реактора и для этого используют газ, циркулирующий в первом контуре реактора. Но в потоке, который там перемещается, концентрация газа довольно мала.
Выделение ацетилена с чистой формулой во втором случае не самая простая задача и ее решение обходится довольно дорого. Существует несколько способов производства формулы ацетилена в промышленных условиях.
Электрический крекинг
Превращение метана в ацетилен происходит в электродуговой печи, при этом ее нагревают до температуры в 2000-3000 °С. При этом, напряжение на электродах достигает 1 кВ. Метан разогревают до 1600 °С. Для получения одной тонны ацетилена необходимо затратить 13 000 кВт×ч. Это существенный недостаток производства формулы ацетилена.
Технологическая схема крекинга
Пиролиз окислительный
Этот способ основан на перемешивании метана и кислорода. После производства смеси, часть ее отправляют на сжигание и полученное тепло отправляют на нагревание сырья до температуры в 16000 °С. Такой процесс отличается непрерывностью и довольно скромными затратами электрической энергии. На сегодня этот метод чаще всего можно встретить на предприятиях по производству ацетилена.
Технологическая схема процесса окислительного пиролиза
Кроме перечисленных технологий производства формулы ацетилена применяют такие как — гомогенный пиролиз, низкотемпературную плазму. Все они отличаются количеством энергетических затрат и в итоге разными характеристиками получаемого газа и его формулой.
Читать также: Компьютер как осциллограф своими руками
Баллоны с ацетиленом
Структурная и молекулярная формула: ацетилен
Баллоны с газами, в т.ч. ацетиленом. Нажмите для увеличения.
Ацетилен можно сжижать и отверждать, однако как в газообразном состоянии при давлении свыше примерно 7 бар, так и в жидком, и в твердом состоянии ацетилен чувствителен к ударному воздействию и взрывоопасен. Поэтому, ацетилен всегда поставляется пользователям в баллонах, растворенным в ацетоне или диметилформамиде и полностью заполненных пористым напонителем Agamassan (или AGA-massan, что расшифровывается в переводе со шведского как «состав AGA». AGA — это название шведской компании-производителя и поставщика промышленных газов, ныне подразделения компании Linde Gas, основанной в свое время изобретателем Agamassan’а Густафом Даленом. В состав Agamassan’а входя асбест, цемент, уголь и кизельгур). Как альтернатива Agamassan’у, может использоваться наполнитель на основе кизельгура или керамики/силикатной извести.
Избыточное давление в ацетиленовых баллонах составляет обычно не более 17 бар, а давление выхода из баллона — не более 1 бара, а обычно порядка 0,5 бара.
Ацетиленовые баллоны обычно снабжены как обычными предохранительными клапанами, срабатывающими при повышении давления, в том числе проходящем и изотермически, так и особыми предохранительными клапанами, срабатывающими при повышении температуры до уровня выше 100°C, выпуская ацетилен в атмосферу. Такие клапаны действуют, как плавкие вставки.
В России, ацетиленовые баллоны окрашены в белый цвет, с красной надписью «Aцетилен».
Преимущества
Упоминание о газовой сварке моментально наводит на мысли об ацетилене. Действительно для этого процесса чаще всего применяют этот газ. Он в сочетании с кислородом обеспечивает самую высокую температуру горения пламени. Но в последние годы из-за развития различных видов сварки использование этого вида соединения металлов несколько снизилось. Более того, в некоторых отраслях произошел полный отказ от применения этих технологий. Но для выполнения определенного вида ремонтных работ она до сих пор остается незаменима.
Применение ацетилена позволяет получить следующие преимущества:
- максимальная температура пламени;
- существует возможность генерации ацетилена непосредственно на рабочем месте или приобретения его в специальных емкостях;
- довольно низкая стоимость, в сравнении с другими горючими газами.
Вместе с тем, у ацетилена есть и определенные недостатки, которые ограничивают его использование. Самый главный — это взрывоопасность. При работе с этим газом необходимо строго соблюдать меры безопасности. В частности, работы должны выполняться в хорошо проветриваемом помещении. При нарушении режимов работы возможно появление некоторых дефектов, например, пережогов.
Применение ацетилена
Ацетилен применяется при всех процессах газопламенной обработки металлов (газовой сварке и газовой резки), благодаря высокой температуре пламени, достигнуть которой при использовании других горючих не удается.
Для пайки, резки, наплавки, газопламенной закалки, металлизации, газопрессовой сварки, сварки цветных металлов и сплавов с успехом применяются газы-заменители ацетилена:
- пропано-бутановые смеси
- городской газ
- природные газы
- водород
- пары бензина
- пары керосина
- МАФ
- и др.
По химическому составу все они, за исключением водорода, представляют собой или соединения, или смеси различных углеводородов.
Правильный выбор и использование газов-заменителей позволяет добиться высокого качества сварки и резки, а при газовой резке металлов малых толщин дает более высокую чистоту резки.
Газовая сварка возможна при условии, что температура пламени в два раза превышает температуру плавления свариваемого металла. Поэтому газы-заменители температура пламени которых ниже, чем у ацетилена применяют для сварки металлов с температурой плавления ниже, чем у сталей
Для газовой резки выбор горючего газа основывается на его теплотворной способности, но необходимо учитывать, что газ при сгорании в смеси с кислородом должен образовывать пламя с температурой не ниже 2000°C.
Влияние примесей в ацетилене на качество сварного шва
Давайте остановимся еще на некоторых особенностях применения ацетилена при газовой сварке – влияние примесей на качество сварного шва. Вредное влияние имеют следующие примеси:
- сероводород
- фосфористый водород
Вышеуказанные примеси обязательно удаляются из ацетилена, не только из-за влияния на качество сварного шва, но также из-за пагубного влияния на органы дыхания и зрения сварщика (см. статью Взрывоопасность, ядовитость и самовоспламенение ацетилена).
Сероводород при сгорании образовывает серную кислоту, которая при переходе в металл сварного шва вызывает красноломкость. Установлено, что наличие сероводорода до 0,007% не оказывает вредного влияния на прочность сварного шва.
Определить наличие сероводорода в ацетилене довольно легко, необходимо поднести фильтровальную бумагу, смоченную в растворе хлористой ртути под струю ацетилена. При наличии сероводорода — бумага побелеет.
Процесс очистки от сероводорода тоже довольно простой – необходимо ацетилен пропустить через воду, в результате чего сероводород растворится в воде.
Фосфористый водород при сгорании образовывает фосфорную кислоту, которая при переходе в металл сварного шва вызывает хладноломкость. Установлено, что наличие фосфористого водорода до 0,027% не оказывает вредного влияния на прочность сварного шва.
Для определения наличия фосфористого водорода необходимо кусок фильтровальной бумаги, смоченный в десятипроцентном растворе азотнокислого серебра поднести под струю ацетилена. При содержании 0,01% фосфористого водорода бумага принимает отчетливую светло- желтую окраску, при содержании более 0,02% — бумага темнеет.
Химическим путем очистка ацетилена от фосфористого водорода производится путем пропускания через особую очистительную массу – гератоль. Гератоль представляет собой массу желтого цвета, которая в результате взаимодействия с фосфористым водородом приобретает зеленый цвет.
Применение ацетилена в химической отрасли
Помимо газопламенной обработки ацетилен используют в области химической промышленности в качестве основного исходного вещества для получения ряда важнейших продуктов органического синтеза: синтетического каучука, пластмасс, растворителей, уксусной кислоты и т. п. Далее мы рассмотрим, как ацетилен используется для получения тех или иных химических соединений.
Уксусный альдегид
Продуктом присоединения воды к ацетилену является уксусный альдегид. Впервые этот синтез был осуществлен М. Г. Кучеровым в 1881 г. Реакция протекает по уравнению:
HC = CH + H2O ? CH3 — CHО
Реакция проводится пропусканием ацетилена через сернокислый раствор соли окиси ртути при температуре 70-80°C.
Применение этой реакции явилось началом промышленного синтеза органических веществ с применением ацетилена в качестве исходного продукта.
Ацетон
При пропускании смеси ацетилена и паров воды в соотношении примерно 1:10 при температуре 430-450°C над цинк-ванадиевым катализатором происходит образование ацетона по уравнению:
2C2H2 + 3H2O ? CH3-CО-CH3 + CО2 + H2О
Указанный процесс нашел применение в промышленных масштабах.
Хлористый винил
При взаимодействии ацетилена с хлористым водородом при 200°C над катализатором, представляющим собой двухлористую ртуть, нанесенную на активированный уголь, образуется хлористый винил по уравнению:
C2H2 + HCl ? CH2 = CHCl
Винилацетат
C уксусной кислотой также в присутствии ртутных солей ацетилен образует винилацетат:
C2H3 + CH3COOH ? CH2 = CH-ОCО-CH3
Хлористый винил и винилацетат широко применяются при производстве пластмасс.
Формула ацетилена
Строение молекулы ацетилена
Ацетилен имеет простую формулу — С2Н2. Относительно дешевый способ его получения путем перемешивания воды и карбида кальция сделал его самым применяемым газом для соединения металлов. Температура с которой горит смесь кислорода и ацетилена вынуждает выделяться твердые частицы углерода.
Ацетилен можно доставить к месту выполнения работ в специальных емкостях (газовых баллонах), а можно получить его непосредственно на рабочем месте используя для этого специально сконструированный реактор. Где происходит смешивание воды и карбида кальция.
Номенклатура
Алкинами, ацетиленовыми углеводородами называют углеводороды, в состав молекул которых входят как минимум два углеродных атома, находящиеся в состоянии sp-гибридизации и соединенные друг с другом тремя связями.
Алкины образуют гомологический ряд с общей формулой СnН2n-2.
Первым членом гомологического ряда является ацетилен имеющий молекулярную формулу С2Н2 и структурную формулу СНСН. В силу особенности sp-гибридизации молекула ацетилен имеет линейное строение. Наличие двух π-связей расположенных в двух взаимно перпендикулярных плоскостях предполагает расположение α-атомов замещающих групп на линии пересечения плоскостей, в которых расположены π-связи. Поэтому связи атомов углерода, затраченные на соединение с другими атомами или группами жестко расположены на линии под углом 1800 друг к другу. Строение системы тройной связи в молекулах алкинов определят их линейное строение.
Особенность строения молекул алкинов предполагает существование изомерии положения тройной связи. Структурная изомерия, обусловленная строением углеродного скелета, начинается с пятого члена гомологического ряда.
1. Изомерия положения тройной связи. Например:
2. Структурные изомеры. Например:
Первый член гомологического ряда носит тривиальное название «ацетилен».
По рациональной номенклатуре ацетиленовые углеводороды рассматриваются как производные ацетилена, Например:
По номенклатуре ИЮПАК названия алкинов образуются заменой суффикса «ан» на «ин». Главную цепь выбирают таким образом, чтобы в нее попала тройная связь. Нумерацию углеродных атомов начинают с того конца цепи, к которому ближе тройная связь. При наличии в молекуле двойной и тройной связей двойная связь имеет меньший номер. Например:
Тройная связь может быть концевой (терминальной, например, в пропине) или «внутренней», например в 4-метил-2-пентине.
При составлении названий радикал -ССН называют «этинил».
Химические и физические свойства
Некоторые химические свойства
Свойства ацетилена во многом определены его формулой. То есть наличием атомов углерода и водорода связанных между собой.
Смешивание ацетилена с водой, при добавлении катализаторов типа солей ртути, приводит к получению уксусного альдегида. Тройная связь атомов, содержащихся в молекуле ацетилена приводит к тому, что при сгорании она выделяет 14 000 ккал/куб. м. В процессе сгорания температура поднимается до 3000 °C.
Этот газ, при соблюдении определенных условий, может превращаться в бензол. Для этого необходимо разогреть его до 4000 °С и добавить графит.
Водород, содержащийся в молекулах показывает кислотные свойства. То есть они довольно легко отрываются от молекулы в виде протонов. Ацетилен в состоянии обесцвечивает воду содержащую бром и раствор «марганцовки».
Молярная масса ацетилена составляет 26,04 г/моль. Плотность ацетилена 1,1 кг/м³.
Физические свойства
В стандартных условиях ацетилен представляет собой бесцветный газ, который практически не растворяется в воде. Он начинает кипеть в -830 °С. При сжимании он начинает разлагаться с выделением большого количества энергии. Поэтому для его хранения применяют стальные баллоны способные хранить газ под высоким давлением.
Этот газ недопустимо выпускать в атмосферу. Его формула может отрицательно сказываться на окружающей среде.
Химические свойства ацетилена:
Химические свойства ацетилена аналогичны свойствам других представителей ряда алкинов. Поэтому для него характерны следующие химические реакции:
- 1. галогенирование ацетилена:
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен);
CHBr=CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-тетрабромэтан).
Реакция протекает стадийно с образованием производных алканов.
В ходе данной реакции ацетилен обесцвечивает бромную воду.
- 2. гидрогалогенирование ацетилена:
СH≡CH + HBr → CH2=CHBr (бромэтен).
- 3. гидратация ацетилена (реакция Михаила Григорьевича Кучерова, 1881 г.):
CH≡CH + H2O → [CH2=CH-OH] (енол) → CH3-CH=O (уксусный альдегид ) (kat = HgSO4, Hg(NO3)2).
- 4. тримеризация ацетилена (реакция Николая Дмитриевича Зелинского, 1927 г.):
3СH≡CH → C6H6(бензол) (kat = активированный уголь, to = 450-500 оС).
Реакция тримеризации ацетилена является частным случаем реакции полимеризации ацетилена и происходит при пропускании ацетилена над активированным углем при температуре 450-500 оС.
- 5. димеризация ацетилена:
СH≡CH + СH≡CH → CH2=CH-С≡CH (винилацетилен) (kat = водный раствор CuCl и NH4Cl).
Реакция димеризации ацетилена является частным случаем реакции полимеризации ацетилена.
- 6. горение ацетилена:
2СH≡CH + 5О2 → 4CО2 + 2H2О.
Ацетилен горит белым ярким пламенем.
- 7. окисление ацетилена.
Протекание реакции и её продукты определяются средой, в которой она протекает.
- 8. восстановления ацетилена:
СH≡CH + Н2 → C2H4 (этилен) (kat = Ni, Pd или Pt, повышенная to);
СH≡CH + 2Н2 → C2H6 (этан) (kat = Ni, Pd или Pt, повышенная to).
Технология и режимы сварки
Ацетилено — кислородные смеси применяют для соединения деталей из углеродистых и низколегированных сталей. Например, этот метод широко применяют для создания неразъемных соединений трубопроводов. Например, труб диаметром 159 мм с толщиной стенок не более 8 мм. Но существуют и некоторые ограничения, так соединение таким методом сталей марок 12×2M1, 12×2МФСР недопустимо.
Выбор параметров режима
Для приготовления смеси необходимой для соединения металлов используют формулу 1/1,2. При обработке заготовок из легированных сталей сварщик должен отслеживать состояние пламени. В частности, нельзя допускать переизбытка ацетилена.
Расход смеси с формулой кислород/ацетилен составляет 100-130 дм 3 /час на 1 мм толщины. Мощность пламени регулируют с помощью горелки, которые подбирают в зависимости от используемого материала, его характеристик, толщины и пр
Для выполнения сварки при помощи ацетилена применяют сварочную проволоку. Ее марка должна соответствовать марке сталей свариваемых деталей. Диаметр проволоки определяют в зависимости от толщины свариваемого металла.
Для удобства технологов и непосредственно сварщиков существует множество таблиц, на основании которых можно довольно легко выбрать сварочный режим. Для этого необходимо знать следующие параметры:
- толщину стенки свариваемых заготовок;
- вид сварки — левый, правый;
Читать также: Греется шина на бензопиле
На основании этого можно определить диаметр присадочной проволоки и подобрать расход ацетилена. К примеру, толщина составляет 5-6 мм, для выполнения работ будет использован наконечник № 4. То есть на основании табличных данных диаметр проволоки будет составлять для левой сварки 3,5 мм, для правой 3. Расход ацетилена в таком случае будет составлять при левом способе 60 -780 дм 3 /час, при правом 650-750 дм 3 /час.
Сварку выполняют небольшими участками по 10-15 мм. Работа производится в следующей последовательности. На первом этапе выполняют оплавление кромок. После этого выполняют наложение корня шва. По окончании формирования корня, можно продолжать сварку далее. Если толщина заготовок составляет 4 мм то сварку допустимо выполнять в один слой. Если толщина превышает указанную, то необходимо наложить второй. Его укладывают только после того, как выполнен корень шва по всей заданной длине.
Для улучшения качества сварки допускается выполнение предварительного нагрева. То есть будущий сварной стык прогревают с помощью горелки. Если принят за основу такой способ, то прогрев надо выполнять после каждой остановки заново.
Выполнение швов газом может выполняться в любом пространственном положении. Например, при выполнении вертикального шва существуют свои особенности. Так, вертикальный шов должен исполняться снизу вверх.
При выполнении сварочных работ перерывы в работе недопустимы, по крайней мере до окончания всей разделки шва. При остановке в работе горелку необходимо отводить медленно, в противном случае, могут возникнуть дефекты шва — раковины и поры. Интересная особенность существует при сварке трубопроводов, в ней не допустим сквозняк и поэтому концы труб необходимо заглушать.
Окисление альдегидов
При окислении альдегидов также образуются карбоновые кислоты или их соли. Альдегиды реагируют с раствором перманганата или дихромата калия в кислой среде при нагревании, а также с гидроксидом меди при нагревании.
| Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота. |
| Например, при окислении альдегидов гидроксидом меди (II) также образуются карбоновые кислоты |
Сложные эфиры в лаборатории получают при взаимодействии карбоновых кислот с одноатомными и многоатомными спиртами (реакция этерификации).
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
Виды ацетилена
Промышленность выпускает два вида ацетилена — твердый и в виде газа.
Газообразный
Ацетилен обладает резким запахом и это дает определённые преимущества при его утечке. По своей массе он близок к атмосферному воздуху.
Жидкий
Жидкий ацетилен не обладает ни каким цветом. У него есть одна особенность он преломляет цвет. Ацетилен и жидкий, и газообразный, представляет собой опасное вещество. То есть при нарушении правил обращения с ним взрыв может произойти в любую секунду, даже при комнатной температуре. Для повышения безопасности при обращении с ним, применяют так называемую флегматизацией. То есть в ёмкости, предназначенной для хранения ацетилена размещают пористое вещество. Которое снижает его опасность
Модели молекулы ацетилена
Формулы, показывающие распределение электронов, послужили фундаментом для создания атомно-орбитальных моделей, пространственных формул молекул (стереохимических). Еще в конце XVIII века получили распространение шаростержневые модели — например, шарики разного цвета и размера, обозначающие углерод и водород, которые образуют ацетилен. Структурная формула молекулы представлена в виде стержней, символизирующих химические связи и их количество у каждого атома.
Шаростержневая модель ацетилена воспроизводит валентные углы, равные 180°, но межъядерные расстояния в молекуле отражаются приблизительно. Пустоты между шариками не создают представления о заполнении пространства атомов электронной плотностью. Недостаток устранен в моделях Дрейдинга, обозначающих ядра атомов не шариками, а точками присоединения стержней друг к другу. Современные объемные модели дают более яркое представление об атомных и молекулярных орбиталях.