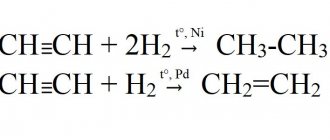Метан CH4
– это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp3:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Метан
– предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
| Например. При нитровании метана образуется преимущественно нитрометан: CH4 + HNO3 = CH3NO2 + H2O |
Анализ радикальной реакции плазменного пиролиза метана»
Автор — tokarna***@rambler.ru
СОДЕРЖАНИЕ
ВВЕДЕНИЕ…………………………………………………………………3
1 Способы получения ацетилена из метана………………………………4
1.1 Физико-химические свойства веществ – участников реакции………5
2 Механизм образования водородной плазмы……………………………7
3 Механизм реакции пиролиза метана в струе водородной плазмы…….7
4 Изучение зависимости изменений концентраций продуктов разложения метана, температуры и скорости плазменной струи от времени……………………………………………………………………………..9
ВЫВОДЫ………………………………………………………………….12
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ……………………..13
ВВЕДЕНИЕ
Современную химическую технологию отличает стремление к использованию все более высоких режимных параметров (температуры, давления, скоростей потоков реагирующих веществ), позволяющих изменить в желаемом направлении прохождения химических реакций. Широкие перспективы в этом отношении открывает использование низкотемпературной плазмы.
Пиролиз углеродсодержащих соединений в плазме восстановительных и инертных газов привлекателен с точки зрения возможности получения непредельных соединений и в первую очередь – ацетилена, а также возможности плазменного производства высококачественной сажи.
Почти вытесненный в 60-е годы прошлого века этиленом и пропиленом ацетилен как химическое сырье все же не утратил своего значения в органическом синтезе в связи с изменением структуры топливного баланса. В настоящее время внимание к ацетилену вновь повысилось. Ацетилен является исходным продуктом в производстве винилацетата, винилхлорида, акрилонитрила и других мономеров с последующим их превращением в полимеры. Наиболее заметно увеличение потребления ацетилена для синтеза 1,4-бутандиола. Кроме того, ацетилен достаточно широко используется в сварочных работах (так называемый «баллонный» ацетилен).
Целью данной работы является анализ реакции пиролиза метана в потоке низкотемпературной плазмы.
Основными задачами анализа являются изучение свойств всех участников реакции, анализ механизма радикальной реакции и изучение зависимости изменений концентраций продуктов разложения метана, температуры и скорости плазменной струи от времени.
1 Способы получения ацетилена из метана
Наиболее распространенным способом производства ацетилена является окислительный пиролиз природного газа или нафты (низкооктанового бензина) при температурах 1600-1800 К за счет экзотермических реакций окисления углеводородов кислородом. Этот процесс значительно вытесняет громоздкий, экологически вредный и энергоемкий карбидный метод. Однако сравнение окислительного пиролиза с плазмохимическим пиролизом по основным показателям демонстрирует преимущества последнего (таблица 1).
Таблица 1 — Сравнение окислительного пиролиза с плазмохимическим пиролизом по основным показателям
| Показатели | Окислительный пиролиз | Плазмохимический пиролиз |
| Расход СН4 (т) на 1 т С2Н2 | 7,5 — 8 | 1,7 |
| Селективность СН4 в С2Н2, % | 30 | 65 — 85 |
| Концентрация С2Н2 в газе пиролиза, % об. | 10 | 12 — 25 |
| Энергоемкость, т.у.т.* 1 т С2Н2 | 11,8 | 6,3 |
*т.у.т. – тонны условного топлива
Как видно из таблицы 1, концентрация ацетилена в продуктах окислительного пиролиза в два раза меньше, чем в плазмохимическом, расход сырья на 1 т ацетилена практически в 2,5 — 3 раза больше в окислительном методе по сравнению с плазмохимическим, энергоемкость (затраты всех видов ресурсов, выраженные в т.у.т.) плазмохимического способа почти в два раза ( 80%) ниже окислительного, себестоимость ацетилена, полученного плазмохимическим способом, по сравнению с окислительным ниже на 40%. К тому же плазмохимический метод получения ацетилена не требует строительства кислородного завода, который необходим для окислительного метода.
При выборе того или иного метода получения ацетилена необходимо провести оценку сырьевой базы, сопутствующих производств, специфики региона.
Сырьем в окислительном производстве являются: 1) углеводороды; 2) кислород; 3) водяной пар. Побочные продукты этого процесса — синтез-газ и азот, требуют своего потребителя.
Для плазмохимического способа необходима потребность: 1) в сырьевой базе — углеродсодержащие вещества различного происхождения и электроэнергия; 2) в потребителе побочной продукции — водорода и сажи.
Производство этилена в настоящее время также столкнулось с рядом проблем при традиционных способах его получения в трубчатых печах. Сырьем в этих процессах являются легкие фракции продуктов нефтепереработки. Однако в связи с изменением структуры потребления нефтепродуктов и повышенным спросом на моторное топливо основным сырьем для производства этилена становятся мазут и другие тяжелые фракции, использование которых в традиционных технологиях весьма затруднительно ввиду значительного выхода смол и углерода. Это также стимулирует внедрение плазмохимических методов пиролиза.
Нетребовательность к сырью — одно из достоинств плазмохимических процессов — дает дополнительное преимущество этому методу. В качестве сырья в плазмохимическом пиролизе с целью получения ацетилена использовался широкий спектр углеродсодержащих материалов, начиная с метана и заканчивая углем.
1.1 Физико-химические свойства веществ – участников реакции
Основные физико-химические свойства веществ – участников реакции приведены в таблице 2.
Таблица 2 — Физико-химические свойства веществ – участников реакции [3]
| Вещество | Температура плавления, ℃ | Температура кипения, ℃ | Применение | Токсическое действие |
| 1 | 2 | 3 | 4 | 5 |
| СН4 (метан) | -182,5 | -161,58 | В качестве топлива, для получения водяного газа, водорода, ацетилена, в производстве сажи, хлористого метила, синильной кислоты. | Первые признаки асфиксии (учащение пульса, увеличение объема дыхания и т. д.) начинает обнаруживаться, когда содержание кислорода в воздухе падает на 25-30 %; смесь из 80% метана и 20% кислорода вызывает головную боль. Класс опасности – 4. |
| НС СН (ацетилен) | -80,0 | 83,8 | Для автогенной сварки, для осветительных целей; как исходный продукт для получения уксусного альдегида, виниловых эфиров, хлористого винила, тетрахлорэтана, нитрила акриловой кислоты и т. д. | Сильное возбуждение, сменяющееся коматозным состоянием, синюхой, неподвижностью зрачков, слабым и неправильным пульсом. Класс опасности – 4. |
| Н2С=СН2 (этилен) | -169,2 | -103,7 | Сырье в производстве полиэтилена, окиси этилена, этилового спирта, этаноламинов, ПВХ, тиокола и др. | Запах ощущается при концентрации 0,02 – 0,026 мг/л. Быстрый наркоз без заметной стадии возбуждения наступает при 80 % этилена с О2. Класс опасности – 4. |
| Н3С-СН3 (этан) | -182,8 | -89 | Основное использование этана в промышленности — получение этилена. | Малотоксичен. Обладает наркотическим действием. Класс опасности – 4. |
| С (сажа) | — | 360 – 380 (температура воспламенения) | При производстве резин и типографской промышленности в качестве красителя. | Класс опасности – 4. |
| Н2 (водород) | -259,14 | -252,8 | Для синтеза аммиака, карбамида, метанола; при гидрогенизации жиров, нефтепродуктов, углей и смол; как восстановитель; для автогенной резки и сварки; для наполнения аэростатов, метеорологических шаров-зондов. | Физиологически инертный газ. Вызывает удушение в очень высоких концентрациях из-за уменьшения нормального давления кислорода. Наркотическое действие проявляется при очень высоких давлениях. Класс опасности – 2. |
Все вещества – участники реакции не относятся к высокотоксичным веществам и находят широкое применение как в химической, так и в нефтехимической отраслях.
2 Механизм образования водородной плазмы
В плазмотрон между двух электродов поступает газ – водород. Через электроды (один- графитовый, второй – ферритовый) проходит электрический ток. Под действием электрического тока по следующей схеме образуется молекулярный ион водорода и электрон:
Образовавшийся электрон переносится на поверхность металла.
Молекулярный ион водорода под воздействием электрического тока диссоциирует на ион водорода и атом водорода:
Затем происходит ионизация атома водорода:
Таким образом, образуется частично ионизированный газ, содержащий нейтральные атомы (молекулы) и заряженные частицы (ионы и электроны).
3 Механизм реакции пиролиза метана в струе водородной плазмы
Основным видом углеводородного сырья для получения ацетилена является природный газ – метан. Реакция проходит при 1500 — 1600 и при атмосферном давлении в струе водородной плазмы, которая является высокотемпературным теплоносителем.
Главной трудностью для получения ацетилена пиролизом природного газа является необходимость создания высоких температур и подвода больших количеств тепла на эндотермическую реакцию образования ацетилена из метана.
В общем виде реакция получения ацетилена из метана и ее мольный баланс в потоке плазмы имеет вид:
СН4 НС СН + Н2С=СН2 + Н3С-СН3 + С + СН4 + Н2 – 90
1 0,60 0,21 0,05 0,01 0,06 0,77
Температура плазменной струи в начале процесса очень быстро падает за счет передачи тепла введенному метану и протекания эндотермических реакций его разложения.
Образование ацетилена из метана проходит по механизму, предложенному Касселем. Активные атомы водорода, входящие в состав плазмы, отрывают водород у молекулы метана, образуя соответствующие радикалы:
От молекулы этилена легче оторвать водород, так как энергия связи С-С в молекуле этилена равна 101,16 , а энергия связи С-Н равна 85,56 .
Стадия обрыва цепи:
Термодинамическая устойчивость ацетилена при температурах выше 1100 К больше, чем других углеводородов. Однако при очень высоких температурах идут конкурентные реакции уплотнения и распада ацетилена [6, с.64].
НС СН С + Н2 + 54,9
В связи с этим пиролиз с целью получения ацетилена ведут при очень малых временах контакта с быстрой «закалкой» продуктов реакции.
4 Изучение зависимости изменений концентраций продуктов разложения метана, температуры и скорости плазменной струи от времени
Важной предпосылкой научной разработки плазмохимического процесса пиролиза метана является расчет кинетики этого процесса. На электронной вычислительной машине была численно проинтегрирована система уравнений гидродинамики и химической кинетики высокотемпературной газовой струи, в которой происходит разложение метана и «закалка» ацетилена. Уравнения химической кинетики были записаны исходя из предположения образования ацетилена из метана по известной схеме Касселя. Результаты решения этой системы уравнений приведены на рисунках 1, 2, 3. [1, с.283].
Рисунок 1 – Зависимость изменений концентраций продуктов разложения метана, температуры и скорости плазменной струи от времени
Как видно из рисунка 1, на первых стадиях реакции происходит быстрое понижение температуры. Такое понижение температуры объясняется протеканием в основном эндотермической реакции разложения метана, идущей при начальной температуре реакции с весьма высокой скоростью.
Рисунок 2 – Зависимость изменений концентраций продуктов разложения метана, температуры и скорости плазменной струи от времени
Как видно из рисунка 2, с понижением температуры скорость разложения метана резко падает, происходит самопроизвольное торможение реакции, которое может быть названо автозакалкой, в отличие от принудительной закалки, осуществляемой путем специальных внешних воздействий.
Рисунок 3 – Зависимость изменений концентраций продуктов разложения метана, температуры и скорости плазменной струи от времени
Как видно из рисунка 3, на дальнейших стадиях реакции происходит разложение ацетилена до сажи и водорода, сопровождающееся выделением тепла и повышением температуры. Для устранения нежелательного разложения ацетилена необходимо провести принудительную закалку. Место, время и скорость принудительной закалки определяются кинетикой рассматриваемых процессов. Кинетический расчет позволил оценить величину скорости принудительного понижения температуры, необходимую для сохранения образовавшегося ацетилена. Она составляет ~ 106 град/сек.
Поскольку промышленный интерес может представлять пиролиз метана в плазменной струе водорода, в лабораторной установке в качестве плазмообразующего газа также был применен водород. Выбор водорода в качестве плазмообразующего вещества обусловлен прежде всего тем, что водород является одним из основных продуктов реакции, объемный выход которого в три раза превышает объемный выход ацетилена. Следовательно, в условиях промышленного производства процесс пиролиза метана в водородной плазменной струе оказывается с избытком обеспеченным водородом в качестве рабочего тела для плазмотрона. Кроме того, при температуре около 4500-5000 К водород, почти полностью диссоциированный на атомы, является эффективным теплоносителем и реагентом. Он также препятствует образованию сажи и, кроме того, оказывает существенное влияние на химию процесса.
ВЫВОДЫ
- Изучена реакция плазменного пиролиза метана, целевым продуктом которой является ацетилен. Однако при температурах выше 1100 К идут конкурентные реакции уплотнения и распада ацетилена, в связи с чем пиролиз ведут с быстрой «закалкой» продуктов реакции.
- Изучена зависимость изменений концентраций продуктов разложения метана, температуры и скорости плазменной струи от времени и установлено, что температура плазменной струи в начале процесса очень быстро падает за счет передачи тепла введенному метану и протекания эндотермических реакций его разложения. В конце процесса температура несколько повышается в связи с выделением тепла при начинающемся распаде ацетилена на углерод и водород.
Окисление метана
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:
- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
Продукт реакции – так называемый «синтез-газ».
Способ получения ацетилена из метана
Способ получения ацетилена из метана
Иллюстрации
Показать все
Изобретение относится к способу получения ацетилена окислительным пиролизом метана в присутствии кислорода и катализатора, характеризующемуся тем, что катализатор нагревают пропусканием через него электрического тока до температур 700-1200°С, в качестве катализатора используют термообработанный на воздухе при температурах 900-1100°С фехралевый сплав, а соотношение метан:кислород изменяют в интервале значений 5:1-15:1. Применение настоящего способа позволяет увеличить выход и селективность процесса. 1 з.п. ф-лы, 1 табл., 1 ил.
Реферат
Изобретение относится к области нефтеперерабатывающей, нефтехимической промышленности и к газопереработке, а именно к способу получения ацетилена из метана.
Как известно, до сих пор не существует приемлемой технологии использования попутных и нефтяных газов, которые десятками миллионов тонн в год сжигаются в факелах. Есть несколько направлений по разработке технологий утилизации этого углеводородного сырья, по которым проводятся исследования. Это, например, разложение C1-С3 парафинов с получением водорода в качестве основного целевого продукта. Другой путь — превращение природного газа в химические продукты, который основан на сложном энерго- и капиталоемком процессе предварительного превращения в синтез-газ.
В последнее время вызывает интерес одноступенчатый процесс превращения метана в химические продукты, например, высокотемпературный (≥900°С) окислительный пиролиз C1-С3 газов до ацетилена. Факт образования ацетилена при неполном сгорании углеводородов известен давно (Евланов С.Ф., Лавров Н.В. // Научные основы каталитической конверсии углеводородов, 1977, с.210-232). При оптимизации выхода ацетилена упор делался на конструирование различных видов горелок и подбор различных условий сгорания углеводородного сырья. Процесс окислительного пиролиза имеет ряд особенностей: очень короткая продолжительность нахождения исходных веществ в реакторе (несколько миллисекунд), высокая температура реакции (1200-1400°С), давление — атмосферное или несколько повышенное, резкое охлаждение реакционных продуктов до температуры ниже 300°С с использованием в качестве охлаждающей среды воды или масла (резкое охлаждение позволяет предотвратить разложение получаемого ацетилена на углерод и водород).
В патенте EP №0178853 приводится технология, согласно которой часть метана частично сжигают, и высокотемпературную газовую смесь (Т>1000°С) пропускают через псевдоожиженный или фонтанирующий слой частиц инертного материала: шамота, кварца, корунда, диоксида циркония, карборунда и др. для уменьшения температурного градиента в потоке газа. При этом максимальная селективность и выход по С2+-углеводородам равны 30% при конверсии метана 62.8% при 1151°С.
Недостатком указанного способа является то, что часть метана расходуется в качестве топлива для нагрева всей массы газа до 1200-1400°С. Кроме того, для сохранения менее прочных, чем метан, молекул С2+ углеводородов применяется закаливание всей смеси водой, т.е. быстрое охлаждение смеси до ~300°С, что весьма усложняет технологию.
Известны работы по исследованию окислительной конденсации метана, в которых основное внимание уделялось поиску катализаторов и исследованию механизма реакции, протекающей при 650-850°С (В.С.Арутюнов, О.В.Крылов. Окислительные превращения метана. М.: Наука, 1998). Именно при указанных температурах (650-850°С) возможно получение значительных выходов этана и этилена при окислении метана.
Наиболее близким к предлагаемому является способ получения углеводородов С2-С4, где впервые был использован термин «каталитический окислительный пиролиз метана» (А.с. СССР №1216937, прототип). Данный способ осуществляют при 800-950°С, времени контакта 0,1-2,5 с, содержании в исходной смеси 10-20 об.% кислорода и 90-80 об.% метана в присутствии катализатора состава, мол.%: Bi2O3 0,95-7,59 и МеО 92,41-99,05, где Me — Mg, Ca, Sr, Ва. Катализатор позволил увеличить выход углеводородов С2+ до 10 мол.% на пропущенный метан при селективности 78,5%. Тем не менее, основными продуктами являются этан и этилен. Ацетилена в получаемой смеси нет, и конверсия метана очень мала — до 20%, что дает низкие выходы по продуктам.
Целью данного изобретения является увеличение выхода и селективности процесса по ацетилену за счет использования катализатора нового типа и изменения технологии окислительного пиролиза.
Предлагаемый способ получения ацетилена окислительным пиролизом метана в присутствии кислорода включает использование в качестве катализатора термообработанного на воздухе при 900-1100°С фехралевого сплава в виде спиралей, лент, стержней и других форм. Нагревание катализатора осуществляют пропусканием через него электрического тока до температур 700-1200°С, а соотношение метан: кислород изменяют в интервале значений 5:1-15:1.
Контакт кислородсодержащих смесей на основе метана в определенных пропорциях СН4/О2 (воздух) с проволокой из термообработанного фехраля, нагрето и электрическим током до температур от 750°С до >1200°С дает каталитический эффект с изменением селективности по С2-углеводородам по сравнению с газофазным, окислительным пиролизом метана. Газовая смесь подается холодной, и только контакт с раскаленным фехралевым сплавом приводит к каталитическому эффекту. Так как газовая смесь подается холодной, проскок части холодного газа приводит к резкому охлаждению продуктов реакции, образовавшихся при контакте с высокотемпературной фехралью, т.е. к закаливанию продуктов окислительного пиролиза и повышению выхода C2-углеводородов, в первую очередь, ацетилена.
В качестве катализатора использован сплав «фехраль» в виде различных форм, преимущественно в виде проволоки диаметром 0,25 мм.
Марка сплава: Х 23 Ю5 Т, состав: С — до 0,05%; Si — до 0,5%; Mn — до 0,3%; Ni — до 0,6%; S — до 0,015%; Р — до 0,03%; Cr — 22-24% Се — до 0,1%; Ti — 0,2-0,5%; Al — 5-5,8%; Ca — до 0,1%; остальное железо. Изготовитель — ОАО металлургический , ГОСТ 12766 1-90.
Подготовка фехраля включала в себя несколько операций: проволоку или ленту массой 0,26-0,28 г скручивали в спираль с внешним диаметром 5 мм, обезжиривали промыванием в ацетоне и прокаливали на воздухе в муфельной печи при температуре 1000°С в течение 21 ч. В результате такой окислительной термообработки на поверхности сплава образуется оксидный слой, состоящий в основном из оксида алюминия.
Подготовленную таким образом спираль надевали на керамическую трубку диаметром 2 мм и помещали в проточный реактор.
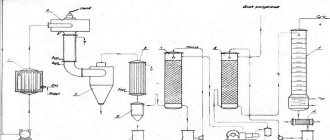
Схема установки для окислительного пиролиза метана представлена на чертеже: а — вид спереди, б — вид сбоку. Схема установки включает кварцевый реактор 1, фехралевую спираль 2 на керамической трубке 3, лабораторный автотрансформатор (ЛАТР) 4, окно из оптического кварца 5 и оптический пирометр 6 с лазерным наведением на спираль.
Реактор работает следующим образом. На спираль 1 при помощи ЛАТР’а 3 подают напряжение, что позволяет нагревать ее до необходимых температур от 700 до 1200°С. Фиксацию температуры проводят с использованием оптического пирометра 6 (ПД-7, , г.Омск) с лазерным наведением на спираль. Для этого реактор снабжен окном из оптического кварца 5. На разогретую проволоку подают исходный реакционный газ. Газ контактирует с разогретой спиралью и выходит. Пробу смеси после реактора направляют на хроматографический анализ, который проводят на хроматографе марки ЦВЕТ-500М. Содержание остаточного метана, а также образующегося этана, этилена и ацетилена фиксируют с помощью детектора по ионизации в пламени. Условия хроматографирования: капиллярная колонка с неподвижной фазой SiO2 длиной 15 м, давление газа-носителя — азот — 1 кгс/см2, расход воздуха 300 мл/мин, расход водорода 30 мл/мин, температура колонки 50°С.
Предлагаемый способ проиллюстрирован примерами.
Пример 1.
Реакционную смесь состава: 15 об.% метана и 85 об.% азота (без кислорода, соотношение метан/кислород 1/0) пропускают через реактор при температуре спирали 1100°С с объемной скоростью 76 мл/мин. Спираль изготовлена из проволоки диаметром 0,25 мм. Конверсия метана и селективности по продуктам приведены в таблице.
Пример 2-3.
Аналогичны примеру 1, но реакционную смесь пропускают через реактор при температуре спирали 760°С и 890°С соответственно. Спираль изготовлена из ленты шириной 1 мм и толщиной 0,4 мм. Конверсия метана и селективности по продуктам приведены в таблице.
Пример 4.
Аналогичен примеру 1, но реакционную смесь пропускают через реактор при температуре спирали 970°С. Конверсия метана и селективности по продуктам приведены в таблице.
Пример 5.
Аналогичен примеру 1, но реакционную смесь состава: 15 об.% метана, 1 об.% кислорода (соотношение метан/кислород 15/1) и 84 об.% азота пропускали через реактор при температуре спирали 1170°С.
Пример 6 и 7.
Аналогичны примеру 5, но реакционную смесь пропускают через реактор при температуре спирали 1000°С и 960°С.
Пример 8.
Аналогичен примеру 5, но реакционную смесь пропускают через реактор при температуре спирали 830°С. Спираль изготовлена из ленты шириной 1 мм и толщиной 0,2 мм.
Пример 9.
Аналогичен примеру 5, но реакционную смесь пропускают через реактор при температуре проволоки 750°С.
Пример 10.
Реакционную смесь состава: 15 об.% метана, 1 об.% кислорода (соотношение метан/кислород 15/1) и 84 об.% азота пропускают через реактор при температуре спирали 1160°С и скорости потока через реактор 80 мл/мин.
Пример 11.
Аналогичен примеру 10, но реакционную смесь состава: 20 об.% метана, 1,33 об.% кислорода (соотношение метан/кислород 15/1) и 78,67 об.% азота пропускают через реактор при температуре спирали 1150°С.
Пример 12.
Реакционную смесь состава: 15 об.% метана, 1,67 об.% кислорода (соотношение метан/кислород 9/1) и 83,33 об.% азота пропускают через реактор при температуре проволоки 760°С. Скорость потока 75 мл/мин. Спираль изготовлена из проволоки диаметром 0,25 мм.
Пример 13 и 14.
Аналогичны примеру 12, но реакционную смесь пропускают через реактор при температуре проволоки 850°С и 930°С соответственно. Спираль изготовлена из ленты шириной 1 мм и толщиной 0,4 мм.
Пример 15, 16 и 17.
Аналогичны примеру 12, но реакционную смесь пропускают через реактор при температуре проволоки 1040°С, 1110°С и 1230°С соответственно.
Конверсия метана и селективности по продуктам приведены в таблице. Как видно из таблицы, данное изобретение позволяет получать ацетилен с селективностью до 41,8% и этилен с селективностью 3,3%, конверсия метана 56,4%.
Значительно увеличен общий выход по С2 — углеводородам — 25,5% (максимальный по прототипу составляет 9,7%).
1. Способ получения ацетилена окислительным пиролизом метана в присутствии кислорода и катализатора, отличающийся тем, что катализатор нагревают пропусканием через него электрического тока до температур 700-1200°С, в качестве катализатора используют термообработанный на воздухе при температурах 900-1100°С фехралевый сплав, а соотношение метан:кислород изменяют в интервале значений 5:1-15:1.
2. Способ по п.1, отличающийся тем, что термообработанный фехралевый сплав используют в виде спиралей, лент, стержней.
Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH →R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия:
Тренировочные задания
1. Для метана верны следующие утверждения:
1) его молекула образована атомом углерода в sp-гибридном состоянии 2) это низкокипящая жидкость, хорошо растворимая в воде 3) это низкокипящий газ, плохо растворимый в воде 4) является основным компонентом природного газа 5) легко реагирует с разбавленной серной кислотой
2. Для метана верны следующие утверждения:
1) его молекула образована атомом углерода в состоянии sp2-гибридизации 2) метан реагирует с парами разбавленной азотной кислоты 3) метан обладает характерным неприятным запахом 4) сгорает на воздухе с образованием угарного газа и воды 5) сгорает на воздухе с образованием углекислого газа и воды.
3. Для этана верны следующие утверждения:
1) это бесцветный газ, немного легче воздуха 2) это бесцветный газ, немного тяжелее воздуха 3) при его взаимодействии с водой образуется этиловый спирт 4) при его дегидрировании образуется этилен 5) все атомы углерода в нём — третичные
4. Для этана верны следующие утверждения:
1) оба атома углерода в его молекуле являются первичными 2) не реагирует с гидроксидом натрия 3) реагирует с серной кислотой 4) реагирует с метаном 5) обладает резким неприятным запахом
5. Для этилена верны следующие утверждения:
1) оба атома углерода в его молекуле находятся в состоянии sp2-гибридизации 2) плотность паров этилена равна плотности паров азота 3) не реагирует с водой 4) не сгорает в кислороде 5) не присоединяет хлор
6. Для этилена верны следующие утверждения:
1) при нормальных условиях это легкокипящая жидкость, хорошо растворимая в воде 2) оба атома углерода в его молекуле находятся в состоянии sp3-гибридизации 3) взаимодействует с водой с образованием уксусной кислоты 4) взаимодействует с бромной водой с образованием 1,2-дибромэтана 5) взаимодействует с водой с образованием этилового спирта
7. Для ацетилена верны следующие утверждения:
1) при нормальных условиях это газ, пары которого легче воздуха 2) при нормальных условиях это газ, пары которого тяжелее воздуха 3) не реагирует с бромом 4) реагирует с водой с образованием этанола 5) реагирует с водой с образованием уксусного альдегида
8. Для ацетилена верны следующие утверждения:
1) атомы углерода в его молекуле находятся в состоянии sp2-гибридизации и соединены двойной связью 2) атомы углерода в его молекуле соединены тройной связью и находятся в состоянии sp-гибридизации 3) при его сгорании в кислороде образуется угарный газ и вода 4) при его сгорании в кислороде образуется углекислый газ и вода 5) реагирует с азотом