Химическое соединение
Карбид кальция
| Имена | |
| Предпочтительное название IUPAC Ацетилид кальция | |
| Систематическое название ИЮПАК Этиндиид кальция | |
| Другие имена Перкарбид кальция Карбид кальция Дикарбид кальция | |
| Идентификаторы | |
| Количество CAS |
|
| 3D модель (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.000.772 |
| Номер ЕС |
|
| PubChem CID |
|
| UNII |
|
| Панель управления CompTox (EPA) |
|
ИнЧИ
| |
Улыбки
| |
| Характеристики | |
| Химическая формула | CaC2 |
| Молярная масса | 64.099 г / моль |
| Внешность | От белого порошка до серых / черных кристаллов |
| Плотность | 2.22 г / см3 |
| Температура плавления | 2160 ° С (3920 ° F, 2430 К) |
| Точка кипения | 2300 ° С (4170 ° F, 2570 К) |
| Растворимость в воде | Быстрый гидролиз |
| Структура | |
| Кристальная структура | Тетрагональный [1] |
| Космическая группа | D174ч, I4 / ммм, tI6 |
| Координационная геометрия | 6 |
| Термохимия | |
| Стандартный моляр энтропия (S о298) | 70 Дж · моль−1· K−1 |
| Станд. Энтальпия формирование (ΔжЧАС ⦵298) | −63 кДж · моль−1 |
| Опасности | |
| Главный опасности | Реагирует с водой с выделением ацетилен газ[2] |
| Пиктограммы GHS | |
| Сигнальное слово GHS | Опасность |
| Формулировки опасности GHS | H260 |
| NFPA 704 (огненный алмаз) | 4 1 2 W |
| Самовоспламенение температура | 305 ° С (581 ° F, 578 К) (ацетилен) |
| Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Y проверять (что YN ?) | |
| Ссылки на инфобоксы | |
Карбид кальция
, также известный как
ацетилид кальция
, это химическое соединение с химическая формула из C2. Его основное промышленное использование — производство ацетилен и цианамид кальция.[3]
Чистый материал бесцветен, однако кусочки технический карбид кальция серого или коричневого цвета и состоит примерно на 80–85% из CaC2 (остальное — CaO (оксид кальция), Ca3п2 (фосфид кальция), CaS (сульфид кальция), Ca3N2 (нитрид кальция), SiC (Карбид кремния), так далее.). При наличии следов влаги технический карбид кальция издает неприятный запах, напоминающий запах чеснока.[4]
Применение карбида кальция включает производство ацетилен газа, а также для производства ацетилена в карбидные лампы; производство химикатов для удобрений; и в сталеплавильном производстве.
Физические свойства
- Бесцветные тетрагональные кристаллы.
- Плотность: 228 (+20 °C, г/см3).
- Удельная теплоёмкость при постоянном давлении (в Дж/г·K): 0,92 (+20—325 °C).
- Стандартная энтальпия образования ΔfH (298 К, кДж/моль): −62,8 (т).
- Стандартная энергия Гиббса образования ΔfG (298 К, кДж/моль): −67,8 (т).
- Стандартная энтропия образования S (298 К, Дж/моль·K): 70,3 (т).
- Стандартная мольная теплоёмкость Cp (298 К, Дж/моль·K): 62,34 (т).
- Энтальпия плавления ΔHпл (кДж/моль): 32,2.
- Карбид кальция имеет резкий чесночный запах.
Рекомендации
- Массалимов, И. А .; Киреева, М. С .; Сангалов, Ю. А. (2002). «Структура и свойства механоактивированного пероксида бария». Неорганические материалы
.
38
(4): 363. Дои:10.1023 / А: 1015105922260. S2CID 91881752. - Информация о рейтинге опасности NFPA для обычных химических веществ. Северо-Восточный университет
- Патнаик, Прадёт (2003). Справочник неорганических химических соединений
. Макгроу-Хилл. ISBN 0-07-049439-8 . - Винколи, Джеффри Уэйн (25 ноября 1996 г.). Управление рисками для опасных химических веществ
. CRC Press. п. 429. ISBN 978-1-56670-200-3 . - ^ абcd
Гринвуд, Норман Н.; Эрншоу, Алан (1997).
Химия элементов
(2-е изд.). Баттерворт-Хайнеманн. п. 298. ISBN 978-0-08-037941-8 . - Рассчитано на основе данных в CRC Справочник по химии и физике
. - ^ аб
Карбид кальция, Бернхард Лангхаммер, Энциклопедия промышленной химии Ульмана, Wiley Interscience. (Требуется подписка) - Фриман, Гораций (1919). «Производство цианамида». Химические новости и журнал физических наук
.
117
: 232. - Морхед, Дж. Т. и де Шалмот, Г. (1896). «Производство карбида кальция». Журнал Американского химического общества
.
18
(4): 311–331. Дои:10.1021 / ja02090a001.CS1 maint: несколько имен: список авторов (связь) - Муассан, Х. (1892). «Chimie Minérale — Description d’un nouveau four électrique». Comptes rendus hebdomadaires des séances de l’Académie des Sciences
.
115
: 1031. - Ренуф, Эдвард (1899). «Использование ацетилена». Ежемесячный научно-популярный журнал
: 335–347. - «Zgrada Prve hidrocentrale na Balkanu — Komisija za očuvanje nacionalnih spomenika». old.kons.gov.ba
(на сербохорватском). КОНС. Получено 15 марта 2022. - ^ аб
Гринвуд, Норман Н.; Эрншоу, Алан (1997).
Химия элементов
(2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8 . - Дун, Я (23.01.2006). «Неприятности в индустрии ПВХ». Совет по развитию торговли Гонконга. Архивировано 28 декабря 2007 года.CS1 maint: BOT: статус исходного URL-адреса неизвестен (связь)
- «Правительство принимает меры по сдерживанию развития карбида кальция». China Daily через BusyTrade.com. 2007-05-16. Архивировано 11 февраля 2007 года.CS1 maint: BOT: статус исходного URL-адреса неизвестен (связь)
- Лаксон, Джейми; Шлаг, Стефан; Токи, Горо (декабрь 2004 г.). «Карбид кальция». НИИ Консалтинг.
- «Спелеологическое снаряжение и культура (из энциклопедии Новой Зеландии Те Ара)».
- Клеммер, Грегг (1987). Карбидные лампы американских горняков: руководство для коллекционеров по освещению американских карбидных шахт
. Публикации Westernlore. - Абелес, Ф. Б. и Гахаган, Х. Э. III (1968). «Поглощение: роль этилена, аналогов этилена, двуокиси углерода и кислорода». Plant Physiol.43
(8): 1255–1258. Дои:10.1104 / стр.43.8.1255. ЧВК 1087003. PMID 16656908.CS1 maint: несколько имен: список авторов (связь) - «Ставка на это. Ваше манго созревает с использованием карбида». ДНК
. 2013-05-18. Получено 2018-08-25. - «Употребление в пищу искусственно созревших фруктов вредно».
- «Carbidschieten wordt feest» (на голландском). Алгемин Дагблад. 2016-12-24.
- Сингх, Рандхир. «Определение содержания воды в почве — метод карбида кальция». Портал гражданского строительства
. Получено 7 сентября 2022. - ASTM International. «ASTM D4944-18, Стандартный метод испытаний для определения содержания воды (влаги) в почве в полевых условиях с помощью измерителя давления газа карбида кальция». ASTM International. Получено 7 сентября 2022.
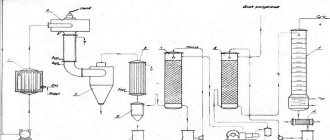
Внешний вид и характеристики технического карбида кальция
Карбид кальция получают сплавлением в электрических печах кокса и негашеной извести. Расплавленный карбид кальция выпускается из печи в специальные формы — изложницы, в которых он затвердевает. Застывший карбид кальция дробится и сортируется на куски определённых размеров.
Технический карбид кальция представляет собой твёрдое кристаллическое вещество. По внешнему виду карбид кальция представляет собой твёрдое вещество тёмно-серого или коричневого цвета. Он даёт кристаллический излом серого цвета с различными оттенками в зависимости от чистоты. Карбид кальция жадно поглощает воду. При взаимодействии с водой даже на холоде карбид кальция разлагается с бурным выделением ацетилена и большого количества тепла. Разложение карбида кальция происходит и под влиянием атмосферной влаги.
По ГОСТ 1460-56 установлены следующие размеры (грануляция) кусков карбида кальция: 2×8; 8×15; 15×25; 25×80. Технический карбид кальция содержит до 80 % химически чистого карбида кальция, остальное составляют примеси — негашеная известь, углерод, кремнекислота и другое.
Производство
Карбид кальция промышленно производится в электродуговая печь из смеси Лайм и кокс примерно при 2200 ° C (3990 ° F).[5] Это эндотермическая реакция требуется 110 килокалорий (460 кДж) на моль[6] и высокие температуры для удаления окиси углерода. Этот метод не изменился с момента его изобретения в 1892 году:
CaO + 3 C → CaC2 + CO
Высокая температура, необходимая для этой реакции, практически недостижима при традиционном сжигании, поэтому реакцию проводят в электродуговой печи с графит электроды. Полученный карбидный продукт обычно содержит около 80% карбида кальция по весу. Карбид измельчается, образуя небольшие комочки размером от нескольких до 50 мм. Примеси концентрируются в более мелких фракциях. ЦК2 Содержание продукта определяют путем измерения количества ацетилена, образующегося при гидролизе. Например, британские и немецкие стандарты содержания более крупных фракций составляют 295 л / кг и 300 л / кг соответственно (при давлении 101 кПа и температуре 20 ° C (68 ° F)). Примеси, присутствующие в карбиде, включают фосфид, который производит фосфин при гидролизе.[7]
Эта реакция была важной частью Индустриальная революция в химии, и это стало возможным в Соединенных Штатах в результате огромного количества недорогих гидроэлектростанция произведено на Ниагарский водопад до рубежа 20-го века.[8]
Способ производства в электродуговая печь был открыт в 1892 г. Т. Л. Уилсон и независимо Х. Муассан в том же году.[9][10][11] В Босния и Герцеговина город Jajce Австрийский промышленник, доктор Йозеф Кранц и его «Bosnische-Elektrizitäts AG»
компания, преемником которой впоследствии стал
«Электро-Босна»
, в 1899 году открыл крупнейший в Европе химический завод по производству карбида кальция. Гидроэлектростанции электростанция на Плива для электроснабжения завода построена река установленной мощностью 8 МВт. Это была первая в своем роде электростанция в Юго-Восточной Европе, которая была введена в эксплуатацию 24 марта 1899 года.[12]
Меры предосторожности
CaC2— нестабильное соединение, которое склонно взрываться. Дело в том, что кальций может вступить даже в реакцию с воздухом, а в результате реакции образуются летучие газы. Малейшая искра способна вызвать моментальное возгорание с выделением огромного количества тепла и метана, что повлечет за собой печальные последствия. Поэтому транспортировать вещество необходимо в герметичных контейнерах.
Любителям лайвхаков и «острых экспериментов» с карбидом стоит позаботиться о собственной безопасности. При работе с веществом следует надеть специальные перчатки, если взять карбид голыми руками, то их будет невозможно помыть. Реакция с водой вызывает не только выброс метана и теплоты, поэтому ожог кожи будет обеспечен.
Карбид — забава детей 90-х
В 90-х годах еще не было всяких компьютерных гаджетов и интернета, детвора развлекалась, как могла. Кто из рогаток стрелял птиц, кто делал дымовые шашки. Но самым опасным были игры с карбидом. Вариантов было много: бросали в костер, он отлично горит мокрый, бросали в воду и наблюдали, как он пузыриться, делали бомбы из пластиковых бутылок.
Карбид достать было легко, газосварщики выбрасывали его прямо на месте проведения сварочных работ. Пацаны, улучив момент, набирали кто, сколько мог унести, и бежали подальше от этого места. Самым интересным занятием было взрывать пластиковые бутылки карбидом. В бутылку клали карбид, заливали водой, встряхивали и отходили подальше. Занимали наблюдательное место и ждали взрыва. Пары карбида раздували пластик, пока бутыль не разорвется. Он всегда происходил внезапно, что добавляло веселья. Был такой случай: ребята сидели, как обычно, взрывали пластиковые бутылки, а одна попалась очень крепкая и никак не хотела взрываться. Ее раздуло и все. Устав ждать взрыва, решили заняться чем-нибудь другим, например, бросать карбид в костер. Сидят, наблюдают за горением реактива, и вдруг кому-то пришло в голову бросить ту самую, так и не взорвавшеюся бутылку в костер. Ее взяли с собой и таскали почти весь день. Тут приходит осознание, что взрыв-то будет не слабым, а с огнем. Успели отбежать всего на пару шагов, как последовал оглушительный взрыв, ребята ощутили удар в спину взрывной волной, и попадали на землю. Все жители двора выбежали на улицу посмотреть что, взорвалось. К тому времени ребята на бешеной скорости умчались с места происшествия. Так быстро они еще не бегали. Кроме бомбы делали пушку из пивной банки. Брали пустую банку, срезали верхушку, а сбоку, ближе ко дну, проделывали небольшое отверстие. Внутрь помещали кусочек карбида и слегка его мочили. Затыкали отверстия и трясли немного. Потом открывали верхушку, а к маленькой дырке подносили горящую спичку, получался громкий выстрел скопившихся газов. Забавы были очень опасными, пострадавших было не мало. Получали сильные ожоги рук, лица. Шрамы оставались на всю жизнь. Это еще хорошо, если отделался шрамами, можно ведь было выжечь себе глаза и остаться слепым на всю жизнь. Такие случаи тоже были. Вот так развлекалась детвора лихих 90-х. Сегодняшняя молодежь далека от таких забав. С одной стороны хорошо, что не рискуют своим здоровьем.
Также может быть интересно: «Змейка Рубика» — головоломка 90-х
В сокращении выбросов CO2
Остатки, полученные от получения ацетилена из CaC2 (также называемый «осадок карбида кальция» или «остатки карбида кальция») используются для получения клинкера или бетона.
Грязь из карбида кальция имеет высокое содержание гидроксида кальция (Ca (OH)2) (около 90%), немного карбоната кальция (CaCO3) и имеет pH более 12.
По этим причинам он может реагировать с SiO.2 или Al2ИЛИ3 образуя продукт, аналогичный продукту, полученному в процессе гидратации цемента.
Один из видов деятельности человека, который производит больше выбросов CO2 это строительная отрасль. Сотрудничество2 он образуется на востоке, чтобы отделиться от карбоната кальция во время реакции с образованием бетона.
Использование осадка карбида кальция для замены карбоната кальция (CaCO3) было обнаружено, что снижает выбросы CO2 на 39%.
Меры безопасности и хранение
Calcium carbide относится к 1 классу опасности по степени воздействия на организм. Его пыль раздражающе действует на кожные покровы, слизистые оболочки и дыхательные пути. Реагент очень опасен при вдыхании (симптомы: прерывистое дыхание, кашель, насморк, чувство удушья, отек легких), попадании на кожные покровы (получение ожогов, язв) и в глаза (резь, слезотечение, отек век).
При применении материала необходимо использовать специальную защитную одежду, противогаз, перчатки и специальную обувь. Работать только в хорошо проветриваемых помещениях. В случае попадания на кожу промыть пораженное место большим количеством воды, смазать жирным кремом и вызвать врача.
Хранить в герметичных тарах в вертикальном положении (не более, чем в 3 ряда) в несгораемых, хорошо вентилируемых складах или на открытых площадках под навесом, защищающих от воздействия влаги. Не допускается совместное хранение с другими веществами. Срок годности – 6 месяцев с даты производства.
Прекращенное использование
ЦК2 он использовался в так называемых карбидных лампах. Их действие заключается в капании воды на карбид кальция с образованием ацетилена, который воспламеняется и, таким образом, дает свет.
Эти лампы использовались на угольных шахтах, но их использование было прекращено из-за наличия метана CH4 в тех шахтах. Этот газ легко воспламеняется, и пламя карбидной лампы может воспламениться или взорваться.
Они широко использовались в сланцевых, медных и оловянных рудниках, а также в ранних автомобилях, мотоциклах и велосипедах в качестве фар или фар.
В настоящее время их заменяют электрические лампы или даже светодиодные лампы. Однако они по-прежнему используются в таких странах, как Боливия, на серебряных рудниках Потоси.