Историческая справка
Медь является одним из самых важных элементов древности. Медь, золото, серебро и олово были первыми металлами, которые человечество узнало в своем историческом развитии. Поскольку медь легко обрабатывается, она использовалась древнейшими культурами более 10 000 лет назад. Время широкого использования меди пришлось с 5 тысячелетия до н.э. до 3-го тысячелетия до н.э.
Однако, в чистом виде медь оказалась относительно мягкой для производства оружия и инструментов. Поэтому древние люди путем экспериментов, добавляя в расплавленную медь кусочки свинца и олова, получили бронзу. Это гораздо более твердый материал, чем нелегированная медь. Бронза используется человечеством уже более 5000 лет. Этот сплав дал название целой исторической эпохе.
В алхимии медь ассоциировалась с Венерой (женственностью). Безусловно не в последнюю очередь потому, что первые зеркала, которыми пользовались женщины, были сделаны из этого металла.
Физические свойства
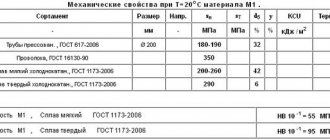
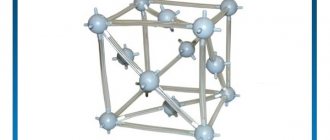
При плотности 8920 кг/куб.м медь является одним из тяжелых металлов с температурой плавления 1083,4 С. Она кристаллизуется в гранецентрированную кубическую систему (ГЦК) и имеет твердость по Моосу от 2,5 до 3. Медь очень хорошо проводит электричество. Немного хуже, чем серебро, и значительно лучше золота. Кроме того, медь является очень хорошим проводником тепла.
Однако алюминий является лучшим электрическим проводником на грамм вещества, чем медь. Но он более объемный, так что медь на квадратный сантиметр сечения кабеля проводит электричество лучше, по сравнению с аналогичным сечением провода из алюминия.
Чистая металлическая медь имеет ярко-красный цвет с розовым отливом. На воздухе медь приобретает красновато-коричневый оттенок. Из-за дальнейшего окисления и коррозии очень медленно (часто в течение столетий) на поверхности меди образуется патина. Металлический блеск теряется, а цвет меняется с красновато-коричневого на голубовато-зеленый.
Химическое строение и свойства
Если вы изучите электронную формулу атома меди, вы обнаружите, что он имеет 4 уровня. На валентной орбитали 4s находится только один электрон. В ходе химических реакций от одного атома могут отделяться от 1 до 3 отрицательно заряженных частиц, в результате получаются соединения меди со степенью окисления +3, +2, +1. Его двухвалентные производные наиболее стабильны.
В химических реакциях он действует как неактивный металл. В обычных условиях медь не растворяется в воде. В сухом воздухе коррозии не наблюдается, но при нагревании поверхность металла покрывается черным налетом двухвалентного оксида. Химическая стабильность меди проявляется под действием безводных газов, углерода, многочисленных органических соединений, фенольных смол и спиртов. Для него характерны реакции комплексообразования с выделением окрашенных соединений. Медь имеет мало общего с металлами щелочной группы, связанной с образованием производных одновалентного ряда.
Источники
- https://vseowode.ru/prosto-o-vode/rastvorimost-v-vode-medi.html
- [https://ollimpia.ru/v-kakih-zhidkostyah-mozhno-rastvorit-med/]
- [https://morflot.su/v-chem-mozhno-rastvorit-med/]
- [https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/himicheskie-svojstva-perehodnyh-metallov]
- [https://FB.ru/article/238897/rastvorimost-medi-v-vode-i-kislotah]
Месторождения меди
Медь иногда встречается в природе в чистом виде как твердый элемент. В основном в базальтовых лавах. Она находится там в виде самородка (затвердевшего расплава) или в разветвленных породных структурах, так называемых дендритах, очень редко в кристаллической форме. Доля чистой меди в природе очень низка.
Напротив, медные руды очень распространены. Медь добывается из следующих минералов: халькопирита (медный гравий — CuFeS2), халькоцита (медный глянец — Cu2S), реже из борнита (Cu5 FeS4), атакамита, малахита и других. Крупнейшие месторождения меди в мире находятся в Чили, США, России, Замбии, Канаде и Перу.
Основной страной-производителем меди является Чили, за ней следуют Индонезия и США. Основные страны-экспортеры объединены в содружество стран-производителей — CIPEC. К CIPEC принадлежат Чили, Перу, Австралия, Индонезия, Демократическая Республика Конго и Папуа-Новая Гвинея.
Растворение в аммиаке
Этот процесс часто происходит при пропускании NH3 в газообразной форме над чугунным металлом. Результат — растворение меди в аммиаке, выделение Cu3N. Это соединение называется одновалентным нитридом.
Его соли подвергаются действию раствора аммиака. Добавление этого реагента к хлориду меди приводит к выпадению осадка в виде гидроксида:
Избыток аммиака способствует образованию соединения сложного типа, имеющего темно-синий цвет:
Этот процесс используется для определения ионов двухвалентной меди.
Производство меди
Для производства меди из медного гравия (CuFeS2) первоначально получают так называемый медный камень (Cu2S с различным содержанием FeS) с содержанием меди около 70%. Для этого исходный материал нагревают с добавлением кокса и содержащихся в нем оксидов железа, зашлакованных кремнистыми заполнителями. Полученный шлак из силиката железа плавает в расплаве на поверхности и может быть легко слит. Далее медный камень перерабатывается в сырую медь (черная медь) с содержанием меди около 98%.
Для этого расплав заливают в конвертер и вдувают воздух. На первой стадии (продувка шлаком) содержащийся в нем сульфид железа обжаривается до оксида железа, и происходит связывание хлопьевидного кварца со шлаком, который можно слить. На втором этапе две трети оставшегося Cu2S окисляются до Cu2O. Затем оксид реагирует с оставшимся сульфидом с образованием неочищенной меди. Сырая медь (цементная медь) затем очищается электролитическим способом.
Медь мигрирует в виде ионов через электролит к катоду и осаждается там. Итоговое содержание меди — 99,99% с очень маленькой примесью других веществ. Менее благородные металлы этих примесей остаются растворенными в электролите, более благородные металлы (включая серебро и золото) образуют «осадок электролита» и далее обрабатываются отдельно.
Применение меди
Современный рынок предлагает широкий спектр потребительских товаров с содержанием меди: от посуды до компьютеров. Медь используется для производства монет, электрических проводов, ювелирных изделий, столовых приборов, фитингов, чайников, прецизионных деталей, произведений искусства, музыкальных инструментов, трубопроводов и многого другого.
Для электрических токопроводящих кабелей и линий, печатных плат и интегральных схем, электрических компонентов (обмотки трансформаторов, дроссели индуктивности, анодные тела магнетронов) используется только чистая медь из-за ее очень хорошей электропроводности. Для воздушных линий используется бериллиевая медь.
Медь обладает высокой отражательной способностью в инфракрасном диапазоне и поэтому используется в качестве зеркал для лазерных установок на углекислом газе. Из-за ее хорошей теплопроводности, медь часто используется в качестве тепловых радиаторов.
Медь является частью многих сплавов, таких как золотисто-желтая латунь (с цинком), бронза (с оловом) и никелированное серебро (с цинком и никелем). Кованые сплавы (латунь и никелированное серебро) приводятся в желаемую форму с помощью пластического формования (горячая штамповка: прокатка, ковка или холодная штамповка: волочение проволоки, ковка, холодная прокатка, глубокая вытяжка), в то время как литые материалы (оружейная сталь, бронза) обычно трудно или невозможно формовать пластическим способом.
Объекты с серебристо-белым (похожим на нержавеющую сталь) внешним видом часто на самом деле представляют собой сплавы с высоким содержанием меди, так как цвет меди полностью исчезает при добавлении никеля. Современные монеты изготовлены из сплава меди, цинка, алюминия и олова. Соединения меди используются в цветных пигментах, в качестве тонеров, в медицинских препаратах и гальванических покрытиях. Благодаря благородному внешнему виду медь незаменима в мебельной промышленности и в области декора.
Растворимость в ртути
При смешивании ртути с металлами других элементов получаются амальгамы. Этот процесс может происходить при комнатной температуре, поскольку в таких условиях Pb представляет собой жидкость. Растворимость меди в ртути проходит только при нагревании. Металл необходимо предварительно измельчить. Когда твердая медь смачивается жидкой ртутью, одно вещество проникает в другое или диффундирует. Значение растворимости выражается в процентах и составляет 7,4 * 10 -3. В результате реакции образуется прочная и простая амальгама, похожая на цемент. Если его немного подогреть, он станет мягким. В результате эту смесь используют для ремонта фарфоровых изделий. Также существуют сложные амальгамы с оптимальным содержанием металлов. Например, стоматологический сплав содержит элементы серебра, олова, меди и цинка. Их процентное число составляет 65: 27: 6: 2. Смесь с таким составом называется серебряной. Каждый компонент сплава выполняет определенную функцию, позволяющую получить качественное уплотнение.
Другой пример — сплав амальгамы, который имеет высокое содержание меди. Его еще называют медным сплавом. Амальгама содержит от 10 до 30% Cu. Высокое содержание меди предотвращает взаимодействие олова с ртутью, что предотвращает образование очень слабой и коррозионной фазы сплава. Кроме того, уменьшение количества серебра в начинке приводит к снижению затрат. Для приготовления амальгамы рекомендуется использовать инертную атмосферу или защитную жидкость, образующую пленку. Металлы, входящие в состав сплава, способны быстро окисляться воздухом. Процесс нагревания амальгамы меди в присутствии водорода приводит к удалению ртути, что позволяет отделить элементарную медь. Как видите, освоить эту тему несложно. Теперь вы знаете, как медь взаимодействует не только с водой, но также с кислотами и другими элементами.
Биологический эффект
Медь является компонентом голубого гемоцианина, который используется многими моллюсками и членистоногими в качестве красителя крови для транспортировки кислорода. Медь также является жизненно важным микроэлементом высших организмах и входит в состав многих ферментов.
Суточная потребность меди для взрослого человека составляет около 2 миллиграммов.
Депо меди в организме человека находится в печени. Избыток меди выводится через пищеварительную систему вместе с желчью. По сравнению со многими другими тяжелыми металлами переизбыток меди не наносит существенного вреда организму. Человек может съедать 0,04 грамма меди в день, не причиняя вреда своему здоровью. Медь в основном содержится в шоколаде, печени, злаках, овощах и орехах.
Дефицит меди редко диагностируется у людей. В основном он наблюдается при хронической диарее, у недоношенных детях, при длительном голодании. Потребление высоких доз цинка, железа или молибдена может привести к снижению количества меди в организме. В свободной (не связанной с белком) форме медь обладает выраженными антибактериальными свойствами. Такими же качествами обладает и чистое серебро.
Сульфат меди (медный купорос) является сильным рвотным средством и поэтому используется для лечения многих интоксикационных заболеваний на стадии острого реагирования.
Растворимость в кислоте серной
В нормальном состоянии такой реакции не происходит. Фактором, определяющим растворение меди в серной кислоте, является ее сильная концентрация. Разбавленная среда не может окислить металл. Растворение меди в концентрированной серной кислоте протекает с выделением сульфата.
Процесс выражается следующим уравнением:
Cu + H2SO4 + H2SO4 → CuSO4 + 2H2O + SO2.
Медь и вода
Средняя концентрация меди в морской воде составляет около 0,2–3 частей на миллиард, хотя значения могут сильно варьироваться. Речная вода обычно составляет 2-5 частей на миллиард. Водоросли содержит около 2-68 частей на миллион (сухое вещество), в то время как устрицы содержат около 63 частей на миллион. В растворенном состоянии элемент находится в форме CuOH + или в виде неионного CuCO3. Кроме того, медь имеет сильную тенденцию к образованию хелатов с использованием доступных органических веществ.
Как и в каких соединениях медь реагирует с водой?
Металлическая медь при нормальных условиях является коррозионно-стойким материалом.
Растворимость меди и / или ее соединений в воде
Элементарная металлическая медь нерастворима в воде, как и оксид меди, сульфат меди. С другой стороны, хлорид меди (I) имеет растворимость в воде 200 мг / л, а медный купорос до 220 г / л.
Как медь может попасть в воду?
Медь содержится в различных минералах, таких как халькопирит, малахит, азурит или куприт. Несмотря на возможное выветривание, его можно найти лишь в небольших количествах в природных водах. Соединения меди также используются в сельском хозяйстве и, таким образом, выбрасываются в окружающую среду. Некоторая часть меди и ее соединений может быть переработана. Однако они часто попадают на мусоросжигательные заводы, откуда, в свою очередь, в определенной степени могут попадать в окружающую среду.
Не следует недооценивать количество меди, которая растворяется при взаимодействии дождевой воды с кровельными материалами. В результате также часто увеличивается содержание меди в осадке сточных вод.
Растворимость меди в азотной кислоте
Такая реакция возможна из-за того, что металл окисляется сильным реагентом. Разбавленная и концентрированная азотная кислота проявляет окислительные свойства при растворении меди.
В первом варианте в ходе реакции получают нитрат меди и оксид двухвалентного азота в соотношении от 75% до 25%. Процесс разбавленной азотной кислоты можно описать следующим уравнением:
Во втором случае получают нитрат меди и оксиды азота, двухвалентные и четырехвалентные, соотношение которых составляет 1: 1. В этом процессе участвуют 1 моль металла и 3 моля концентрированной азотной кислоты. При растворении меди происходит сильный нагрев раствора, в результате чего наблюдается термическое разложение окислителя и выделение дополнительного объема оксидов азота:
Реакция используется в мелкосерийном производстве, связанном с переработкой отходов или удалением покрытия с отходов. Однако этот метод растворения меди имеет ряд недостатков, связанных с выделением большого количества оксидов азота. Для их захвата или нейтрализации требуется специальное оборудование. Эти процессы очень дороги.
Растворение меди считается полным, когда происходит полное прекращение образования летучих оксидов азота. Температура реакции составляет от 60 до 70 ° C. Следующим этапом является слив раствора из химического реактора. На дне есть небольшие кусочки металла, которые не прореагировали. К полученной жидкости добавляют воду и проводят фильтрацию.