Нахождение в природе
В природе углерод встречается как в чистом виде, так и в форме соединений. В свободном кристаллическом состоянии он находится в виде двух аллотропных видоизменений:
- Алмаз — чрезвычайно твердое вещество, плохо проводящее тепло и электричество. По внешнему виду — бесцветные кристаллы, сильно преломляющие свет. Если их соответствующим образом огранить — получатся бриллианты, их масса измеряется в каратах: 1 карат = 0,205 г. Самым крупным камням присваиваются имена: например, Куллинан (более 3 тыс. карат), Звезда Якутии (232 карата), и прочие. Тусклые алмазы (борт) используются в промышленности. При нагревании без доступа воздуха алмаз превращается в графит. В настоящее время из графита создаются искусственные алмазы (длительный нагрев при t=3000°С, и давлении 70−100 тыс. атмосфер). Синтетические продукты широко используются в технике.
- Графит — образует мощные залежи. По внешнему виду это серо-черная, жирная на ощупь масса. Имеет слоистую структуру. Хорошо проводит тепло и электричество, тугоплавкий. Используется в промышленности при производстве электродов и грифелей карандашей.
Есть еще одна модификация — аморфный углерод. Это пористое вещество черного цвета. Его «известные представители» — кокс, сажа, древесный и костяной уголь. В чистом виде не встречается, всегда содержит примеси.
В связанном состоянии углерод встречается в карбонатах (кальцит, известняк, мел, мрамор, железный шпат FeCO3, марганцевый шпат MnCO3, цинковый шпат ZnCO3, магнезит, доломит, малахит, и прочие). Кроме того, углерод — основная составная часть каменных и других углей, нефти, горючих природных газов, всех живых организмов.
Практическое применение карбидов
Как мы уже обсудили, ковалентные карбиды имеют самый большой диапазон практических применений. Это и абразивные и режущие материалы, и композиционные материалы, используемые в разных областях (например, в качестве одного из материалов, входящих в состав бронежилета), и автодетали, и электронные приборы, и нагревательные элементы, и ядерная энергетика. И это далеко не полный список применений этих сверхтвёрдых карбидов.
Самое узкое применение имеют солеобразующие карбиды. Их реакцию с водой используют как лабораторный способ получения углеводородов. То, как это происходит, мы уже разобрали выше.
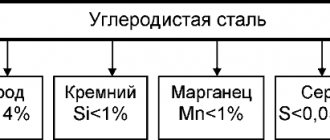
Наравне с ковалентными, металлоподобные карбиды имеют широчайшее применение в промышленности. Как мы уже говорили, таким металлоподобным видом обсуждаемых нами соединений являются стали, чугуны и прочие соединения металлов с вкраплениями углерода. Как правило, металл, находящийся в таких веществах, относится к классу d-металлов. Именно поэтому он склонен образовывать не ковалентные связи, а как бы внедряться в структуру металла.
На наш взгляд, практических применений у вышеперечисленных соединений более чем достаточно. Теперь взглянем на процесс их получения.
Основные свойства
Углерод инертен по отношению ко всем обычным растворителям. Исключение — некоторые расплавленные металлы. Однако после остывания он снова кристаллизуется в графит.
При нормальных условиях более химически активный только черный углерод. Он может соединяться со фтором, а при повышении температуры — с водородом, кремнием, серой, бором и некоторыми другими металлами. В результате реакции образуются карбиды:
- 4Al + 3C → Al4C3.
- Ca + 2C → CaC2.
При взаимодействии карбидов с водой или кислотой образуется метан или ацетилен:
- Al4C3 + 12HCl → 4AlCl3 + 3CH4 (метан).
- CaC2 + 2H2O → C2H2 (ацетилен) + Ca (OH)2 (гидроксид кальция).
Ряд карбидов имеет состав, который не подчиняется «общепринятому» представлению о валентности. К таким относится, например, Fe3C.
С азотом углерод не соединяется, но в присутствии водорода образует циановодород (формула вещества HCN). В реакциях с кислородом он образует монооксид и диоксид, при этом выделяется большое количество тепла:
- C + O2 → CO2.
- монооксид чаще всего выделяется при пропускании диоксида над раскаленным углем: CO2 + C → 2CO.
Углерод — один из наиболее сильных восстановителей, известных в химии. При взаимодействии с оксидами металлов он «отнимает» у них кислород, восстанавливая при этом вещества до свободного состояния:
- ZnO + C → Zn + CO.
- SiO2 +2C → Si + 2CO.
При взаимодействии избытка углерода с диоксидом кремния (кварцем, песком), кроме чистого Si, образуется карборунд (окись кремния) — очень твердое вещество: SiO2 + 3C → SiC + 2CO.
С галогенами «чистый» углерод не взаимодействует. Соединения с ними образуются из других веществ (например, углеводородов).
Применение
Элементы используют, чтобы придать чугуну и разного вида сталям твердость, повысить их износоустойчивость. Карбиды вольфрама и титана, как наиболее твердые и тугоплавкие варианты, применяют для изготовление режущих инструментов, а также для получения сверхтвердых материалов. Благодаря хорошим химическим и физическим свойствам, вещества используют в качестве компонента огнеупорных материалов, стержней сопротивления электронагревательных приборов и в качестве абразивного материала.
Карбид кальция также называют карбидом для сварки. Это идеальное вещество для сварочных работ: при контакте с водой оно выделяет ацетилен — летучий газ, являющийся основой кислородной сварки, металлизации, резки и напайки.
На свете известно очень много разных химических соединений: порядка сотни миллионов. И все они, как люди, индивидуальны. Нельзя найти два вещества, у которых совпадали бы химические и физические свойства при разном составе.
Одними из интереснейших неорганических веществ, существующих на белом свете, являются карбиды. В данной статье мы обсудим их строение, физические и химические свойства, применение и разберём тонкости их получения. Но для начала немного об истории открытия.
Углеродные соединения
В начале XIX века вещества были разделены на неорганические и органические. Ко второй группе относятся углеводороды (метановый, этиленовый и ацетиленовый ряды), белки, углеводы, жиры. Изучением этих веществ занимается органическая химия.
Неорганическая химия изучает другие соединения углерода: галогениды, цианиды, карбиды, оксиды. Наиболее значимыми являются кислородсодержащие вещества — CO, CO2. Есть еще C2O (окись диуглерода) и C3O2 (недооксид), но это пока не слишком изученные вещества.
Монооксид или угарный газ
Оксид углерода 2 (другое название монооксида) — образуется при неполном сгорании C, или продуктов, его содержащих. Его основные свойства:
- Сжижается при температуре — 192 °C.
- Затвердевает при t=-205°С.
- Молекулярная масса — 28,01 г/моль.
- Строение молекулы — линейное (в рамках теории валентных связей ее можно записать как «:C==O:»).
- В воде практически нерастворим.
Монооксид — ядовитый газ, не имеющий цвета и запаха. Его отравляющее действие состоит в том, что он необратимо взаимодействует с гемоглобином крови, в результате чего полностью утрачивается способность переносить кислород от легких к тканям.
В промышленности монооксид получают в процессе газификации твердого топлива. В лаборатории синтезировать соединение можно путем воздействия концентрированной серной кислоты на щавелевую (C2H2O4) или муравьиную (HCOOH). Реакция протекает при нагревании:
- HCOOH → CO + H2O.
- C2H2O4 → CO + CO2 + H2O.
По химическим свойствам двухвалентный оксид — хороший восстановитель. Он отлично горит, выделяя при этом большое количество тепла: 2CO + O2 → 2CO2. Другие характерные признаки:
- Способность «изымать» кислород из его соединений с металлами: FeO + CO → Fe + CO2.
- В присутствии активированного угля, выступающего в роли катализатора, окись углерода со степенью окисления +2, способна присоединять хлор (Cl), образуя при этом фосген (COCL2) — боевое отравляющее вещество. Представляет собой бесцветный, высокотоксичный газ с запахом прелого сена. Уравнение реакции получения: CO + Cl2 → COCl2.
- При высоких температурах (выше 400°C) и повышенном давлении (300 атм) реагирует с водородом. В результате процесса образуется метиловый спирт (метанол): CO + 2H2 → CH3OH.
- При повышенных температурах взаимодействует со щелочами, образуя при этом соли муравьиной кислоты (HCOOH): CO + NaOH → HCOONa.
- При взаимодействии с аммиаком образуется синильная кислота — очень ядовитое вещество: CO + NH3 → HCN + H2O.
Угарный газ находит широкое практическое применение. Он входит в состав искусственного газообразного топлива. Кроме того, незаменим при процессах органического синтеза.
Диоксид углерода или CO2
Это газ, не имеющий цвета, обладающий слабым кисловатым запахом и вкусом. Молярная масса равна 44.01 г/моль.
Примечание: оксид углерода 4 в полтора раза тяжелее воздуха, поэтому его можно «переливать» из пробирки в пробирку.
Углекислый газ (еще одно название диоксида углерода) не поддерживает горения. Кроме того, он делает невозможным дыхание: в комнате, где концентрация вещества будет высокой, человек задохнется. Какие свойства присущи соединению:
- В углекислом газе могут гореть некоторые вещества, образующие с кислородом более прочную связь, нежели углерод (например, магний): 2Mg + CO2 → 2MgO + C.
- Реакция горения с раскаленным углем: CO2 + C → 2CO.
- Взаимодействие с водой: CO2 + H2O → H2CO3 (угольная кислота).
- Образует кислотные оксиды при взаимодействии с основными оксидами: Na2O + CO2 → Na2CO3 (карбонат натрия).
- При недостатке щелочи образует гидрокарбонаты: CO2 + NaOH → NaHCO3.
В промышленности диоксид углерода синтезируют путем термического разложения известняка или мела (иногда доломита, магнезита): CaCO3 → CaO + CO2. Также это вещество можно выделить из коксового газа, при сжигании угля, торфа, нефтепродуктов, древесины. Кроме того, он содержится и в природных источниках: например, «появляется» в результате вулканической деятельности, при распаде органических веществ.
В лабораторных условиях его получают при взаимодействии CaCO3 и соляной кислоты: CaCO3 + 2HCl → CaCL2 + CO2 + H2O (реакция проводится в аппарате Киппа). Другой способ — прокаливание гидрокарбоната натрия: NaHCO3 → Na2CO3 + CO2 + H2O.
Углекислый газ имеет промышленное значение: он необходим в содовом производстве, в пищевой промышленности (изготовление газированных напитков), для синтеза органических кислот. Сухой лед (твердый диоксид) используется в качестве хладагента — углекислая среда предотвращает продукты питания от разложения. Кроме того, CO2 применяется и в медицине (углекислотные ванны для активизации метаболических функций). Незаменим он и для сельского хозяйства — оксид углерода IV участвует в фотосинтезе, поэтому его недостаток негативно сказывается на растениях.
Какие бывают карбиды?
Оказывается, карбид, формула которого, скажем, CaC 2, существенно отличается по строению от SiC. И отличие это прежде всего в характере связи между атомами. В первом случае мы имеем дело с солеобразным карбидом. Назван этот класс соединений так потому, что ведёт себя фактически как соль, то есть способен диссоциировать на ионы. Такая ионная связь очень слабая, что и позволяет легко проводить и многие другие превращения, включающие взаимодействия между ионами.
Другим, наверное, более промышленно важным видом карбидов являются ковалентные карбиды: такие как, например, SiC или WC. Они отличаются высокой плотностью и прочностью. А также тугоплавки и инертны к разбавленным химическим веществам.
Существуют также металлоподобные карбиды. Их скорее можно рассматривать как сплавы металлов с углеродом. Среди таких можно выделить, например, цементит (карбид железа, формула которого бывает разной, но в среднем она примерно такая: Fe 3 C) или чугун. Они имеют химическую активность, промежуточную по своей степени между ионными и ковалентными карбидами.
Каждый из этих подвидов обсуждаемого нами класса химических соединений имеет своё практическое применение. О том, как и где применяется каждый из них, мы поговорим в следующем разделе.