Человечество научилось использовать газообразные вещества для поддержания искусственных процессов и реакций, в результате которых удаётся получить другие химические соединения. Кроме этого, различные газы используются для получения определённых физических явлений и свойств. Углекислый газ или СО2 обладает большим количеством качеств, которые не могут не использоваться в химической промышленности и быту.
Что такое диоксид углерода
Диоксид углерода также известен, как Е290 (в международной регистрации пищевых добавок). В большой концентрации обладает кисловатым привкусом и запахом, плотность 1,977 г/л. Применяется в качестве регулятора кислотности, антиоксиданта, консерванта. Представляет собой нетоксичный (в допустимых дозах), инертный, негорючий, тяжелый бесцветный газ, также именуемый, как углекислый, двуокись/оксид углерода, угольный ангидрид (СО₂).
Строение молекулы углекислого газа:
Молекула углекислого газа
Физические свойства
Углекислый газ существует в жидком, газообразном и твёрдом состоянии, в виде белого «сухого льда». Особенность – стремительный переход из кристаллизованного состояния в газообразное, минуя стадию жидкости. Цвет и запах ощутим только в условиях высокой концентрации СО₂. Газ двуокись углерода тяжелее воздуха, устойчива к термическому воздействию, поэтому в привычных атмосферных условиях испаряется, а не плавится. Сублимируется при 78°С. В жидкости не растворяется, частично контактирует с ней.
Формула и свойства
Традиционная формула углекислого газа: CO2, масса: 44 г/моль.
Инертную окись относят к оксидным кислотам.
- контактируя с Н₂О, образует нестабильную, мгновенно распадающуюся взаимообратимую кислоту: СО₂ + H₂O ↔ CO₂ × H₂O (растворение) ↔ Н₂СО₃;
- реакция между известковой жидкостью и углекислым газом образовывает карбонат кальция (белесый осадок на дне жидкости): CO₂ + Ca(OH)2 = CaCO₃↓ + H₂O;
- термальное воздействие разлагает диоксид на кислород и диоксид углерода: 2CO₂ = 2CO + O₂;
- газ СО₂, реагирующий с металлическими активными пероксидами, разлагается на кислород и карбонаты: 2CO₂ + 2Na₂O₂ = 2Na₂CO₃ + O₂↑.
- CaO + CO₂ = CaCO₃;
- Al₂O₃ + 3CO₂ = Al₂(CO₃)3;
- CO₂ + NaOH = NaHCO₃;
- CO₂ + 2NaOH = Na₂CO₃ + H₂O;
- CO2 + 4H2 = CH4 + 2H2O (t°, kat = Cu2O);
- CO2 + 2Mg = C + 2MgO (t°);
Следовательно, углекислый газ обладает 4 важнейшими свойствами:
- Реагирует с основаниями и основными оксидами, образуя угольно-кислотные соли.
- При воздействии высоких температур, восстановителей проявляется окислительная способность. Возобновить газообразную форму можно углем.
- Горящий в воздухе магний продолжает гореть в атмосфере углекислого газа.
- Качественная реакция, обусловленная появлением в известковой воде белого осадка, исчезающего при длительном пропускании диоксида через известняковую жидкость. В результате карбонат кальция, лишенный способности к растворению превращается в растворимый гидрокарбонат.
Свойства позволяют диоксиду углерода обладать несколькими формами. Например: при традиционном давлении атмосферы элемент существует в форме газа. Охлаждение океанскими глубинами трансформирует СО₂ в жидкое состояние, а заморозка – кристаллизует, формируя лёд. Резкое нагревание стимулирует испарение и восстановление газообразной формы.
Углекислый газ в атмосфере и природе
В окружающей среде газ СО₂ образуется несколькими источниками: природой, человеком, животными:
- люди и животные вдыхают кислород для жизнедеятельности, а в результате переработки легочной системой выводится оксид углерода. То же касается растений. При фотосинтезе поглощают О₂ и выводят СО2, поэтому не стоит размещать много цветов в непроветриваемой комнате;
Важно! В сутки человеческий организм выделяет в атмосферу 0,03% углерода = 1 кг СО2
- углерод является составляющей вулканических газов, поэтому, в местностях с повышенной вулканической активностью диоксид углерода может попадать из недр на поверхность земли через трещины, почвенные разломы и пр. В некоторых случаях, концентрация СО2 настолько высока, что провоцирует отравление и гибель мелких животных;
- гниение, горение и разложение органики. Углекислый газ хранится в недрах земли, в виде торфа, угля, нефти, известняка, а также выделяется при горении древесины.
Формирование газа диоксида углерода в недрах земли и выведение СО2 в атмосферу живыми существами взаимосвязано. Первоначально органические вещества (выделяемые животными, известняки) минерализуются, превращаясь в ископаемые, хранящиеся в недрах земли веками. Затем уголь, нефть, торф используются перерабатывающими станциями и выделяют в атмосферу СО2.
Также люди, животные, растения, поглощая кислород, выводят в воздух газообразный диоксид углерода, растворяющийся в морях и океанах, превращающийся в известняк.
Считается, что избыток углекислого газа – это причина климатических изменений в мире, ведь она провоцирует парниковый эффект. Следовательно, солнечное излучение беспрепятственно попадает на поверхность почвы и задерживается в атмосфере. Возникает тепловой эффект, плавящий ледники, повышающий уровень моря.
Последствия климатических изменений и повышенного количества СО2:
- эволюция растений, животных;
- глобальное повышение температуры;
- природные катастрофы, пожары.
Больше всех пострадает человечество: уменьшится территория для жизнедеятельности, которая станет менее комфортной. Способ спастись – снизить выбросы диоксида углерода, путём минимизации выработки углекислоты на производстве и переходом на экологический транспорт.
Получение углекислоты
Кроме получения газа СО₂ природными способами, его также добывают лабораторно и в промышленности для применения в пищевой, медицинской и др. индустриях.
Лабораторные способы
Лаборатории изготавливают небольшие партии углекислого газа, путём вытеснения воздуха при взаимодействии соли, мрамора, мела с соляной кислотой:
CaCO₃ + 2HCl → CaCl₂+ H₂O + CO₂, NaHCO₃+ HCl → NaCl + H₂O + CO₂
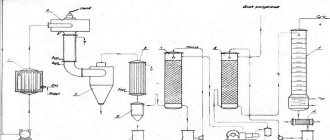
Промышленное производство
Диоксид углерода получают при отделении азота, кислорода, аргона при обжиге промышленных отходов (дыма). Это наивыгодный способ добычи газа углекислоты. Моноэтаноламин адсорбируют, путем подачи в дымовую трубу. Частицы впитывают углекислый газ и подаются в специальные резервуары, где при определённом давлении и температурных показателях высвобождаются (из моноэтаноламина). Так получают диоксид углерода в газообразной форме.
Получение углеродного оксида в жидком состоянии выполняют, путём брожения сырья (при изготовлении алкоголя). Тогда полученные газы обрабатывают углем, перманганатом калия и водородом.
Добыча углерода в сухой форме производится на ликеро-водочных заводах, пивоварнях. Сложный и продолжительный процесс, выполняющийся в несколько этапов:
- Выделенный газ (в результате брожения сырья) направляется на промывку.
- После чистки проникает в устройство, где подвергается высокому давлению.
- Подаётся в холодильники, охлаждается до жидкого состояния.
- Повторно очищается углем.
- Направляется в холодильники для обретения твёрдой формы.
Полученный высококачественный диоксид углерода направляется на предприятия для дальнейшего применения, в качестве охладителя, в виде белоснежного «сухого льда».
Сварка в среде защитных газов
Сварка в среде защитных газов сегодня применяется практически для всех металлов, включая углеродистую и нержавеющую стали, алюминий, медь и титан. Теплотой дуги расплавляется основной металл и проволока или присадочный пруток, если сварку выполняют неплавящимся электродом. Расплавленный металл сварочной ванны, кристаллизуясь, образует шов. При сварке в зону дуги непрерывно подаётся защитный газ. В качестве защитных газов применяют углекислый газ (CO2) и инертные газы, такие как аргон (Ar), гелий (He) и их смеси: Ar+He, Ar+CO2, Ar+O2, CO2+O2, Ar+H2 и др.
Изначально наибольшее распространение получила сварка в среде CO2. Такой способ является самым дешёвым при сварке углеродистых и низколегированных сталей.
Дальнейшим этапом повышения эффективности сварки при изготовлении сварных металлоконструкций стало применение газовых смесей на основе углекислого газа (CO2) и аргона (Ar). Предлагаемые технологии сварки в смесях с использованием CO2 и аргона позволяют значительно улучшить, в сравнении со сваркой в CO2, технологические параметры процесса сварки.
Сварочные смеси на основе углекислого газа являются наиболее распространёнными среди смесей, применяемых для сварки углеродистых конструкционных сталей.
Химические реакции с диоксидом углерода, соединения
Сам по себе углерод не горюч, не активен, но реагирует с другими веществами, позволяя получить новые вещества, используемые практически во всех сферах промышленности.
- Реакция между аммиаком и углекислым газом приводит к разложению элементов до гидрокарбоната аммония: 2NH₃ + CO₂ + H₂O = NH₄HCO₃ Гидрокарбонатная соль, широко используется хлебопекарнями.
- При взаимодействии аммиака и углекислоты под температурой свыше 130°С и давлением 200 атомов производят мочевину: 2NH₃ + СО₂ → (NH₂)2СО + H₂O
- Оксид цинка получают, путём комбинации цинка и диоксида углерода под воздействием температуры 800°С.
- Газ CO₂ соединяют с гидроксидом бария для получения оксида водорода с карбонатом бария: Ba(OH)2+CO₂ = BaCO₃ + H₂O Получается средняя соль, используемая для изготовления синтетики, кухонной плитки, фейерверков, красных кирпичей и пр.
- Поскольку углекислый газ не горюч, поддерживать горение он может только в соединении с магнием: 2Mg + CO₂ = C + 2MgO Полученный оксид магния применяют в косметологии и, в качестве активной пищевой добавки.
- Углекислый газ реагирует с карбонатами и бикарбонатами, образуя гидрокарбонаты: CO₂ + NaOH → NaHCO₃. Большее количество натрия образует карбонат натрия и воду: CO₂ + 2NaOH → Na₂CO₃ + H₂O
- Комбинация углекислого газа и щёлочи служит для затвердевания известняка: Ca(OH)2 + CO₂ → CaCO₃ + Н₂O
- При взаимодействии углекислоты и воды формируется глюкоза, позволяющая растениям питаться (принимающая участие в фотосинтезе): 6CO₂ + 6H₂O → C₆H₁₂O₆ + 6O₂
- Соду получают, в результате соединения аммиака, углекислоты и натрия хлорида: NaCl + CO₂ + NH₃ + H₂O → NaHCO₃ + NH₄Cl
- Контактирующий с углеродом фенолят натрия разлагается, образуя осадок из плохо растворимого фенола.
Благородные газы: ксенон, аргон, гелий и пр. не вступают в реакцию с двуокисью углерода, из-за несовместимого молекулярного строения этих газов.
Применение углерода
Пищевая добавка Е290 (углекислый газ) разрешается для использования в пищевой индустрии, в качестве консерванта, регулятора кислотности, антиоксиданта, газификации напитков (алкогольных и безалкогольных). Также, растворенные частицы углекислоты в воде, оказывают обеззараживающее и антибактериальное действие.
Пищевая промышленность
В хлебобулочном производстве пищевая добавка Е290 является разрыхлителем, придающим изделиям пышность и объём. В виноделии угольная кислота – регулятор брожения.
Углекислый газ в кристаллизованной форме применяют для транспортировки и хранения пищевых продуктов.
Пищевая добавка Е290 в оптимальных количествах не воздействует негативно на организм, поэтому может применяться для изготовления пищевых продуктов.
Химическая промышленность
Химическая отрасль использует СО₂ для регуляции температуры реактора, изготовления синтетических, химических веществ, нейтрализации щёлочи сточных вод и увеличения их проводимости, сушки\очистки полимеров растительного, животного происхождения.
Медицина, косметология
В лечебных целях углекислый газ применяют для стимуляции углублённого дыхания, криоабляции злокачественных опухолей.
В дерматокосметологии диоксид углерода вводят подкожно для расщепления липидов. Попадая в дерму изотонический раствор, вступает в реакцию с углекислотой, распадается на гидрокарбонаты и ионы водорода, приводя к сжиганию жиров. Остатки СО₂ вызывают нехватку кислорода, стимулируя улучшение кровотока и обмена веществ.
Металлургия
Металлургия применяет углекислоту для защиты окружающей среды от вредных выбросов в атмосферу:
- осаждение дыма и минимизация азота при вскрытии промышленных печей, донном перемешивании;
- для осаждения дыма при транспортировке слитков, штейна цветных металлов;
- при отводе шахтных кислотных вод для рециркуляции жидкости.
Металлургическая отрасль использует лазеры для резки металлов, устройства заправляют жидким углекислым газом. Так, диоксид углерода выступает ещё и топливом для металлургического оборудования.
Лабораторные исследования
Подвижный диоксид углерода (стадия между жидкой и газообразной) применяется для экстрагирования и хроматографического анализа.
Полиграфия
Углекислый газ применяют для регуляции pH переработанного сырья, отбеливания древесины, целлюлозы для качественного изготовления тетрадей и белоснежных листов. А также для улучшения производительности оборудования, нейтрализации талового масла.
Электроника
Диоксид углерода в электронике применяется при испытательных проверках воздействия электронного оборудования на окружающую среду. Также для увеличения проводимости, обработки сточных вод, устранения фототвердеющих частиц из кристаллических пластин, чтобы избежать применения растворителей органического типа.
Охрана окружающей среды
Углекислый газ используется в качестве альтернативы серной кислоты для поддержания pH в сточных водах.
Металлургия
Применение углекислоты в производстве металлоизделий актуально, когда сваривают металлы. Газовое облако защищает расплавленную область от поступления активного кислорода. Оно обеспечивает ровность сварного шва, защиту от окисления. В металлургии CO2 используют также для:
- регулировки водоотвода внутри шахт;
- получения лазерного луча, для резки металла;
- отвода вредных веществ-газов в форме осадков.
Влияние на человеческий организм
Углекислый газ – это конечный продукт метаболизма, возникающий при глюкозно-жировом расщеплении. Гемоглобин переносит его к лёгким, откуда выводится в воздух. Скопление в организме приводит к расширению капилляр, увеличению кровотока, переизбытку кислорода.
Польза углекислого газа
Именно диоксид углерода возбуждает дыхательную систему, поэтому очередной вдох регулируется количеством углекислоты. При вдохе происходит обмен – поступление кислорода и выделение углекислого газа.
Примечание! Кислород при помощи гемоглобина транспортируется по клеткам, а отходы (в виде газа СО₂) переносятся им же в дыхательную систему для выведения.
Процессы, в которых участвует газ СО₂:
- поддержка обмена веществ;
- возбудимость нервной системы;
- регуляция сосудисто-двигательного центра, дыхания;
- электролитный состав крови;
- активность гормонов и ферментов.
Углекислый газ помогает кислороду высвобождаться и проникать в клетки организма. Недостаток СО₂ влечет затрудненное дыхание, ощущение нехватки кислорода, вялость, плохое самочувствие, сбой работе всего организма.
Вред
Организм нуждается в углекислоте наравне с кислородом, но его нехватка или переизбыток влечёт серьёзные проблемы, такие как:
- Гипокапния. Первые проявления тошнота: кружение головы. При отсутствии лечения – обмороки. Характеризуется недостатком углекислоты в организме, из–за чего он не способен высвободить кислородные молекулы и снабдить нужным количеством полезных веществ.
- Гиперкапния. Уровень углекислоты в организме превышает 1000 ppm, провоцирует отравление. Первые симптомы: тошнота: потеря работоспособности, затрудненное дыхание, боль в голове. Отсутствие лечения приводит к недостатку кислорода, обморокам.
В норме газы О₂ и СО₂ крепятся по разные стороны гемоглобина и двигаются по телу, насыщая нужными веществами и забирая отработанные. Переизбыток СО₂ нарушает способность красных кровяных телец прикреплять кислород, из–за чего питательные вещества перестают насыщать клетки.
Повышенная концентрация газа СО₂ встречается в шахтах и в быту, особенно в осенне–весенний период, когда помещения проветриваются реже.
Считается, что напитки, содержащие в составе углекислый газ, вымывают кальций и нарушают обмен веществ, поэтому противопоказаны людям с заболеваниями желудочно-кишечного тракта (язва, гастрит и пр.)
Почему они важны?
О важности воздуха уже говорилось выше. Но любой образованный человек и так прекрасно знает, что без него ничто живое на планете Земля не смогло бы выжить в принципе.
А вот что можно сказать про углекислый газ? Парадоксально, но если он внезапно исчезнет с Земли, то и человечество вымрет удивительно быстро. Дело даже не в том, что углекислый газ активно применяется в различных сферах промышленности. Просто он необходим растениям.
Как говорилось выше, любые живые организмы дышат кислородом. И растения – не исключение. Однако им также необходим углекислый газ. Ведь на свету в зеленых клетках активно идет процесс фотосинтеза. Он заключается в расщеплении клеток CO2 на углерод и кислород. Последний выделяется в атмосферу (или в воду, если речь идет о зеленых водорослях, в которых также идет фотосинтез), а углерод используется для построения новых клеток и роста растений. Если весь углекислый газ исчезнет, то и процесс фотосинтеза замрет. А значит, растения перестанут расти, животные и люди останутся без еды, что очень быстро приведет к голоду и вымиранию всего человечества.
Класс опасности и токсичности
Углекислый газ – это невзрывоопасное, негорючее, не поддерживающее горение вещество. В газообразной форме в 1,5 раза тяжелее воздуха, поэтому скапливается в шахтах, тоннелях, ямах, внутри подземного оборудования.
При контакте кожного покрова с углекислотой возможно покалывание пораженного участка, краснота, ощущение теплоты, вплоть до обморожения. Медленное согревание холодной водой приводит к прогрессированию болезни внешним источником холода.
Горячая вода может вызвать ожог пораженной области, в связи с частичной\полной потери температурной чувствительности дермы. Немедленно обратитесь к врачу!
Резервуары с газом СО₂ могут взрываться при воздействии высоких температур, ударах и сублимации сжиженной кислоты, разгерметизации баллона.
Где используется разница массы?
Зная, что тяжелее – воздух или углекислый газ, можно предположить, что последний всегда стремится вниз. И это можно использовать на практике. Например, применяется данный эффект водолазами при погружении с колпаком. Запас воздуха здесь ограничен, и, если бы углекислый газ смешивался с ним равномерно, дыхание было бы затруднено. Но его избыток преимущественно выделяется и опускается ниже, позволяя человеку легко дышать.
Применяется этот эффект и при пожаротушении. Углекислым газом заправляют специальные огнетушители – углекислотные. Когда сжиженный газ вырывается из раструба, он тут же расширяется примерно в 400-500 раз, заодно охлаждаясь на 72 градуса. Уже этого достаточно, чтобы многие горящие предметы потухли. Но тяжелый газ расползается по полу и горящим предметам, вытесняя воздух. Так как СО2 не поддерживает горение, то пламя, оставшись без подпитки кислородом, просто гаснет.
Хранение и транспортировка углекислого газа
Баллоны высокого давления с углекислым газом хранят в специализированных складских помещениях и огражденных площадках, оснащенных навесом, препятствующим контакту резервуаров с солнечными лучами и осадками. Хранить, не более 1 года со дня изготовления.
Низкотемпературный диоксид углерода с жидким веществом хранят в изотермических цистернах. Срок хранения 6 месяцев с момента изготовления.
Углекислый газ в баллонах
Транспортировка углекислого газа относится ко 2-му классу опасности. Требуется строгое соблюдение правил безопасности: не бросать, не бить! Во избежание повреждения баллона, утечки газа и, как следствие взрыва!
Где купить, сколько стоит диоксида углерода
Приобрести углекислый газ в промышленных целях, можно:
- в офисе завода изготовителя;
- у дистрибьютера
- через интернет.
Покупая у завода или дистрибьютора, вы оформите заказ на нужное количество сжиженного углекислого газа. Доставку организует отправитель, соблюдая технику безопасности. Стоимость договорная. Оговаривается непосредственно при формировании заказа, отталкиваясь от формы вещества (жидкая\«сухой лёд») и величины заказа.
Углекислый газ не оказывает негативного воздействия на организм, если употреблять в разумном количестве. Соединяется со многими элементами, помогая создать новые вещества, используемые в быту и промышленности.