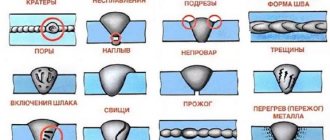
Химическая стойкость алюминия и его сплавов.
Стандартный электродный потенциал алюминия равен -1,66В, т.е. он является достаточно активным металлом. Однако, благодаря склонности к пассивированию, алюминий может быть стоек во многих средах.
В обычном состоянии поверхность алюминия покрыта слоем оксида толщиной от 5 до 100 нанометров. Пленка прочно сцеплена с металлом и покрывает его сплошным слоем. Пленка на алюминии образуется при рН=3-9. Коррозионная стойкость алюминия выше у максимально чистого алюминия (АВ1 и АВ2) с содержанием алюминия 99,9-99,85% соответственно, ниже — у технически чистого А00 и А0 с содержанием алюминия 99,7-99,6 соответственно. Дюралюминий (дюраль, 2-7% меди) имеет низкую коррозионную стойкость. Литейные сплавы силумины (0,8-13% кремния) хорошо держатся в окислительных средах.
Алюминий стоек:
- В атмосферных условиях;
- В средах, содержащих H2S, SO2, NH3;
- В воде при нагревании;
- В растворах солей, обладающих окислительными свойствами — хромовокислых, азотнокислых;
- В концентрированных растворах азотной и серной кислот (обладают окислительными свойствами);
- В разбавленной серной кислоте при 20о С;
- В олеуме до 200о С;
- В фосфорной кислоте при комнатной температуре;
- В уксусной кислоте с концентрацией 1-99%масс при температуре до 65о С;
- В кипящей уксусной кислоте только при концентрациях 98-98,8%масс;
- В формальдегиде;
- В сухом хлористом водороде.
Алюминий нестоек:
- В нейтральных растворах солей, содержащих галогениды — фториды, хлориды, бромиды, йодиды;
- В серной кислоте средней концентрации;
- В кипящая уксусная кислота до 98%масс и выше 98,8%масс;
- В капельножидкой и парообразной ртути (коррозия алюминия в уксусной кислоте начинается при присутствии ртути 0,000004% масс;
- В щелочах (с водородной деполяризацией);
- В плавиковой кислоте;
- При контакте с медью, железом и их сплавами.
Устойчивость покрытий к коррозии под воздействием перемены температур и повышенной влажности
Для оценки параметра с данными условиями используются методы 12-14
Метод 12
Для оценки устойчивости к коррозии данным способом проводят не менее 15 циклов.
В начале каждого цикла образцы выдерживают в камере влаги в течение 6 часов при температуре 40 градусов и влажности 97 процентов. После отключения обогрева их держат еще 2 часа. Далее в камере холода изделия испытываются на протяжении 3 часов температуре 42-48оС. После этого образцы в течение 7 часов подвергают высоким температурам в термокамерах (при 60 градусах). В завершение цикла их держат при 15-30 градусах в течение 6 часов (влажность до 80%). По окончании последнего цикла производится оценка.
Метод 13
Для проведения тестирований по тринадцатому методу, испытываемые объекты сначала ставят в камеру влаги на 2 часа. В ней заранее устанавливают 40 градусов Цельсия и влажность 97%. После выключения обогрева их выдерживают еще столько же.
Следующая камера – камера с низкими температурами (-30оС). В ней испытываемый объект находится в течение 6 часов. После этого изделия подвергают повышенным температурам, а именно 60 градусов, в камере тепла. Продолжительность воздействия составляет 5 часов. После этого объекты перемешают обратно в камеру холода (-60) и выдерживают еще 3 часа.
В завершение, изделие 6 часов находится в обычных условиях (15-30 градусов, 80% влажность воздуха).
Все эти процедуры составляют один цикл. Для объективной оценки параметра проводят 15 или более циклов.
Метод 14
Количество циклов для 14 метода зависит от условий Т3 и Т2, но в любом случае их количество более 10.
Испытываемое изделие держат сначала 10 часов в камере влаги при 55 градусах С (97% влажность), затем еще 2 часа с отключенным обогревом. После помещают в термокамеру (60оС) на 10 часов. После достают и держат 2 часа при 15-30оС (80% влажность воздуха).
После проводят оценку по полученным данным.
Химическая стойкость меди и ее сплавов.
Стандартный потенциал меди равен +0,52/0,337В для восстановления одновалентной и двухвалентной меди соответственно. Обычно при коррозии медь переходит в раствор именно в двухвалентной форме. Стандартный потенциал меди в растворе 3% хлорида натрия равен +0,05В, а в растворе 1Н соляной кислоты равен +0,15В. Поэтому медь при обычных условиях не вытесняет водород из растворов, т.е. не может корродировать с водородной деполяризацией. Способность к пассивированию у меди выражена слабо. Устойчивость к газовой коррозии меди повышается при легировании бериллием, магнием и алюминием.
Латунь — сплав меди и цинка. Введение в латунь алюминия, марганца, никеля повышает устойчивость сплава к атмосферной коррозии, кремния — к морской воде.
Медь устойчива:
- В солевых растворах;
- В разбавленных неокислительных кислотах;
- В формалине.
Медь неустойчива:
- В растворах, где она может образовывать комплексы (цианиды, аммиак);
- В растворах окислителей — азотная кислота, перекись водорода;
- В присутствии растворенного кислорода (особенно при продувке его через раствор);
- В хромовой кислоте;
- В муравьиной кислоте;
- В сульфидах, полисульфидах, сернистом газе.
Метод 9
Метод 9 используется для оценки устойчивости к коррозии под воздействием повышенной температуры, влажности, соляного тумана и солнечного излучения. Для оценки образцы подвергают различным климатическим условиям, повторяя их в течение 20 или более циклов.
Каждый цикл начинается с камеры влаги, с установленными в пределах 53-57оЦельсия и влажностью 97 процентов. После выдерживания на протяжении 5 часов, объекты перемещают в камеру соляного тумана, где выдерживают 3 часа. После этого объекты возвращают в камеру влаги, где подвергают тем же условиям, то же количество времени. В световой камере с реж. 4-16 их держат 10 часов. После чего 1 час хранят на воздухе при не менее 15о, и не более 30оС (влажность до 80 процентов).
Оценку осуществляют по окончании последнего цикла основываясь на п. 6.12.6-10 ГОСТ 9. 401-2018.
Химическая стойкость никеля и его сплавов.
Стандартный потенциал никеля равен -0,25В. Коррозия никеля в основном протекает с килородной деполяризацией.
Никель устойчив:
- В неокисляющих разбавленных кислотах (соляная до 15%, серная кислота до 70%);
- В ряде органических кислот, спиртах;
- В любых щелочах при любых температурах.
Никель неустойчив:
- В присутствии хлорида железа (III), хлорида меди (II), хлорида ртути (II), нитрата серебра, NaClO;
- В окисляющих кислотах (например, азотная);
- В концентрированных неокисляющих кислотах.
Химическая стойкость олова и его сплава с висмутом.
Стандартный потенциал олова равен -0,136В. Чистое олово компактно при температуре выше +13о С (в форме белого олова). Ниже этой температуры, особенно при -48о С олово активно переходит в аллотропную модификацию «серое олово», имеющую порошкообразную структуру. Для исключения этого явления олово легируют, например небольшим количеством висмута (0,5-2%). Олово слабо пассивируется.
Олово устойчиво:
- В природных водах;
- В растворах нейтральных солей;
- В пищевых средах;
- В разбавленных растворах серной и соляной кислот;
- В органических кислотах.
Определение коррозии
Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией.
Коррозия металлов вызывается окислительно-восстановительными реакциями, в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
Можно выделить 3 признака, характеризующих коррозию:
- Коррозия – это с химической точки зрения процесс окислительно-восстановительный.
- Коррозия – это самопроизвольный процесс, возникающий по причине неустойчивости термодинамической системы металл – компоненты окружающей среды.
- Коррозия – это процесс, который развивается в основном на поверхности металла. Однако, не исключено, что коррозия может проникнуть и вглубь металла.
Химическая стойкость свинца.
Стандартный потенциал свинца равен -0,126В. Коррозионная устойчивость свинца во многом определяется устойчивостью продуктов его коррозии.
Свинец устойчив:
- В серной кислоте и сульфатах;
- В фосфорной кислоте и фосфатах;
- В соляной кислоте до 10%;
- В жестких водах с сульфатом кальция;
- В кремниевой кислоте;
- В индустриальных атмосферах с сероводородом, сернистым газом и серной кислотой.
Свинец неустойчив:
- В азотной кислоте;
- В уксусной кислоте;
- В щелочах;
- В серной кислоте выше 96% и олеуме;
- В горячей серной кислоте до 80%;
- В соляной кислоте свыше 10%;
- В подземных водах с органическими кислотами;
- В подземных водах насыщенных углекислотой.
Метод 1
Метод дает возможность оценить устойчивость покрытий к коррозии при воздействии изменений температурных значений, высокой влажности воздуха и разрушительного солнечного воздействия в течение короткого промежутка времени. Для тестирования устанавливают определенные условия. Температурное значение составляет 40оС, а влажность воздуха 97%.
Испытание состоит из 5 циклов. Где каждый цикл начинается с выдерживания образца в указанных условиях 1 час. После этого обогрев отключают, и оставляют изделие еще на 2 часа. Далее их помещают в световую камеру с реж. 3-17 еще на 2 часа. Завершающим шагом образцы держат 19 часов на воздухе в условиях с температурным значением в пределах 15-30оС и влажностью воздуха до 80%.
После 5 циклов образцы оцениваются.
6.Химическая стойкость цинка.
Стандартный потенциал цинка равен -0,76В. Цинк может корродировать как с водородной, так и с кислородной деполяризацией. В чистом виде применяется редко, в основном в хроматированом или хромИтированом виде, а также в пассивированом виде с применением безхромовых пассиваторов.
Цинк устойчив:
- В пресной воде до 55оС;
- В чистой и морской сухих атмосферах.
Цинк неустойчив:
- В кислых средах (при рН ниже 7);
- В щелочных средах (при рН выше 12);
- В индустриальных средах, содержащих SO2, SO3, HCl;
- В морской воде и влажной морской атмосфере.
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
фосфатирование – получение защитной пленки фосфатов (Fe3(PO4)2, Mn3(PO4)2);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла и коррозионной среды
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Примеры задач с решениями на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов, а также уравнения реакций, протекающих при электрохимической коррозии металлов приведены в разделе Задачи к разделу Коррозия металлов
Категории Коррозия металлов, ОБЩАЯ ХИМИЯ
Химическая стойкость кадмия.
Стандартный потенциал кадмия равен -0,4В. Кадмий обладает низкой способностью к пассивации. По коррозионному поведения аналогичен цинку, однако с понижением рН скорость коррозии снижается. Кадмий более устойчив в кислых и нейтральных средах, чем цинк. В щелочных средах кадмий вполне устойчив. Самое главное — кадмий, в отличие от цинка, устойчив в морской воде и это определяет его главное применение. Присутствие SO2 и SO3 кадмий быстро корродирует. Как и цинк, кадмиевые покрытия применяются в хроматированом виде.
Сплав cупердуплексной нержавеющей стали 2507
Нержавеющая сталь
Дуплексная нержавеющая сталь имеет двухфазную микроструктуру, состоящую из зерен аустенита и феррита. Такая структура придает этим материалам сочетание привлекательных свойств, включая прочность, пластичность и коррозионную стойкость.
Сплав супердуплексной феррито-аустенитной нержавеющей стали 2507 отлично подходит для работы в высококоррозионных условиях. В ее состав входят никель, молибден, хром, азот и марганец, что обеспечивает превосходную устойчивость к сплошной, точечной и щелевой коррозии, коррозионному, а также растрескиванию под напряжением при сохранении качества свариваемости.
- Повышенный предел текучести и прочности на разрыв при повышенных номинальных параметрах давления.
- По сравнению с трубками из стали 316/316L с таким же наружным диаметром и номинальным давлением меньшая толщина стенок способствует увеличению потока среды.
- Свариваемость.
- Области применения с температурами до 482 °F (250 °C).
- Более высокая теплопроводность / более низкий коэффициент температурного расширения в сравнении с нержавеющей сталью 316.
- Возможность использования в среде высокосернистого газа (NACE MR0175/ISO 15156)
- Изделия Swagelok из сплава 2507 предлагаются из прутков и поковок, соответствующих требованиям стандарта NORSOK M-650, регламентирующего поставщиков стали.
Механические свойства сплава 2507 делают его превосходным выбором для морских систем высокого давления и подводных систем, где необходимо учитывать факторы коррозии, большого расхода среды и веса.
Для борьбы со:
сплошной коррозией; местной коррозией; коррозионным растрескиванием под напряжением
Химическая стойкость титана.
Стандартный потенциал титана равен -1,63/-1,21В для двухвалентной и трехвалентной формы соответственно. Титан склонен к пассивации.
Титан устойчив:
- В окислительных средах (в т.ч. хроматы, перманганаты, перекись водорода, кислород, азотная кислота);
- В присутствии хлорид-ионов;
- В царской водке;
- В хлориде железа (III) до 30% и до 100о С;
- В хлориде меди (II) до 20% и до 100о С;
- В хлориде ртути (II) всех концентраций до 100о С;
- В хлориде алюминия до 25% и до 60о С;
- В хлориде натрия всех концентраций до 100о С;
- В растворе гипохлорита натрия до 100о С;
- В хлорной воде;
- В газообразном хлориде до 75о С;
- В соляной кислоте не более 3% при 60о С;
- В соляной кислоте не более 0,5% при 100о С;
- В фосфорной кислоте до 30 не выше 35о С;
- В фосфорной кислоте до 3% при 100о С;
- В атмосфере влажного хлора (при наличии выше 0,005% влаги);
- В щелочах до 20%;
- Во многих органических средах.
Титан неустойчив:
- В соляной кислоте выше 3% при 60о С;
- В соляной кислоте более 0,5% при 100о С;
- Максимумы растворения титана в серной кислоте наблюдаются при 40% и 75%;
- В атмосфере абсолютно сухого хлора;
- В щелочах выше 20%.
О коррозионной стойкости инструментальной стали
Железо и сталь подвержены коррозии. Чем больше углерода в стали, тем сильнее она способна корродировать. Поднять коррозионную стойкость стали, то есть сопротивляемость коррозии, можно тремя путями:
1-й путь.
Коррозионная стойкость сталей определяется наличием легирующих элементов, способных делать сталь более благородной, то есть расположенных правее железа в ряду электрохимической активности металлов:
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Cr→Zn→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
таких элементов оказывается совсем не много, а их вклад в повышение коррозионной стойкости не очень велик, поскольку ввести эти элементы в количествах, достаточных для скачка коррозионной стойкости, в состав стали оказывается невозможным или затруднительным. Наличие таких элементов, как Ni, Co, Mo, W, Cu в составе стали указывает на повышенную коррозионную стойкость, однако даже быстрорежущие стали, содержащие большое количество вольфрама и молибдена, не являются коррозионностойкими.
2-й путь.
Легирующие элементы в стали, способные образовывать на поверхности стали прочную оксидную пленку. По иронии судьбы эти элементы стоят в ряду электрохимической активности левее железа, то есть более активные. Этими элементами могли бы быть титан, хром, алюминий, кремний, но только хром можно вводить в количествах, при которых сталь станет «нержавеющей», то есть покрытой сплошной пленкой оксида хрома. Оксид хрома чрезвычайно химически стоек и его пленка защищает сталь от воздействия агрессивной среды. Для того, чтобы пленка оксида была сплошной, свободного хрома в стали должно быть более 13%. Свободного – значит способного соединяться с кислородом воздуха и не связанного химически с другими атомами в стали. Максимальная коррозионная стойкость хромистых сталей достигается после закалки, поскольку именно закалка делает хром в стали свободным.
3-й путь.
Снижение количества углерода. Поскольку наличие углерода повышает прочность и износостойкость, третий путь редко применяется в инструментальных сталях. Существует лишь несколько марок инструментальных сталей, в которых углерод заменен азотом. Максимальной же коррозионной стойкостью обладают стали, коррозионная стойкость которых повышена тремя путями, чаще всего в этих сталях очень мало углерода, много хрома и никеля, также содержится некоторое количество титана или молибдена. Это так называемые в просторечье «пищевые нержавейки», применяемые в пищевой и химической промышленности. Однако присутствие никеля в больших количествах делает сталь неспособной принимать закалку. Стали типа 12Х18Н10Т, 12Х23Н18 применяют в ножеделии для изготовления фурнитуры ножей, например, винтов, темлячных трубок. Стали для режущего лезвийного инструмента обладают меньшей коррозионной стойкостью, поскольку не содержат никеля в значительных количествах и содержат чаще всего много углерода.
По коррозионной стойкости стали, применяемые для изготовления режущего лезвийного инструмента могут быть условно разделены на несколько групп.
Группа-1:
Активно корродирующие или некоррозионностойкие стали. Это стали, не содержащие легирующих элементов (углеродистые), а также легированные и содержащие легирующие элементы в количестве до 20%, однако содержание хрома не превышает 6%. Такие стали требуют тщательного ухода при эксплуатации ножей, возможно консервации при хранении. Коррозия с образованием ржавчины идет на таких сталях в течении минут. Следует заметить, что многие представители первой группы являются чемпионами по удержанию остроты режущей кромки.
Группа-2:
Условно коррозионностойкие стали, часто не образующие активно ржавчины, однако корродирующие с образованием патины (потемнения). Эти стали можно назвать сталями с повышенным сопротивлением коррозии. Чтобы коррозия проходила с образованием ржавчины, такие стали должны храниться в течении часов или десятков часов во влажной среде. Это стали, содержащие легирующие элементы в количествах более 10%, причем содержание хрома, как важнейший показатель коррозионной стойкости, колеблется в интервале 6-12%. Ножи из таких сталей требуют протирки после использования.
Группа-3:
Коррозионностойкие стали, не образующие ржавчины, и почти не корродирующие во влажной атмосфере. Эти стали содержат хрома всегда не менее 13%, но и высокое содержание хрома не гарантирует сопротивления коррозии. Максимальное сопротивление коррозии у хромистых инструментальных сталей бывает в состоянии закалки с низким отпуском. Чтобы коррозия правильно термообработанных коррозионностойких сталей проходила с образованием ржавчины, они должны храниться в течении нескольких суток, а иногда и месяцев, во влажной среде в присутствии органических кислот, ферментов, солей, активных окислительных реактивов. Например, возможна точечная коррозия при хранении в сырых ножнах, ведь кожа может содержать как органические вещества, так и минеральные окислители, применяемые для дубления. Несмотря на то, что в просторечье эти стали именуют «нержавеющие стали», это не совсем так: не бывает абсолютно нержавеющих инструментальных сталей!
Термин «нержавеющая» обычно используется в маркетинговых целях. Инструмент из этой группы сталей чаще всего не требует особого ухода, однако из соображений сохранности и инструмента, и зачастую здоровья, не забывайте мыть и насухо протирать ножи после использования. Даже самые коррозионностойкие азотистые стали типа Cronidur-30 обладают скоростью коррозии в десятки раз меньшей, чем у ближайших соседей, но эта скорость коррозии не нулевая.
Буров С.В.