06.05.2020 Автор: VT-METALL
Вопросы, рассмотренные в материале:
- Как получают цветные металлы
- Виды легких цветных металлов
- Виды тяжелых цветных металлов
- Виды малых цветных металлов
- Виды легирующих цветных металлов
- Благородные цветные металлы
- Примеры веществ, входящих в группу цветных металлов
- О видах и маркировке лома цветных металлов
Различные виды цветных металлов широко применяются в современных отраслях промышленности. Особенно они ценятся там, где требуется устойчивость изделий к использованию в агрессивных средах. Но как происходит деление на черные и цветные металлы? К последним относят те, в составе которых отсутствует железо. Групп таких материалов довольно много, а четкая классификация отсутствует.
В нашей статье мы расскажем про основные категории цветных металлов и поговорим о классификации их лома.
Получение цветных металлов
На то, чтобы добыть цветные металлы, уходит много сил и материальных ресурсов, так как они находятся в земле в небольшом количестве, а встретить их в чистом виде практически нереально.
Добытую руду отправляют на завод цветных металлов для дальнейшей переработки посредством особых технологий, включающих ряд металлургических процессов, таких как:
- Пирометаллургия. В этом случае металл получают и очищают при высоких температурах. Так изготавливают примерно 60 % цинка, весь свинец, около 95 % меди.
- Гидрометаллургия. Металл извлекают из руды, концентратов и отходов производства посредством применения химических реагентов с последующим выделением из водных растворов.
- Электрометаллургия. В основе получения металлов и их соединений лежит электролиз, то есть цветные металлы выделяют из растворов либо расплавов их соединений путем пропускания через них постоянного электрического тока. В частности, такую технологию применяют для получения алюминия.
Токсичность
Несмотря на важную биологическую роль лития в нашем организме, он может быть опасным. Самый легкий металл достаточно токсичен и способен вызывать отравления. При горении он провоцирует раздражение и отёки слизистых оболочек. Если на них попадет кусочек целого металла, произойдёт то же самое.
Литий нельзя брать в руки без перчаток. Взаимодействуя с влагой в воздухе или влагой на коже, он легко вызывает ожог. С расплавленным металлом нужно быть ещё осторожнее, так как его активность повышается в разы. При работе с ним нужно помнить, что это щелочь. Уменьшить его действие на кожу можно обычным уксусом.
В организме литий повышает устойчивость иммунной системы и улучшает работу нервной системы. Но его переизбыток сопровождается головокружением, сонливостью, потерей аппетита. Отравление металлом приводит к снижению либидо, слабости в мышцах, набору веса. При этом может ухудшиться зрение, память и наступить кома. Работать с литием нужно всегда в перчатках, защитном костюме и очках.
Виды легких цветных металлов
Цветные металлы широко распространены в природе, отличаются прочностью, малой плотностью и высокой химической активностью. Добывать их начали еще в XIX в. Получают их посредством электролиза солей в расплавленном виде, электро- и металлотермии. Многие легкие цветные металлы применяют для производства сплавов.
Ниже рассмотрим виды легких цветных металлов.
- Алюминий.
Металл серебристого цвета с низкой плотностью и высокой прочностью, точка плавления – около +700 °С. В промышленности его используют в составе сплавов. Его без труда можно резать, пилить, сверлить, варить и гнуть.
VT-metall предлагает услуги:
Обычно его используют для образования сплавов с металлами, имеющими различные свойства, например, с медью, никелем, магнием и кремнием. Такие соединения очень прочные и стойкие к неблагоприятным погодным условиям. Алюминий обладает высокой тепло- и электропроводностью.
Рекомендуем статьи по металлообработке
- Марки сталей: классификация и расшифровка
- Марки алюминия и области их применения
- Дефекты металлический изделий: причины и методика поиска
- Магний.
Цвет металла – серебристо-белый, на поверхности имеется окисная пленка. Магний отличается малой плотностью, но при этом хорошо поддается обработке, стоек к воздействию горючих веществ, таких как бензин, керосин, минеральные масла, но растворяется в кислотах. Не магнитен. Характеризуется малой упругостью и низкими литейными свойствами. Неустойчив к коррозии.
- Титан.
Немагнитный легкий металл серебристого цвета с голубым отливом. Имеет высокую прочность и устойчивость к коррозии. Среди недостатков можно выделить маленькую тепло- и электропроводность. При температуре свыше +400 °С титан утрачивает свои механические свойства, а при достижении +540 °С становится хрупким.
При соединении с такими металлами, как алюминий, марганец, хром, молибден и др., механические свойства титана увеличиваются. Такие сплавы отличаются друг от друга прочностью, в зависимости от легирующего металла. Титановые соединения широко востребованы в судо-, машино-, самолетостроении. Их используют в производстве ракетной техники, бытовых приборов и т.д.
Самый легкий и прочный металл
Алюминий
В поисках золотой середины между легкостью и прочностью большинство химиков сходятся во мнении – таковым металлом является алюминий.
Алюминий – золотая середина между легкими и прочными металлами
Алюминий был открыт в 1825 году датчанином Эрстедом. Первым изделием, изготовленным из алюминия, стала детская погремушка. С тех пор неприхотливому в обработке металлу нашлось столь широкое применение, что это вещество по праву получило звание металла XX века. Из него производят все, без чего нельзя представить наш современный быт: от строительных конструкций до садового инвентаря, фурнитуры и столовых приборов.
Виды тяжелых цветных металлов
Сырьем для производства тяжелых цветных металлов служат сульфидные и окисленные полиметаллические руды. При этом могут использоваться различные производственные техники и способы, основная задача которых состоит в максимальном извлечении ценных компонентов из руды.
При обработке тяжелых цветных металлов используют технологии пиро- и гидрометаллургии. В результате этих процессов образуются черновые металлы, которые в дальнейшем рафинируются и используются в промышленности.
- Медь.
Распространенный тяжелый металл, обладающий высокой электро- и теплопроводностью, пластичностью.
Медь отлично соединяется с другими компонентами. Благодаря этому полученные сплавы широко используются в машиностроении.
- Цинк.
Не все сплавы с содержанием цинка используются в промышленной сфере. Все дело в его хрупкости. Однако при нагревании до +150 °С он легко поддается ковке и прокатке. Цинк устойчив к коррозии, но разрушается при взаимодействии с кислотой и щелочью.
- Свинец.
Имеет серый цвет, отдающий голубоватым оттенком. Точка его плавления – +327 °С. Свинец одновременно тяжелый и мягкий металл, отлично поддается ковке молотком, не затвердевая при этом. При литье принимает различные формы. Не поддается воздействию соляной, серной, уксусной и азотной кислот.
Реакции с литием
Учитывая его щелочную природу, можно предположить, что он очень активен. Однако металл является самым спокойным представителем своей группы. При нормальной комнатной температуре литий слабо реагирует с кислородом и многими другими веществами. Свой «бурный нрав» он проявляет после нагревания, тогда он вступает в реакцию с кислотами, различными газами и основаниями.
В отличие от других щелочных металлов с водой он реагирует мягко, образуя гидроксид и водород. С сухим воздухом реакции практически нет. Но если он влажный, то литий медленно реагирует с его газами, образуя нитрид, карбонат и гидроксид.
При определённых температурах самый легкий металл активен с аммиаком, этиловым спиртом, галогенами, водородом, углеродом, кремнием, серой.
Виды малых цветных металлов
К цветным металлам также относят:
- сурьму;
- ртуть;
- кадмий.
Сурьма – это металл серебристо-белого цвета с синеватым оттенком. Отличается особой хрупкостью, что позволяет раскрошить его даже при помощи пальцев рук. Однако при соединении с другими металлами существенно увеличивает их твердость. Сурьма пользуется популярностью не только в промышленности, но и в медицине – она является эффективным средством при лечении воспалений слизистой оболочки глаза.
Ртуть – это металл, находящийся в жидком агрегатном состоянии. На протяжении долгого времени используется в медицине (в градусниках), применяется в современных технологиях (в датчиках положения, в ионных двигателях).
Кадмий – белое вещество с металлическим отливом. Несмотря на свою особую твердость, без труда режется даже ножом. Имеет свойства, схожие со ртутью и цинком. В чистом виде ядовит для всего живого.
Сплавы лития
Свойства лития повышают отдельные качества металлов, из-за чего его часто используют в сплавах. Полезной является его реакция с окислами, водородом, сульфидами. При нагревании он образует с ними нерастворимые соединения, которые легко извлечь из расплавленных металлов, очистив их от этих веществ.
Для придания сплаву стойкости к коррозии и пластичности его смешивают с магнием и алюминием. Медь в сплаве с ним становится более плотной и менее пористой, лучше проводит электричество. Самый легкий металл повышает твёрдость и пластичность свинца. При этом он повышает температуру плавления многих веществ.
Благодаря литию металл становится прочным и устойчивым к разрушениям. При этом он не утяжеляет их. Именно поэтому сплавы на его основе применяются в космической инженерии и авиации. Главным образом используются смеси с кадмием, медью, скандием и магнием.
Виды легирующих цветных металлов
К ним относятся, например:
- молибден;
- вольфрам;
- кобальт;
- ванадий.
Молибден в чистом виде в природе не встречается. По прочности уступает вольфраму, однако более легко поддается обработке. В основном применяется в авиационной и ракетной промышленных отраслях.
Вольфрам – один из наиболее тугоплавких и плотных металлов, имеет серебристо-белый цвет, внешне похож на платину. Он широко применяется в производстве различных режущих инструментов, ювелирных изделий, деталей для самолетов и ракет, боеприпасов.
Кобальт имеет серебристый цвет с желтым или синим отливом. Сплавы с его преобладанием используют при изготовлении различных медицинских деталей и инструментов.
Ванадий – высокопластичный металл серебристо-белого цвета, который активно используют в автомобилестроении, так как он существенно повышает антикоррозионные и механические свойства стали.
Самый легкий искусственный металл
Микролаттис
Известно, что самый легкий природный металл – литий. Однако в 2015 году ученые Калифорнийского университета продемонстрировали сверхлегкий материал по прочности схожий с металлами, но в сотню раз легче пенопласта. Он на 99,99% состоит из воздуха. При этом толщина его стенок составляет всего 100 нанометров – в тысячу раз тоньше человеческого волоса.
Если положить кусок микролаттиса на одуванчик, цветок, чью «шапку» может разрушить даже легкое дуновение ветерка, не деформируется.
Микролаттис так легок, что не деформирует одуванчики
Структура микролаттиса напоминает человеческие кости. Материал имеет такую же ячеистую структуру, состоящую из полых никелевых трубок, пересекающихся крест-накрест. Благодаря строению материал способен выдерживать колоссальные для своего веса нагрузки.
Микролаттис под микроскопом
Компания Boeing незамедлительно объявила о намерении использовать микролаттис для «самолетов будущего».
Благородные цветные металлы
К таковым относят:
- золото;
- серебро;
- платину.
Золото – металл, обладающей чрезвычайной химической стойкостью. Его не получится окислить даже в расплавленном виде – растворяется только под воздействием состава из соляной и азотной кислот. Отличается высокими показателями текучести, отлично поддается обработке. Цена на бирже цветных металлов за 1 г составляет 2 450 руб.
Серебро – металл, отличающийся пластичностью, высокой электро- и теплопроводимостью, хорошо поддается ковке, не окисляется под воздействием О2.
Виды редких цветных металлов
К таким металлам относят:
- тантал;
- ниобий.
Тантал – твердый и плотный металл серебристого оттенка, однако хорошо поддающийся обработке. Основные отрасли его применения – металлургическая, химическая и ядерная.
Ниобий – серое вещество со стальным отливом. Отличается особой тугоплавкостью и парамагнитными свойствами. Используется в авиации и радиотехнической отрасли.
Нахождение в природе и значение
Самый легкий металл имеет около 30 собственных минералов, но только 5 из них используются в промышленности: пенталит, амблигонит, лепидолит, циннвальдит и сподумен. Кроме того, находится он в солёных озёрах. Всего в земной коре содержится 0,005 % этого металла.
Большие промышленные запасы лития находятся на всех континентах. Его добывают в Бразилии, Австралии, ЮАР, Канаде, США и других странах. После чего применяют его в электронике, металлургии, лазерных материалах, ядерной энергетике и даже медицине.
Большое содержание лития есть в гумусах, что говорит о его участии в круговороте природных веществ. Металл присутствует в организме животных, а также во многих растениях. Литием богаты персики, грибы, редис, картофель, морковь.
В нашем организме он содержится в печени, крови, лёгких, костях и других органов. Недостаток лития приводит к нарушениям в работе нервной системы и мозга. Он повышает устойчивость организма к болезням, активизирует деятельность ферментов. С помощью него борются с болезнью Альцгеймера, психическими расстройствами, склерозом, а также различными зависимостями.
Виды и маркировка лома цветных металлов
Некоторые виды лома цветных металлов могут быть переработаны с целью их вторичного использования.
В таблице ниже представлен список металлов и количество видов лома к каждому из них.
| Название металла | Количество видов лома |
| Алюминий | 32 |
| Вольфрам | 17 |
| Кадмий | 2 |
| Кобальт | 3 |
| Магний | 8 |
| Медь | 13 |
| Латунь | 23 |
| Бронза | 15 |
| Молибден | 9 |
| Свинец | 11 |
| Ртуть | 6 |
| Олово | 10 |
| Никель | 26 |
В пункты по приему вторичного сырья чаще всего сдают сплавы цветных металлов. Принадлежность к тому либо иному виду металла определяют по преобладающему в сплаве элементу в процентном соотношении. Оценка происходит посредством применения особого оборудования.
Лом цветных металлов принято делить на группы в зависимости от:
- происхождения;
- химических составляющих;
- физического состояния материала на момент сдачи.
Цветной металл становится ломом, если:
- обнаружен брак;
- списан в отходы промышленного производства;
- является некондиционным;
- стал скрапом готовой продукции.
Химические составляющие лома возможно определить только в лаборатории, именно после этого можно верно сказать, к какому металлу либо сплаву он относится.
Наиболее ценным вторичным сырьем являются нелегированные металлы, содержащие примеси в незначительном количестве. Однако физические параметры скрапа не имеют такую же важность, как и химические.
В соответствии с этими характеристиками виды лома цветных металлов принято делить таким образом:
- класс А – лом и куски отходов;
- класс Б – стружка, проволока и небольшие кусковые отходы;
- класс В – отходы в виде порошка (встречаются нечасто, обычно у определенных металлов, среди которых вольфрам, молибден, кобальт и титан).
- класс Г – остальные виды вторичного сырья.
Весь цветной скрап проходит тщательную проверку на:
- загрязнения химического и радиационного типа;
- степень взрывоопасности.
После ее проведения выдается сертификат, подтверждающий безопасность лома. Без данного документа дальнейшая транспортировка невозможна.
Насыщенность лома вредными веществами не должна превышать норму, установленную ГОСТом 12.1.005.
Министерство природных ресурсов и экологии РФ различает пять классов цветного металлолома, представляющих химическую, радиационную и взрывоопасность. Это скрап:
- Опасный для экологической среды. К таким отходам относят ртуть, а также плутоний и полоний.
- Имеющий высокую опасность, на выведение последствий от применения которого необходимо 30 лет. К нему относят сплавы таких металлов, как свинец, молибден и кобальт.
- Имеющий умеренную опасность, после применения которого на восстановление экологии нужно 10 лет. К нему относят лом с примесями таких металлов, как медь, железо, цинк, никель, алюминий и серебро.
- Имеющий малую опасность, на выведение последствий от применения которого необходимо 3 года. К данному классу относится бронза.
- С низким уровнем опасности, который не наносит ущерб экосистеме. Сюда входит большинство видов лома цветных металлов.
Пункты приема металлолома обязаны иметь лицензию. Эта необходимость обуславливается тем, что цветмет представляет опасность для людей и экологической среды. ГОСТ регулирует определение сортов лома в соответствии с обозначенными параметрами качества.
При этом берутся во внимание некоторые характеристики, присущие скрапу, среди которых:
- величина;
- происхождение;
- степень однородности;
- процент засора;
- химические составляющие;
- физический износ;
- габаритные размеры.
Представительная проба позволяет выявить качество лома. Во время его транспортировки обязательным требованием является маркировка, содержащая следующую информацию:
- наименование;
- обозначение в соответствии с ГОСТом;
- вид вторичного сырья;
- марка сплава.
Маркировка должна быть надежно прикреплена к грузу при транспортировке и хранении.
Для определения марки металла нужно только заглянуть в специальный документ – марочник, который содержит информацию обо всех маркировках интересующего вас металла либо сырья.
Лекция 1. Общая характеристика металлов
План.
1. Особенности строения атомов металлов. Положение металлов в ПС.
2. Строение простых веществ-металлов. Металлическая связь и металлическая кристаллическая решетка.
3. Физические свойства металлов.
4. Химические свойства металлов.
5. Нахождение в природе и общие способы получения металлов.
6. Понятие про коррозию.
1. Внешний электронный уровень элементов, которые относят к металлам заполнен электронами менее чем наполовину (обычно 1-2). Обычно это s-электроны. К типичным металлам (т.е. проявляющим металлические свойства в максимальной степени) относят s-элементы (элементы 1 и 2 группы, главных подгрупп), т.е. те у которых только начинается заполнение нового слоя. Причем металлические свойства усиливаются с увеличением радиуса атомов (числа электронных слоев). К металлам относят также все d элементы (т.е. те у которых идет заполнение d-подуровня предпоследнего слоя), они расположены в побочных подгруппах во всех группах. d элементы называют переходными металлами, нетипичными. К металлам относятся и f- элементы (лантаноиды и актиноиды, которые располагают обычно отдельными строками внизу таблицы
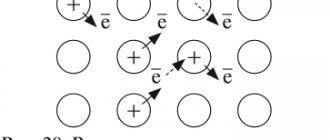
2. Металлы имеют кристаллическое, т.е. упорядоченное строение. Часть атомов в кристаллической решетке ионизирована, т.е. потеряла электроны внешнего электронного слоя и свободные электроны равномерно распределены по всему кристаллу. Они присоединяются к ионам металла и те превращаются в атомы, а другие атомы металла в это время теряют свои электроны и превращаются в ионы. Т.е. происходит своеобразный обмен электронами. Валентные электроны находятся одновременно во владении всех атомов и ионов металла (т.е. притягиваются к ним) и называются «электронным газом. Такая связь между атомами в кристалле металла называется металлической. И кристаллическая решетка металлов тоже называется металлической. Металлы имеют немолекулярное строение. Металлическая связь нелокализована между определенными атомами.
3. Общие физические свойства металлов обусловлены сходством в строении кристаллической решетки и одинаковом типе химической связи.
Эта связь достаточно прочная, поэтому металлы при н.у. находятся в твердом агрегатном состоянии. Исключение – ртуть Hg с температурой плавления (-39 ). Но температуры плавления металлов могут быть разные. Есть
металлы легкоплавкие (менее 100 ), например цезий Сs (28 ) и другие щелочные металлы, магний, алюминий… Есть и тугоплавкие(более 100 ), например вольфрам W (3380 ), а также хром, молибден, медь, титан, железо…
Металлическая кристаллическая решетка плотная и поэтому все металлы непрозрачные и отражают падающий свет (белый цвет, металлический блеск). Исключением являются золото и медь, которые поглощают часть спектра и имеют желтый цвет.
Все металлы могут проводить электрический ток. Это свойство обусловлено наличием подвижных электронов в кристаллической решетке. При обычных условиях самой высокой электропроводностью обладают металлы подгруппы меди: Ag, Cu, Au и алюминий. Эти металлы используются как проводники в электротехнике и радиоэлектронике. Высокое сопротивление имеют вольфрам, никель, хром. Из них изготавливают нагревательные элементы электроприборов.
Металлы проводят не только электрический ток, но и тепло. Металлы, хорошо проводящие электрический ток, имеют высокую теплопроводность. Это тоже связано с возможностью электронов перемещаться и переносить тепловую энергию.
Все металлы в той или другой степени пластичны (т.е. они необратимо деформируются при механических нагрузках), их можно ковать. Самым пластичным является золото, из него можно получить нить в 500 раз тоньше человеческого волоса, т.е. практически невидимую. Мягкими являются также и щелочные металлы. Очень твердыми металлами считаются хром и вольфрам. А сурьма при комнатной температуре настолько хрупкая, что ее можно растереть в порошок. Пластическая деформация объясняется тем, что у металлов не происходит разрыва химических связей в металлической кристаллической решетке, ионы и атомы просто смещаются относительно друг друга.
Все металлы не растворимы в воде, но растворяются друг в друге. Такие растворы называют сплавами.
По плотности металлы делят на легкие (меньше 5 г/см3) и тяжелые. К легким металлам относятся щелочные и щелочноземельные металлы, титан, алюминий. К тяжелым относятся цинк, железо, медь, ртуть, свинец, золото. Самым тяжелым является осмий (22,6 г/см3).
4. Общие химические свойства металлов тоже определяются общими чертами в их строении. Все они завершают внешний электронный слой отдавая валентные электроны. Следовательно, в химических реакциях простые вещества — металлы всегда являются восстановителями.
Me0 – ne- → Me+n Например:
Чем легче атомы отдают электроны, тем более сильным восстановителем является металл. Но надо помнить, что ионы металлов способны принимать электроны, т.е. проявлять окислительную способность. Причем чем легче атом теряет электроны, тем хуже принимает их соответствующий ион. Т.е. например, натрий активный восстановитель, но ион натрия окислительной активности не проявляет. Малоактивный атом меди неохотно теряет свои электроны, а ион меди является достаточно сильным окислителем.
Окислителями металлов могут выступать разные вещества, но в природе и технике важнейшими считают газообразный кислород и ион водорода, который присутствует в воде и растворах кислот. Рассмотрите внимательно таблицу.
| Li | K | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H2 | Cu | Hg | Ag | Pt | Au | |
| Восстановительная способность металлов в свободном состоянии | Возрастает | ||||||||||||||||||
| Взаимодействие с кислородом воздуха | Быстро окисляется при обычной температуре | Медленно окисляется при обычной температуре или при нагревании | Не окисляются | ||||||||||||||||
| Взаимодействие с водой | При обычной температуре выделяется H2 и образуется гидроксид | При нагревании выделяется водород, и образуются оксиды | Не вытесняют водород из воды | ||||||||||||||||
| Взаимодействие с кислотами | Вытесняют водород из разбавленных кислот ( кроме HNO3) | Не вытесняют водород из разбавленных кислот | |||||||||||||||||
| Реагируют с HNO3 иконц. H2SO4 | Растворяются только в «царской водке» | ||||||||||||||||||
| Нахождение в природе | Только в соединениях | В соединениях и в свободном виде | Главным образом в свободном виде | ||||||||||||||||
| Способы получения | Электролиз расплавов | Восстановление углём, СО, активными металлами, электролиз водных растворов | |||||||||||||||||
| Окислительная способность ионов металлов | Li | K | Ca | Na | Mg | Al3 | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H | Cu | H Hg | Ag | Pt | Au |
| Возрастает |
Окисление металлов: Zn + O2 → ZnO
Взаимодействие активных металлов с водой: K + H2O → KOH + H2
Взаимодействие металлов с кислотами: Mn + HCl → MnCl2+ H2
Взаимодействие металлов с другими окислителями: Fe + CuSO4 → FeSO4 + Cu
5. Те металлы, которые могут окисляться ионами водорода из природной воды (обычно подкисленной взаимодействием с различными кислотными оксидами) или кислородом воздуха в свободном виде, т.е. в виде простого вещества в природе не могут существовать. Значит, в свободном состоянии обычно встречаются «благородные металлы» золото, серебро и платина. Некоторые малоактивные металлы тоже могут встречаться, но такие месторождения – редкие, и к настоящему времени хозяйственного значения не имеют. Но именно это было причиной, по которой первыми металлами известными человечеству были медь, ртуть, свинец, олово… Неблагородные металлы в природе встречаются в виде соединений. Для активных металлов это соли: хлориды, сульфаты, фосфаты, карбонаты. Причем, чем ниже растворимость этих соединений, тем больше вероятность их встретить. Менее активные металлы встречаются в виде оксидов или в виде сульфидов. Причем до железа – преимущественно оксиды, а после – преимущественно сульфиды.
Естественно, что и способы получения металлов тоже зависят от их активности. Получение благородных металлов обычно заключается в отделении их от пустой породы. Существует много методов для этого, они описаны в художественной и специальной литературе. Получение металлов из их соединений можно назвать одним словом: «восстановление». Т.е. химическая суть этих процессов – заставить ионы металла принять электроны. Что можно использовать как восстановитель? Какие вещества легко расстаются со своими электронами? Правильно, металлы! Значит активные металлы можно использовать для получения менее активных из их оксидов. Например:
Mg + SnO2 → MgO + Sn
Такие способы получения металлов в зависимости от восстановителя называются магнийтермия, кальцийтермия, натрийтермия…
Хорошим восстановителем является и водород:
H2 + Cr2O3 → H2O+ Cr
Но у этих восстановителей (и водорода и активных металлов) есть существенный недостаток – высокая стоимость. Ведь в природе они в свободном виде не встречаются, а их получение требует больших затрат. Поэтому такие восстановители используют только если это экономически обосновано, т.е. для получения редких и дорогих металлов. А металлы, которые надо получать в очень большом количестве (железо), восстанавливают более дешевыми восстановителем – углеродом. Его применяют в виде кокса, а ранее использовали древесный уголь.
С + Fe2O3→ СO2 + Fe
А если металл находится в природе не в виде оксида, а в виде сульфида, то руду предварительно подвергают обжигу, а уже потом восстанавливают образовавшийся оксид. Например:
NiS + O2→ NiO + SO2
А как восстанавливают самые активные металлы? Где найти такой сильный восстановитель? Таким активным восстановителем будет электрический ток. Процесс называют электролизом. Оксид металла или его хлорид расплавляют и через расплав пропускают электрический ток. Например:
На катоде идет процесс восстановления металла: Na+ + e- → Na0
На аноде идет процесс окисления аниона: Cl- — e- → Cl20
Суммарно реакция выглядит так: NaCl → Cl20 + Na0
План.
1. Особенности строения атомов металлов. Положение металлов в ПС.
2. Строение простых веществ-металлов. Металлическая связь и металлическая кристаллическая решетка.
3. Физические свойства металлов.
4. Химические свойства металлов.
5. Нахождение в природе и общие способы получения металлов.
6. Понятие про коррозию.
1. Внешний электронный уровень элементов, которые относят к металлам заполнен электронами менее чем наполовину (обычно 1-2). Обычно это s-электроны. К типичным металлам (т.е. проявляющим металлические свойства в максимальной степени) относят s-элементы (элементы 1 и 2 группы, главных подгрупп), т.е. те у которых только начинается заполнение нового слоя. Причем металлические свойства усиливаются с увеличением радиуса атомов (числа электронных слоев). К металлам относят также все d элементы (т.е. те у которых идет заполнение d-подуровня предпоследнего слоя), они расположены в побочных подгруппах во всех группах. d элементы называют переходными металлами, нетипичными. К металлам относятся и f- элементы (лантаноиды и актиноиды, которые располагают обычно отдельными строками внизу таблицы
2. Металлы имеют кристаллическое, т.е. упорядоченное строение. Часть атомов в кристаллической решетке ионизирована, т.е. потеряла электроны внешнего электронного слоя и свободные электроны равномерно распределены по всему кристаллу. Они присоединяются к ионам металла и те превращаются в атомы, а другие атомы металла в это время теряют свои электроны и превращаются в ионы. Т.е. происходит своеобразный обмен электронами. Валентные электроны находятся одновременно во владении всех атомов и ионов металла (т.е. притягиваются к ним) и называются «электронным газом. Такая связь между атомами в кристалле металла называется металлической. И кристаллическая решетка металлов тоже называется металлической. Металлы имеют немолекулярное строение. Металлическая связь нелокализована между определенными атомами.
3. Общие физические свойства металлов обусловлены сходством в строении кристаллической решетки и одинаковом типе химической связи.
Эта связь достаточно прочная, поэтому металлы при н.у. находятся в твердом агрегатном состоянии. Исключение – ртуть Hg с температурой плавления (-39 ). Но температуры плавления металлов могут быть разные. Есть
металлы легкоплавкие (менее 100 ), например цезий Сs (28 ) и другие щелочные металлы, магний, алюминий… Есть и тугоплавкие(более 100 ), например вольфрам W (3380 ), а также хром, молибден, медь, титан, железо…
Металлическая кристаллическая решетка плотная и поэтому все металлы непрозрачные и отражают падающий свет (белый цвет, металлический блеск). Исключением являются золото и медь, которые поглощают часть спектра и имеют желтый цвет.
Все металлы могут проводить электрический ток. Это свойство обусловлено наличием подвижных электронов в кристаллической решетке. При обычных условиях самой высокой электропроводностью обладают металлы подгруппы меди: Ag, Cu, Au и алюминий. Эти металлы используются как проводники в электротехнике и радиоэлектронике. Высокое сопротивление имеют вольфрам, никель, хром. Из них изготавливают нагревательные элементы электроприборов.
Металлы проводят не только электрический ток, но и тепло. Металлы, хорошо проводящие электрический ток, имеют высокую теплопроводность. Это тоже связано с возможностью электронов перемещаться и переносить тепловую энергию.
Все металлы в той или другой степени пластичны (т.е. они необратимо деформируются при механических нагрузках), их можно ковать. Самым пластичным является золото, из него можно получить нить в 500 раз тоньше человеческого волоса, т.е. практически невидимую. Мягкими являются также и щелочные металлы. Очень твердыми металлами считаются хром и вольфрам. А сурьма при комнатной температуре настолько хрупкая, что ее можно растереть в порошок. Пластическая деформация объясняется тем, что у металлов не происходит разрыва химических связей в металлической кристаллической решетке, ионы и атомы просто смещаются относительно друг друга.
Все металлы не растворимы в воде, но растворяются друг в друге. Такие растворы называют сплавами.
По плотности металлы делят на легкие (меньше 5 г/см3) и тяжелые. К легким металлам относятся щелочные и щелочноземельные металлы, титан, алюминий. К тяжелым относятся цинк, железо, медь, ртуть, свинец, золото. Самым тяжелым является осмий (22,6 г/см3).
4. Общие химические свойства металлов тоже определяются общими чертами в их строении. Все они завершают внешний электронный слой отдавая валентные электроны. Следовательно, в химических реакциях простые вещества — металлы всегда являются восстановителями.
Me0 – ne- → Me+n Например:
Чем легче атомы отдают электроны, тем более сильным восстановителем является металл. Но надо помнить, что ионы металлов способны принимать электроны, т.е. проявлять окислительную способность. Причем чем легче атом теряет электроны, тем хуже принимает их соответствующий ион. Т.е. например, натрий активный восстановитель, но ион натрия окислительной активности не проявляет. Малоактивный атом меди неохотно теряет свои электроны, а ион меди является достаточно сильным окислителем.
Окислителями металлов могут выступать разные вещества, но в природе и технике важнейшими считают газообразный кислород и ион водорода, который присутствует в воде и растворах кислот. Рассмотрите внимательно таблицу.
| Li | K | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H2 | Cu | Hg | Ag | Pt | Au | |
| Восстановительная способность металлов в свободном состоянии | Возрастает | ||||||||||||||||||
| Взаимодействие с кислородом воздуха | Быстро окисляется при обычной температуре | Медленно окисляется при обычной температуре или при нагревании | Не окисляются | ||||||||||||||||
| Взаимодействие с водой | При обычной температуре выделяется H2 и образуется гидроксид | При нагревании выделяется водород, и образуются оксиды | Не вытесняют водород из воды | ||||||||||||||||
| Взаимодействие с кислотами | Вытесняют водород из разбавленных кислот ( кроме HNO3) | Не вытесняют водород из разбавленных кислот | |||||||||||||||||
| Реагируют с HNO3 иконц. H2SO4 | Растворяются только в «царской водке» | ||||||||||||||||||
| Нахождение в природе | Только в соединениях | В соединениях и в свободном виде | Главным образом в свободном виде | ||||||||||||||||
| Способы получения | Электролиз расплавов | Восстановление углём, СО, активными металлами, электролиз водных растворов | |||||||||||||||||
| Окислительная способность ионов металлов | Li | K | Ca | Na | Mg | Al3 | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H | Cu | H Hg | Ag | Pt | Au |
| Возрастает |
Окисление металлов: Zn + O2 → ZnO
Взаимодействие активных металлов с водой: K + H2O → KOH + H2
Взаимодействие металлов с кислотами: Mn + HCl → MnCl2+ H2
Взаимодействие металлов с другими окислителями: Fe + CuSO4 → FeSO4 + Cu
5. Те металлы, которые могут окисляться ионами водорода из природной воды (обычно подкисленной взаимодействием с различными кислотными оксидами) или кислородом воздуха в свободном виде, т.е. в виде простого вещества в природе не могут существовать. Значит, в свободном состоянии обычно встречаются «благородные металлы» золото, серебро и платина. Некоторые малоактивные металлы тоже могут встречаться, но такие месторождения – редкие, и к настоящему времени хозяйственного значения не имеют. Но именно это было причиной, по которой первыми металлами известными человечеству были медь, ртуть, свинец, олово… Неблагородные металлы в природе встречаются в виде соединений. Для активных металлов это соли: хлориды, сульфаты, фосфаты, карбонаты. Причем, чем ниже растворимость этих соединений, тем больше вероятность их встретить. Менее активные металлы встречаются в виде оксидов или в виде сульфидов. Причем до железа – преимущественно оксиды, а после – преимущественно сульфиды.
Естественно, что и способы получения металлов тоже зависят от их активности. Получение благородных металлов обычно заключается в отделении их от пустой породы. Существует много методов для этого, они описаны в художественной и специальной литературе. Получение металлов из их соединений можно назвать одним словом: «восстановление». Т.е. химическая суть этих процессов – заставить ионы металла принять электроны. Что можно использовать как восстановитель? Какие вещества легко расстаются со своими электронами? Правильно, металлы! Значит активные металлы можно использовать для получения менее активных из их оксидов. Например:
Mg + SnO2 → MgO + Sn
Такие способы получения металлов в зависимости от восстановителя называются магнийтермия, кальцийтермия, натрийтермия…
Хорошим восстановителем является и водород:
H2 + Cr2O3 → H2O+ Cr
Но у этих восстановителей (и водорода и активных металлов) есть существенный недостаток – высокая стоимость. Ведь в природе они в свободном виде не встречаются, а их получение требует больших затрат. Поэтому такие восстановители используют только если это экономически обосновано, т.е. для получения редких и дорогих металлов. А металлы, которые надо получать в очень большом количестве (железо), восстанавливают более дешевыми восстановителем – углеродом. Его применяют в виде кокса, а ранее использовали древесный уголь.
С + Fe2O3→ СO2 + Fe
А если металл находится в природе не в виде оксида, а в виде сульфида, то руду предварительно подвергают обжигу, а уже потом восстанавливают образовавшийся оксид. Например:
NiS + O2→ NiO + SO2
А как восстанавливают самые активные металлы? Где найти такой сильный восстановитель? Таким активным восстановителем будет электрический ток. Процесс называют электролизом. Оксид металла или его хлорид расплавляют и через расплав пропускают электрический ток. Например:
На катоде идет процесс восстановления металла: Na+ + e- → Na0
На аноде идет процесс окисления аниона: Cl- — e- → Cl20
Суммарно реакция выглядит так: NaCl → Cl20 + Na0