Изотопы
Основная статья: Изотопы олова
Природное олово состоит из десяти стабильных нуклидов с массовыми числами 112 (в смеси 0,96 % по массе), 114 (0,66 %), 115 (0,35 %), 116 (14,30 %), 117 (7,61 %), 118 (24,03 %), 119 (8,58 %), 120 (32,85 %), 122 (4,72 %) и 124 (5,94 %). Для некоторых из них энергетически возможен двойной бета-распад, однако экспериментально он пока (2018 г.) не наблюдался, поскольку предсказываемый период полураспада очень велик (более 1020 лет).
Олово обладает наибольшим среди всех элементов числом стабильных изотопов, что связано с тем, что 50 (число протонов в ядрах олова) является магическим числом — оно составляет заполненную протонную оболочку в ядре и повышает тем самым энергию связи и стабильность ядра. Известны два дважды магических изотопа олова, оба они радиоактивны, так как удалены от полосы бета-стабильности: нейтронодефицитное 100Sn (Z
=
N
= 50) и нейтроноизбыточное 132Sn (
Z
= 50,
N
= 82).
Изотопы олова 117Sn и 119Sn являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Химические свойства
Металлическое олово
При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной плёнки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150 °C:
Sn + O2 → SnO2
При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4, которая более характерна для олова, чем +2. Например:
Sn + 2Cl2 → SnCl4
Растворяется в разбавленных кислотах (HCl, H2SO4):
Sn + 2HCl → SnCl2 + H2↑
Олово реагирует c концентрированной соляной кислотой. При этом белое олово (α-Sn) образует раствор хлорида олова (II), а серое (β-Sn) хлорида олова (IV):
Sn + 3HCl → H[SnCl3 ] + H2↑ Sn + 4HCl → H2[SnCl6] + H2↑
Состав продукта реакции олова с азотной кислотой зависит от концентрации кислоты. В концентрированной азотной кислоте (60%) образуется оловянная кислота β-SnO2·n
H2O (иногда её формулу записывают как H2SnO3). При этом олово ведёт себя как неметалл:
Sn + 4HNO3 → SnO2 ⋅ H2O + 4NO2 + H2O
При взаимодействии с разбавленной азотной кислотой (3-5%) образуется нитрат олова (II):
4Sn + 10HNO3 → 4Sn(NO3)2 + NH4NO3 + 3H2O
Окисляется растворами щелочей до гидроксостанната (II), который в горячих расстворах склонен к диспропорцианированию:
Sn + NaOH + 3H2O → Na[Sn(OH)3] + H2↑ 2Na[Sn(OH)3] → Sn + Na2[Sn(OH)6] Sn + 2NaOH + 4H2O → Na2[Sn(OH)6] + 2H2↑
Олово (II)
Менее устойчивая степень окисления чем (IV). Вещества имеют высокую восстановительную активность и легко диспропорцианируют:
2SnO →to SnO2 + Sn
На воздухе соединения быстро окисляются кислородом, как в твердом виде, так и в растворах:
2SnO + O2 → 2SnO2 2Sn2+ + O2 + 4H+ → 2Sn4+ + 2H2O
Сильным восстановителем является «оловянная соль» SnCl2 ⋅ 2H2O
Оксид можно получить действием аммиака на горячий раствор хлорида олова в атмосфере СO2:
SnCl2 + 2NH3 + H2O → SnO + 2NH4Cl
Также при слабом нагревании гидроксида олова (II) Sn(OH)2 в вакууме или осторожном нагревании некоторых солей:
Sn(OH)2 → SnO + H2O SnC2O4 → SnO + CO↑ + CO2↑
В растворах солей олова идёт сильный гидролиз:
[Sn(H2O)3]2+ + H2O → [Sn(H2O)2OH]+ + H3O+
При действии на раствор соли Sn(II) растворами сульфидов выпадает осадок сульфида олова (II):
Sn2+ + S2− → SnS↓
Этот сульфид может быть легко окислен до сульфидного комплекса раствором полисульфида натрия, при подкислении превращающегося в осадок сульфида олова (IV):
SnS + Na2S2 → Na2SnS3 Na2SnS3 + 2HCl → SnS2 + 2NaCl + H2S↑
Олово (IV)
Оксид олова(IV) (SnO2) образуется прямым окислением кислородом. При сплавлении с щелочами образует станнаты, при обработке водой образующие гидроксостаннаты:
SnO2 + 2NaOH →to Na2SnO3 + H2O
При гидролизе растворов солей олова (IV) образуется белый осадок — так называемая α-оловянная кислота:
SnCl4 + 4NH3 + 6H2O → H2[Sn(OH)6] + 4NH4Cl H2[Sn(OH)6] → SnO2 ⋅ nH2O + 3H2O
Свежеполученная α-оловянная кислота растворяется в кислотах и щелочах:
SnO2 ⋅ nH2O + 2KOH → K2[Sn(OH)6] SnO2 ⋅ nH2O + 4HNO3 → Sn(NO3)4 + (n+2)H2O
При хранении α-оловянная кислота стареет, теряет воду и переходит в β-оловянную кислоту, которая отличается большей химической инертностью. Данное изменение свойств связывают с уменьшением числа активных HO-Sn группировок при стоянии и замене их на более инертные мостиковые -Sn-O-Sn- связи.
Гидрид олова — станнан SnH4 — можно получить по реакции:
SnCl4 + Li[AlH4] → SnH4↑ + LiCl + AlCl3
Этот гидрид весьма нестоек и медленно разлагается уже при температуре 0 °C.
Четырёхвалентное олово образует обширный класс оловоорганических соединений, используемых в органическом синтезе, в качестве пестицидов и др.
Виды олова
Виды олова для пайки:
- ПОС-18. Содержит несколько основных компонентов — олово (18%), свинец (около 81), сурьму (2,5%). Применяется при лужении металлов. Подходит для создания швов при низких стандартах. Температура плавления — 270°C.
- ПОС-30. Содержит олово (28%), свинец (около 70%), сурьму (2%). Применяется для пайки меди, стали, латуни. Температура плавления — 270°C.
- ПОС-50. Содержит олово (50%), свинец (около 50%), сурьму (0,8%). Применяется для спаивания радиодеталей, получения высокого качества шва. Температура плавления — 230°С.
- ПОС-90. Содержит олово (90%), свинец (9–10%), сурьму (0,15%).
Отдельные виды оловянных припоев — ПОС-40, ПОС-60. Применяются для пайки радиодеталей.
Нахождение в природе
Олово — редкий рассеянный элемент, по распространённости в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2⋅10−4 до 8⋅10−3 % по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn).
Месторождения
Мировые месторождения олова находятся в основном в Китае и Юго-Восточной Азии — Индонезии, Малайзии и Таиланде. Также есть крупные месторождения в Южной Америке (Боливии, Перу, Бразилии) и Австралии.
В России запасы оловянных руд расположены в Хабаровском крае (Солнечный район — месторождения Фестивальное и Соболиное; Верхнебуреинский район — Правоурмийское месторождение), в Чукотском автономном округе (Пыркакайские штокверки; рудник/посёлок Валькумей, Иультин — разработка месторождений закрыта в начале 1990-х годов), в Приморском крае (Кавалеровский район), в Якутии (месторождение Депутатское) и других районах.
Распространённость в природе
Распространённость в природе отражена в следующей таблице:
| Геол. объект | Камен. метеориты | Дуниты и др. | Базальты и др. | Диориты и др. | Гранитоиды | Глины и др. | Вода океанов | Живое вещество(% на живой вес) | Почва | Зола растений |
| Содержание, вес. % | 001⋅10−4 | 05⋅10−5 | 01,5⋅10−4 | 0000− | 0003⋅10−4 | 1⋅10−3 | 07⋅10−7 | 00005⋅10−5 | 1⋅10−3 | 005⋅10−4 |
В незагрязнённых поверхностных водах олово содержится в субмикрограммовых концентрациях. В подземных водах его концентрация достигает единиц микрограмм на литр, увеличиваясь в районе оловорудных месторождений, оно попадает в воды за счёт разрушения в первую очередь сульфидных минералов, неустойчивых в зоне окисления. ПДКSn = 2 мг/дм³.
Кристаллы касситерита — оловянная руда
Олово является амфотерным элементом, то есть элементом, способным проявлять кислотные и основные свойства. Это свойство олова определяет и особенности его распространения в природе. Благодаря этой двойственности олово проявляет литофильные, халькофильные и сидерофильные свойства. Олово по своим свойствам проявляет близость к кварцу, вследствие чего известна тесная связь олова в виде окиси (касситерита) с кислыми гранитоидами (литофильность), часто обогащёнными оловом, вплоть до образования самостоятельных кварц-касситеритовых жил. Щелочной характер поведения олова определяется в образовании довольно разнообразных сульфидных соединений (халькофильность), вплоть до образования самородного олова и различных интерметаллических соединений, известных в ультраосновных породах (сидерофильность).
Формы нахождения
Основная форма нахождения олова в горных породах и минералах — рассеянная (или эндокриптная). Однако олово образует и минеральные формы, и в этом виде часто встречается не только как акцессорий в кислых магматических породах, но и образует промышленные концентрации преимущественно в окисной (касситерит SnO2) и сульфидной (станнин) формах.
Твёрдая фаза. Минералы
Кристаллы касситерита
В общем можно выделить следующие формы нахождения олова в природе:
- Рассеянная форма
; конкретная форма нахождения олова в этом виде неизвестна. Здесь можно говорить об изоморфно рассеянной форме нахождения олова вследствие наличия изоморфизма с рядом элементов (Ta, Nb, W — с образованием типично кислородных соединений; V, Cr, Ti, Mn, Sc — с образованием кислородных и сульфидных соединений). Если концентрации олова не превышают некоторых критических значений, то оно изоморфно может замещать названные элементы. Механизмы изоморфизма различны. - Минеральная форма
: олово установлено в минералах-концентраторах. Как правило, это минералы, в которых присутствует железо Fe+2: биотиты, гранаты, пироксены, магнетиты, турмалины и так далее. Эта связь обусловлена изоморфизмом, например, по схеме Sn+4 + Fe+2 → 2Fe+3. В оловоносных скарнах высокие концентрации олова установлены в гранатах (до 5,8 вес. %) (особенно в андрадитах), эпидотах (до 2,84 вес. %) и так далее.
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu2+1Fe+2SnS4 или тиллита PbSnS2 и других минералов.
Собственно минеральные формы
Самородные элементы, сплавы и интерметаллические соединения
Хотя концентрации этих минералов в породах очень низки, однако распространены они в широком круге генетических образований. Среди самородных форм вместе с Sn выявлены Fe, Al, Cu, Ti, Cd и так далее, не считая уже известные самородные платиноиды, золото и серебро. Эти же элементы образуют между собой и различные сплавы: (Cu + Sn + Sb), (Pb + Sn + Sb) и другие, а также твёрдые растворы. Среди интерметаллических соединений установлены стистаит SnSb, атакит (Pd,Pt)3Sn, штумырлит Pt(Sn,Bi), звягинцевит (Pd,Pt)3(Pb,Sn), таймырит (Pd,Cu,Pt)3Sn и другие.
Приведённые формы нахождения олова и других элементов встречаются в различных геологических образованиях:
- Группа интрузивных и эффузивных магматических пород: траппы, пикриты Сибирской платформы, гипербазиты и габброиды Камчатки, кимберлиты Якутии, лампроиты Алдана и так далее; гранитоиды Приморья, Дальнего Востока, Тянь-Шаня.
- Группа метасоматически и гидротермально изменённых пород: медно-никелевые руды Сибирской платформы, золоторудные объекты Урала, Кавказа, Узбекистана и так далее.
- Группа современного рудообразования: пелагические осадки Тихого океана, продукты Большого Трещинного Толбачинского извержения, гидротермальная система Узон на Камчатке и прочие.
- Группа осадочных пород различного происхождения.
Окисные соединения олова
Наиболее известной формой является главный минерал олова — касситерит SnO2, представляющий собой соединение олова с кислородом. В минерале по данным ядерной гамма-резонансной спектроскопии присутствует Sn+4.
Касситерит
Основная статья: Касситерит
Касситерит
(от греч. kassiteros — олово) — главный рудный минерал для получения олова, химическая формула SnO2. Теоретически содержит 78,62 % Sn. Образует отдельные выделения, зерна, сплошные массивные агрегаты, в которых зёрна минерала достигают в размере 3—4 мм и даже больше. В чистом виде бесцветные кристаллы, примеси придают минералу самые различные цвета.
- Плотность 6040—7120 кг/м³ (наиболее низкая у светлоокрашенных касситеритов).
- Твёрдость по Моосу 6,5.
- Блеск — матовый, на гранях — алмазный.
- Спайность несовершенная.
- Излом раковистый.
Основные формы выделения касситерита:
- микровключения в других минералах;
- акцессорные выделения минерала в породах и рудах;
- сплошные или вкрапленные руды: игольчатые радиально-лучистые агрегаты (месторождения Приморья), коломорфные и криптокристаллические выделения и скопления (месторождения Приморья); кристаллическая форма — главная форма выделения касситерита.
В России месторождения касситерита имеются на Северо-Востоке, в Приморье, Якутии, Забайкалье; за рубежом — в Малайзии, Таиланде, Индонезии, КНР, Боливии, Нигерии и других странах.
Гидроокисные соединения
Второстепенное место занимают гидроокисные соединения олова
, которые можно рассматривать как соли полиоловянных кислот. К ним можно отнести минерал сукулаит Ta2Sn2+2O; твёрдый раствор олова в магнетите вида Fe2SnO4 или Fe3SnO3 (Бретштейн Ю. С., 1974; Воронина Л. Б., 1979); «варламовит» — продукт окисления станнина; считается, что он представляет собой смесь аморфных и полуаморфных соединений Sn, метаоловянной кислоты, поликонденсированной фазы и гидрокасситеритовой фазы. Известны также гидратированные продукты окисления — гидромартит 3SnO·H2O; мушистонит (Cu,Zn,Fe)Sn(OH)6; гидростаннат меди CuSn(OH)6 и другие.
Силикаты
Известна многочисленная группа силикатов олова
, представленная малаяитом CaSn[SiO5]; пабститом Ba(Sn, Ti)Si3O9, стоказитом Ca2Sn2Si6O18·4H2O и др. Малаяит образует даже промышленные скопления.
Шпинелиды
Из других окисных соединений известны также шпинелиды
, например, минерал нигерит Sn2Fe4Al16O32 (Peterson E. U., 1986).
Сульфидные соединения олова
Включает различные соединения олова с серой. Это вторая по промышленному значению группа минеральных форм нахождения олова. Наиболее важным из них является станнин, второй по значению минерал. Кроме этого, отмечаются франкеит Pb5Sn3Sb2S14, герценбергит SnS, берндтит SnS2, тиллит PbSnS2 и кестерит Cu2ZnSnS4. Выявлены и более сложные сульфидные соединения олова со свинцом, серебром, медью, имеющие в основном минералогическое значение. Тесная связь олова с медью обусловливает частое присутствие на оловорудных месторождениях халькопирита CuFeS2 с образованием парагенезиса касситерит — халькопирит.
Станнин
Основная статья: Станнин
Станнин (от лат. stannum — олово), оловянный колчедан, минерал из класса сульфидов с общей формулой вида Cu2FeSnS4. Она следует из формулы халькопирита путём замены одного атома Fe на Sn. Содержит 29,58 % Cu, 12,99 % Fe, 27,5 % Sn и 29,8 S, а также примеси Zn, Sb, Cd, Pb и Ag. Широко распространённый минерал в оловорудных месторождениях России. На ряде месторождений России (Приморье, Якутия) и Средней Азии (Таджикистан) он является существенным элементов сульфидных минералов и часто вместе с варламовитом составляет 10—40 % общего олова. Часто образует вкрапленность в сфалерите ZnS, халькопирите. Во многих случаях наблюдаются явления распада станнина с выделением касситерита.
Коллоидная форма
Коллоидные и олово-кремнистые соединения играют значительную роль в геохимии олова, хотя детально она не изучена. Значительное место в геологии элемента играют коломорфные соединения и продукты его кристаллических превращений в скрытокристаллические разности. Коломорфный касситерит рассматривается как форма выражения вязких гелеобразных растворов.
Независимые исследования выявили аномально высокую растворимость SnO2 в хлор-кремниевых растворах. Максимальная растворимость достигается при отношении SnO2\SiO2 = 1,5.
Анализ свойств соединения Sn(OH)4 и близость их к соединению Si(OH)4 выявляет способность его к полимеризации с образованием в конечном счёте соединений H2Snk
O2
k
+1, Sn
k
O2
k
−1(OH)2. В обоих случаях возможно замещение группы (ОН) на анионы F и Cl.
Таким образом, полимеризация молекул Sn(OH)4 и соединение их с молекулами Si(OH)4 ведёт к образованию геля (коллоида) и появлению цепочек Hm
Sn2
n
Si
n
O
p
, причём
m
≤ 8, или H
s
[SiO2
n
(SnO
m
)
d
] (Некрасов И. Я. и др., 1973).
Имеющиеся данные говорят о том, что коллоидная форма является естественным промежуточным звеном при осаждении олова из гидротермальных растворов.
Формы нахождения олова в жидкой фазе
Наименее изученная часть геохимии олова, хотя в газово-жидких включениях установлены касситериты в виде минералов-узников (Кокорин А. М. и др., 1975). Работ по анализу конкретных оловосодержащих природных растворов нет. В основном вся информация основана на результатах экспериментальных исследований, которые говорят только о вероятных формах нахождения олова в растворах. Существенную роль в разработке методики этих исследований принадлежит академику В. Л. Барсукову.
Вся совокупность экспериментально установленных форм нахождения олова в растворах разбивается на группы:
- Ионные соединения
. Эти соединения и их структура описываются с позиций классических валентных и стереохимических представлений. Выделяются подгруппы:
Простые ионы
Sn+2 и Sn+4 в основном обнаружены в магматических расплавах, а также в гидротермальных растворах, обладающих низкими значениями pH. Однако в существующих гидротермальных системах, отражаемых составом газово-жидких включений, такие условия не установлены. - Галогениды
— SnF2, SnF40, SnCl40. Считается, что роль хлора в переносе и отложении олова и сопутствующих металлов более значительна, чем роль фтора. - Гидроксильные соединения
. В щелочных условиях исходными являются соединения H2SnO2, H2SnO4, H2SnO3. Эти формы часто устанавливаются на основе известных минеральных форм. Часть этих форм имеет как искусственное (CaSnO3, Ca2SnO4), так и природное (FeSnO2, Fe2SnO4) происхождение. В кислых средах эти соединения ведут себя как слабые основания типа Sn(OH)2, Sn(OH)4. Считается, что одной из форм проявления подобных соединений является варламовит. Согласно экспериментальным данным Sn(OH)4 отлагается только при
Т
< 280 °C в слабокислых или нейтральных условиях при pH = 7—9. Соединения Sn(OH)4 и Sn(OH)3+ устойчивы при pH= 7—9, тогда как Sn(OH)2+2 и Sn(OH)+2 — при pH < 7. Довольно часто группы (ОН)−1 замещаются на F и Cl, создавая галогенозамещённые модификации гидросоединений олова. В общем виде эти формы представлены соединениями Sn(OH)4-
k
F
k
или Sn(OH)4−
k
F
k-n
Cl
n
. В целом соединение Sn(OH)3F устойчиво при
Т
= +25…+50 °C, а Sn(OH)2F2 — при
Т
= 200 °C. - Сульфидные соединения
. По экспериментальным данным в растворе присутствуют соединения SnS4−4 или SnS3−2 при pH > 9; SnS2O−2 (pH = 8—9) и Sn(SH)4 (pH = 6). Имеется упоминание о существовании соединения типа Na2SnS3, неустойчивого в кислой среде.
олова изучены при растворении касситерита во фторированных средах. Эти соединения отличаются высокой растворимостью. Этими же свойствами обладают соединения, полученные в хлоридных растворах. В качестве основных форм комплексных соединений, известных из экспериментов, можно назвать Na2[Sn(OH)6], Na2[SnF6], Na2[Sn(OH)2F4] и пр. Эксперименты показали, что комплекс Sn(OH)4F2−2 будет преобладать при
Т
= 200 °C.
. Об их существовании говорит присутствие на многих месторождениях коломорфных выделений касситерита.
Промышленные типы месторождений олова
Описанные выше геохимические особенности олова находят косвенное отражение в формационной классификации оловорудных месторождений, предложенной Е. А. Радкевич с последующими дополнениями.
А.
Формация оловоносных гранитов
. Касситерит установлен в акцессорной части гранитов. Б.
Формация редкометальных гранитов
. Это граниты литионит-амазонит-альбитового типа (апограниты по А. А. Беусу). Касситерит в акцессорной части вместе колумбит-татнатлитом, микролитом и прочими. В.
Формация оловоносных пегматитов
. Оловянная минерализация характерна для Be-Li-, Be-Ta-, F-Li- типов. Г.
Формация полевошпат-кварц-касситеритовая
. Выделена Ив. Ф. Григорьевым. Это кварц-полевошпатовые жилы с касситеритом и другими минералами. Д.
Формация кварц-касситеритовая
. Распространена на северо-востоке России. Это жильные зоны, грейзены с кварцем, мусковитом, вольфрамитом, касситеритом и другим. Е.
Формация касситерит-силикатно-сульфидная
с турмалиновым и хлоритовым типами. Одна из основных продуктивных формаций Приморья России. Ж.
Формация касситерит-сульфидная
. Также основная оловопродуктивная формация. В ней выделяют основные типы: 1) штокверковое олово-вольфрамовое оруденение; 2) рудные тела квар-касситерит-арсенопиритового типа; 3) продуктивные кварцевые жилы сульфидно-касситерит-хлоритового типа. З.
Формация оловянно-скарновая
. И.
Формация деревянистого олова
(риолитовая формация). К.
Формация основных и ультраосновных пород
(по И. Я. Некрасову). Л.
Формация щелочных пород Украины
(по В. С. Металлиди, 1988).
Как отличить олово от припоя?
Прежде всего, чтобы отличить чистое олово от припоя, нужно знать, что оно без примесей хрустит. Если взять пруток олова и попытаться отломить от него кусок, то будет слышен хруст.
Также при определении олова рекомендуется смотреть вот на что:
- Вес. Припой с содержанием свинца будет всегда тяжелее олова. Поэтому если взять в руки или положить на весы олово и припой, то разница в весе будет более чем ощутимая;
- Внешний вид. На вид чистое олово имеет серебристый и слегка белый оттенок, в то время как свинец всегда темноватый. Происходит это из-за того, что свинец активно окисляется на воздухе, поэтому он сильно темнеет;
- Чистое олово хрустит при деформации. Отличие припоя со свинцом как раз в том, что его структура мягка. Припой можно легко резать, гнуть, ломать, и при этом такого хруста как у чистого олова не будет.
Чаще всего людям нужно знать, чистое перед ними олово или нет, при изготовлении каких-то определённых вещей. Никому не хотелось бы носить предметы с содержанием свинца, поскольку все знают, что свинец вреден, и со временем могут возникнуть серьезные проблемы со здоровьем.
Производство
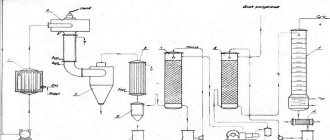
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем ~10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационным методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Таким образом удается повысить содержание олова в руде до 40—70 %. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановлении древесного угля, слои которого укладываются поочередно со слоями руды, или алюминием (цинком) в электропечах: SnO2 + C = Sn + CO2. Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
Марки олова
Известны следующие марки олова:
- О1, О1пч. Это обозначение указывает на то, что в сплаве содержится 99,9% Sn. Изготавливается в виде проволоки, прутков, чушек.
- ОВЧ-000. Сплав высокой чистоты. Содержание Sn в составе — 99,99%. Изготавливается в виде прутков, чушек.
- О2. Содержание Sn в составе — 99,565%. Производится в виде прутков, проволоки, чушек.
- О3. Сплав содержит 98,49% Sn. Изготавливается чушками.
- О4. Самое «грязное» соединение. Содержит большое количество сторонних примесей. Их примерное количество — 3,5% от общей массы.
Маркировка указывается на готовых изделиях с помощью штампа.
Применение
- Олово используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова — в белой жести (лужёное железо) для изготовления тары пищевых продуктов, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Важнейший сплав олова — бронза (с медью). Другой известный сплав — пьютер — используется для изготовления посуды. Для этих целей расходуется около 33 % всего добываемого олова. До 60 % производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев. В последнее время возрождается интерес к использованию металла, поскольку он наиболее «экологичен» среди тяжёлых цветных металлов. Используется для создания сверхпроводящих проводов на основе интерметаллического соединения Nb3Sn.
- Дисульфид олова SnS2 применяют в составе красок, имитирующих позолоту («поталь»).
- Искусственные радиоактивные ядерные изомеры олова 117mSn и 119mSn — источники гамма-излучения, являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
- Интерметаллические соединения олова и циркония обладают высокими температурами плавления (до 2000 °C) и стойкостью к окислению при нагревании на воздухе и имеют ряд областей применения.
- Олово является важнейшим легирующим компонентом при получении конструкционных сплавов титана.
- Двуокись олова — очень эффективный абразивный материал, применяемый при «доводке» поверхности оптического стекла.
- Смесь солей олова — «жёлтая композиция» — ранее использовалась как краситель для шерсти.
- Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцево-оловянный элемент, окисно-ртутно-оловянный элемент. Перспективно использование олова в свинцово-оловянном аккумуляторе; так, например, при равном напряжении, по сравнению со свинцовым аккумулятором свинцово-оловянный аккумулятор обладает в 2,5 раза большей ёмкостью и в 5 раз большей энергоплотностью на единицу объёма, внутреннее сопротивление его значительно ниже.
- Исследуются изолированные двумерные слои олова (станен), созданные по аналогии с графеном.
Получение олова из руды и месторождения
Процесс получения сплава зависит от того, в какой форме его нашли. Олово в виде руды не имеет значительных отличий от производства других цветных металлов. Процесс состоит из трех этапов:
- Добыча, обработка расходного сырья (руды).
- Восстановительная плавка для получения чернового металла.
- Рафинирование подготовленного сырья допустимыми способами.
Разработка россыпных месторождений осуществляется с помощью промышленных песковых насосов.
Физиологическое действие
О роли олова в живых организмах практически ничего не известно. Ежедневное поступление олова с пищей составляет 0,2—3,5 мг, при регулярном потреблении консервированной пищи — до 38 мг. В теле человека содержится примерно (1—2)·10−4 % олова, наибольшая концентрация наблюдается в кишечнике.
Металлическое олово не токсично, что позволяет применять его в пищевой промышленности. Олово представляет опасность для человека в виде паров, различных аэрозольных частиц и пыли. При воздействии паров или пыли олова может развиться станноз — поражение лёгких. Станнан (оловянистый водород) — сильнейший яд. Также очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м3, ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках — 100 мг/кг. Токсическая доза олова для человека — 2 г, интоксикация организма начинается при содержании в организме 250 мг/кг.
Вредные примеси, содержащиеся в олове в обычных условиях хранения и применения, в том числе в расплаве при температуре до 600 °C, не выделяются в воздух в объёмах, превышающих предельно допустимую концентрацию (в частности, определенную по ГОСТ 12.1.005—76. Длительное (в течение 15—20 лет) воздействие пыли олова оказывает фиброгенное воздействие на лёгкие и может вызвать заболевание работающих пневмокониозом.
Общее описание
Люди начали добывать руду металла еще в IV веке до нашей эры. Древние греческие и римские предметы изготавливались из оловянистой бронзы, которая была в обиходе в те времена. Сплавы содержали также примесь свинца и меди, а чистый металл научились получать только в VII веке.
Редкий элемент занимает 46-е место по распространенности в коре земли. Он залегает в виде касситерита, в массе которого содержится до 78% олова. Реже встречается оловянный колчедан с примесью меди и железа. Олово относится к группе амфотерных веществ. Элемент способен к проявлению основных и кислотных характеристик.
Металл образует отдельные кварц-касситеритовые жилы благодаря тесной связи кислородных соединений олова с ангидритами гранита. Щелочные свойства проявляются в образовании различных соединений сульфидов, вплоть до возникновения интерметаллических слияний и самородного сплава олова в основных породах.
Белое и серое олово
Различают несколько аллотропных модификаций олова. В обычных условиях существует белое олово, которое является устойчивым при температуре свыше +13,3˚С. Это мягкий металл, образующий кристаллы с элементарными ячейками, где два одинаковых вектора и третий отличный от них располагаются строго перпендикулярно друг другу. Характерный хруст слышится при сгибании прутка. Звук возникает при трении кристаллов.
Охлаждение вещества ведет к образованию серого олова. При этом возникают кубические кристаллы, отличающиеся алмазной структурой. Ионизирующее излучение также способствует переходу из одной модификации в другую и кристаллизации по карбонатному типу.
Трансформация структуры ведет к следующим изменениям:
- удельный объем увеличивается;
- плотность олова уменьшается;
- металл становится порошкообразным.
Электрофизические свойства двух вариаций разнятся из-за отличия структурных решеток и валентности. Белое олово относится к группе металлов, а серое получает характеристики ковалентного кристалла алмазной структуры. Соприкосновение двух модификаций ведет к ускорению электронного фазового перехода, так как зарождаются новые формы кристаллов. Такое явление получило наименование оловянной чумы. Используется стабилизатор (например, висмут) для предотвращения этого процесса. Катализатор гексахлорстаннат аммония, наоборот, ускоряет переход.
Изотопы элемента
Олово в природе содержит 10 неизменных нуклидов с определенным суммарным числом нейтронов, протонов и электронов в молекуле. Атомный заряд также является постоянным и соответствует порядковому номеру элемента в таблице Менделеева в химии.
Массовые числа нуклидов с изменением содержания в массе:
- 112 — 0,96% в смеси.
- 114 — 0,66%.
- 115 — 0,35%.
- 116 — 14,3%.
- 117 — 7,61%.
- 118 — 24,03%.
- 119 — 8,58%.
- 120 — 32,85%.
- 122 — 4,72%.
- 124 — 5,94%.
Некоторые элементы могут подвергаться энергетическому двойному распаду, но такое явление до сегодняшнего дня не наблюдалось из-за величины теоретического времени распада, равного 1020 лет. У олова выделяется самое большее количество стабильных изотопов. Они заполняют протонную капсулу и увеличивают устойчивость ядра.
Собственно минеральные формы
Самородные элементы, сплавы и интерметаллические соединения
Хотя концентрации этих минералов в породах очень низки, однако распространены они в широком круге генетических образований. Среди самородных форм вместе с Sn выявлены Fe, Al, Cu, Ti, Cd и т. д., не считая уже известные самородные платиноиды, золото и серебро. Эти же элементы образуют между собой и различные сплавы: (Cu + Sn + Sb), (Pb + Sn + Sb) и др., а также твёрдые растворы. Среди интерметаллических соединений установлены стистаит SnSb, атакит (Pd,Pt)3Sn, штумырлит Pt(Sn,Bi), звягинцевит (Pd,Pt)3(Pb,Sn), таймырит (Pd,Cu,Pt)3Sn и другие.
Приведённые формы нахождения олова и других элементов встречаются в различных геологических образованиях:
- Группа интрузивных и эффузивных магматических пород: траппы, пикриты Сибирской платформы, гипербазиты и габброиды Камчатки, кимберлиты Якутии, лампроитыАлдана и т. д.; гранитоиды Приморья, Дальнего Востока, Тянь-Шаня.
- Группа метасоматически и гидротермально изменённых пород: медно-никелевые руды Сибирской платформы, золоторудные объекты Урала, Кавказа, Узбекистана и т. д..
- Группа современного рудообразования: пелагические осадки Тихого океана, продукты Большого Трещинного Толбачинского извержения, гидротермальная система Узон на Камчатке и пр.
- Группа осадочных пород различного происхождения.
Происхождение названия
Латинское название stannum
, связанное с санскритским словом, означающим «стойкий, прочный», первоначально относилось к сплаву свинца и серебра, а позднее к другому, имитирующему его сплаву, содержащему около 67 % олова; к IV веку этим словом стали называть собственно олово.
Слово олово
— общеславянское, имеющее соответствия в балтийских языках (ср. лит.
alavas
,
alvas
— «олово», прусск.
alwis
— «свинец»). Оно является суффиксальным образованием от корня
ol-
(ср. древневерхненемецкое
elo
— «жёлтый», лат.
albus
— «белый» и пр.), так что металл назван по цвету.
Добыча
Мировые месторождения касситерита разрабатывают в Юго-Восточной Азии, в основном в Китае, Индонезии, Малайзии и Таиланде. Другие важные месторождения касситерита находятся в Южной Америке (Боливии, Перу, Бразилии) и Австралии. В России запасы оловянных руд расположены в Чукотском автономном округе (рудник/посёлок Валькумей, разработка месторождения закрыта в начале 90-х годов), в Приморском крае (Кавалеровский район), в Хабаровском крае (Солнечный район, Верхнебуреинский район (Правоурмийское месторождение)), в Якутии (месторождение Депутатское) и других районах.
Преимущества и недостатки олова
К преимуществам отлова относятся:
- Пластичность. Из олова изготавливают сложные изделия для украшения интерьера.
- Инертность. Металл применяется в пищевой промышленности для изготовления посуды, тар для хранения продуктов.
- Низкая температура плавления. Олово используется для нанесения на металлические детали в виде защитного покрытия.
Недостатки:
- Низкий показатель прочности. Сплав не подходит для изготовления деталей, которые будут подвергаться большим нагрузкам.
- Редкость. Из-за этого увеличивается цена на материал.
Касситеритстатья: Касситерит
Касситерит
(от греч. kassiteros — олово) — главный рудный минерал для получения олова. Теоретически содержит 78,62 % Sn. Образует отдельные выделения, зерна, сплошные массивные агрегаты, в которых зерна минерала достигают в размере 3 — 4 мм и даже больше.
- Плотность 6040-7120 кг/м³ (наиболее низкая у светлоокрашенных касситеритов).
- Твердость 6½.
- Блеск — матовый, на гранях — алмазный.
- Спайность несовершенная.
- Излом раковистый.
Основные формы выделения касситерита:
- микровключения в других минералах;
- акцессорные выделения минерала в породах и рудах;
- сплошные или вкрапленные руды: игольчатые радиально-лучистые агрегаты (Приморье), коломорфные и криптокристаллические выделения и скопления (Приморье); кристаллическая форма — главная форма выделения касситерита. В России месторождения касситерита имеются на Северо-Востоке, в Приморье, Якутии, Забайкалье; за рубежом — в Малайзии, Таиланде, Индонезии, КНР, Боливии, Нигерии и др.
Оловянная чума
При температуре ниже 13,2 °C происходит увеличение удельного объёма чистого олова на 25,6 %, и металл образует новую модификацию, обладающую полупроводниковыми свойствами , — серое олово (α-Sn), в кристаллической решётке которого атомы располагаются менее плотно. Одна модификация переходит в другую тем быстрее, чем ниже температура окружающей среды. При −33 °C скорость превращений становится максимальной. Олово трескается и превращается в порошок. Причём соприкосновение серого олова и белого приводит к «заражению» последнего. Совокупность этих явлений называется «оловянной чумой». Начало научного изучения этого фазового перехода было положено в 1870 г. работами петербургского учёного Ю. Фрицше. Установлено, что это есть процесс аллотропического превращения белого олова в серое со структурой типа алмаза. Много ценных наблюдений и мыслей об этом процессе высказано Д. И. Менделеевым в его «Основах химии».
Белое олово — серебристо-белый, блестящий металл со специфической тетрагональной структурой и электронным s2p2-состоянием — β-фазой. Серое олово — ковалентный кристалл со структурой алмаза и электронным sp3-состоянием — α-фазой. Фазовые переходы олова из белого в серое и обратно сопровождаются перестройкой электронной структуры и сильным (26,6 %) объёмным эффектом. Белое олово можно переохладить до гелиевых температур (температура фазового α-β-равновесия около +13,2 °C).
В литературе встречаются указания на то, что олово, попавшее в пробирку, где когда-то находилось способное инфицировать вещество, «заражается»! Показано экспериментально, что если на несколько суток (даже при комнатной температуре) положить на стекло кристалл InSb, то после его удаления «память» о его пребывании там сохраняется. Это стекло «заражает» образец белого олова. Но не сразу, а по прошествии нескольких дней. И не со 100 % вероятностью. С повышением температуры стекла резко возрастает «инкубационный период» и падает вероятность «заражения». Выдержка затравки на стекле при 100 °C полностью устраняет возможность «заражения». Промывание пластины водой, спиртом и другими поглощающими воду веществами также «стирает» эту «память». Потеря «памяти» происходит и в том случае, если затравка находилась в контакте со стеклом в вакууме или в сухом эксикаторе. Существует ещё одно замечательное явление, характерное для «оловянной чумы», — это «память» белого олова о том, что оно когда-то прежде переходило в серое. Ю. Фрицше ещё в 1870 г. заметил, что белое олово, полученное путём нагрева из серого, при повторном охлаждении переходит в серое значительно легче, чем при первом. Образец как бы «вспоминает» свою предысторию, в связи с чем это явление, теперь широко известное, обычно называют «памятью». Коэн к одному из признаков «оловянной чумы» отнёс «порчу» олова после «выздоровления».
Одним из средств предотвращения «оловянной чумы» является добавление в олово стабилизатора, например висмута.
Любопытные факты:
- «Оловянная чума»— одна из причин гибели экспедиции Скотта к Южному полюсу в 1912 г. Она осталась без горючего из-за того, что оно просочилось через запаянные оловом баки, поражённые «оловянной чумой», названной так в 1911 г. Г. Коэном.
- Отдельные историки указывают на «оловянную чуму» как на одно из обстоятельств поражения армии Наполеона в России в 1812 г. — сильные морозы привели к превращению оловянных пуговиц на мундирах солдат в порошок.
- «Оловянная чума» погубила многие ценнейшие коллекции оловянных солдатиков. Например, в запасниках питерского музея Александра Суворова превратились в труху десятки фигурок — в подвале, где они хранились, лопнули зимой батареи отопления.
История
Олово было известно человеку уже в IV тысячелетии до н. э. Этот металл был малодоступен и дорог, так как изделия из него редко встречаются среди римских и греческих древностей. Об олове есть упоминания в Библии, Четвёртой Книге Моисеевой. Олово является (наряду с медью) одним из компонентов бронзы (см. История меди и бронзы), изобретённой в конце или середине III тысячелетия до н. э.. Поскольку бронза являлась наиболее прочным из известных в то время металлов и сплавов, олово было «стратегическим металлом» в течение всего «бронзового века», более 2000 лет (очень приблизительно: 35—11 века до н. э.).