Электрохимическая защита – эффективный способ защиты готовых изделий от электрохимической коррозии. В некоторых случаях невозможно возобновить лакокрасочное покрытие или же защитный оберточный материал, тогда целесообразно использовать электрохимическую защиту. Покрытие подземного трубопровода или же днища морского суда очень трудоемко и дорого возобновлять, иногда просто невозможно. Электрохимическая защита надежно защищает изделие от коррозии, предупреждая разрушение подземных трубопроводов, днищ судов, различных резервуаров и т.п.
Применяется электрохимическая защита в тех случаях, когда потенциал свободной коррозии находится в области интенсивного растворения основного металла либо перепассивации. Т.е. когда идет интенсивное разрушение металлоконструкции.
Основные разновидности
При коррозии в электролитах происходит преобразование химической энергии в электрическую. В связи с этим ее называют электрохимической. Принято различать следующие виды электрохимической коррозии.
Межкристаллитная
Под межкристаллитной коррозией подразумевается такое опасное явление, при котором происходит разрушение границ зерна никеля, алюминия и других металлов избирательным образом. Как следствие, прочностные и пластичные свойства материала утрачиваются. Главная опасность этой разновидности коррозии в том, что далеко не всегда она заметна визуально.
Питтинговая
Питтинговая электрохимическая коррозия представляет собой точечное поражение отдельных участков поверхности меди и других металлов. В зависимости от характера поражения, различают закрытый, открытый, а также поверхностный питтинг. Размеры пораженных участков могут варьироваться от 0,1 мм до 1,5 мм.
Щелевая
Щелевой электрохимической коррозией принято называть усиленный процесс разрушения металлических конструкций в местах расположения щелей, зазоров и трещин. Протекание щелевой коррозии может происходить в воздушной атмосфере, газовых смесях, а также морской воде. Данный вид разрушения характерен для газопроводов, днищ морских судов и многих других объектов.
Распространено протекание коррозии в условиях небольшого количества окислителя из-за затрудненного подхода к стенкам щели. Это приводит к накоплению коррозийных продуктов внутри зазоров. Электролит, содержащийся во внутреннем пространстве зазора, может изменяться под воздействием гидролиза продуктов коррозии.
С целью защиты металлов от щелевой коррозии принято применять несколько методов:
- уплотнение зазоров и щелей;
- электрохимическая защита;
- процесс ингибирования.
В качестве профилактических методов следует использовать только те материалы, которые в наименьшей степени подвержены возникновению ржавчины, а также изначально грамотно и рационально конструировать газопроводы и другие важные объекты.
Грамотная профилактика во многих случаях представляет собой более простой процесс, чем последующая очистка металлоконструкций от въевшейся ржавчины.
Катодная защита от коррозии для движущегося автомобиля
Теперь давайте разберём, как своими руками защитить таким способом от коррозии движущуюся машину. Как и в описанном выше способе, авто выступает в роли катода. В качестве анода мы можем использовать заземляющийся«хвост» из резины или защитные электроды.
«Хвост» — это самый простой метод профилактики возникновения ржавчины. Это полоска резины с прикреплёнными металлизированными элементами. Он крепится на задней части транспортного средства таким образом, чтобы свисать и создавать разницу потенциалов между машиной и мокрым покрытием дороги.
С увеличением влажности автоматически возрастает эффективность защиты от окисления. На него попадают брызги из-под колёс машины, что служит на пользу для протекания электрохимического процесса. Дополнительным плюсом «хвоста» является удаление статического напряжения. Например, транспорт с огнеопасным грузом использует даже такое средство, как металлические цепи, которые волочатся по дороге — таким образом происходит удаление статического заряда, по причине которого может возникнуть искра и спровоцировать возгорание.
Заземляющий “хвост” из резины
Использование защитных электродов годится как для движущихся машин, так и для неподвижного транспорта. Для создания эффективной системы нужно поставить на авто около 15—20 элементов. Это круглые или квадратные пластинки размером от 4 до 10 квадратных сантиметров. Для их изготовления годятся алюминий, нержавейка, магнетит, графит, платина. Алюминий и нержавейка со временем разрушаются — их нужно будет менять через каждые 4 года.
Такие элементы имеют следующие свойства:
- действуют в радиусе до 0,35 м;
- ставятся лишь на окрашенные участки машины;
- крепятся при помощи эпоксидного клея или шпатлёвки;
- перед монтажом необходима зачистка;
- наружная сторона не покрывается никакими изолирующими материалами;
- необходима изоляция электродов от отрицательно заряженного кузова авто
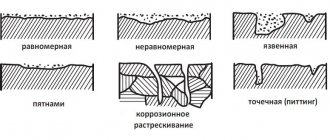
Как проявляется коррозия разных видов
В качестве примера протекания коррозийного процесса можно привести разрушение различных приборов, компонентов автомобилей, а также любых конструкций, произведенных из металла и расположенных:
- в атмосферном воздухе;
- в водах – моря, реки, содержащиеся в почве и под слоями грунта;
- в технических средах и т.д.
В процессе ржавления металл становится многоэлектронным гальваническим элементом. Так, например, если в электролитической среде происходит контакт меди и железа, медь является катодом, а железо – анодом. Отдавая электроны меди, железо в виде ионов попадает в раствор. Ионы водорода начинают двигаться по направлению к меди и там разряжаются. Становясь все более и более отрицательным, катод вскоре приравнивается к потенциалу анода, в результате чего коррозийный процесс начинает замедляться.
Разные виды коррозии проявляются по-разному. Более интенсивно электрохимическая коррозия проявляется в тех случаях, когда в катоде присутствуют вкрапления металла с меньшей активностью по сравнению с корродирующим – на них ржавчина появляется быстрее и является довольно выразительной.
Протекание атмосферной коррозии происходит в условиях влажного воздуха и обычной температуры. В данном случае на поверхности металла образуется пленочка из влаги с растворенным кислородом. Процесс разрушения металла становится интенсивнее по мере увеличения влажности воздуха и содержания газообразных оксидов углерода и серы при условии наличия:
- трещин;
- шероховатостей;
- других факторов, провоцирующих облегчения процесса конденсации.
Почвенная коррозия в наибольшей степени поражает разнообразные подземные сооружения, газопроводы, кабели и другие конструкции. Разрушение меди и других металлов происходит по причине их тесного соприкосновения с почвенной влагой, в составе которой также присутствует растворенный кислород. Разрушение трубопроводов может произойти уже спустя полгода с момента их строительства в том случае, если для почвы, в которой они установлены, характерна повышенная кислотность.
Под воздействием блуждающих токов, исходящих от посторонних объектов, возникает электрическая коррозия. Ее главными источниками являются электрические железные дороги, линии электропередач, а также специальные установки, функционирующие на постоянном электротоке. В большей степени данный вид коррозии провоцирует разрушение:
- газопроводов;
- всевозможных сооружений (мосты, ангары);
- электрокабелей;
- нефтепроводов.
Действие тока провоцирует возникновение участков входа и выхода электронов – то есть, катодов и анодов. Наиболее интенсивным разрушительный процесс является именно на участках с анодами, поэтому на них ржавчина более заметна.
Коррозия отдельных компонентов газопроводов и водяных трубопроводов может быть вызвана тем, что процесс их инсталляции является смешанным, то есть, происходит с использованием различных материалов. Наиболее частыми примерами является точечная коррозия, возникающая в элементах из меди, а также коррозия биметаллов.
При смешанной установке железных элементов со сплавами меди и цинка, процесс коррозии отличается меньшей степенью критичности, чем при медном литье, то есть со сплавами меди, цинка и олова. Предотвратить коррозию трубопроводов можно, используя специальные методы.
Методики предупреждения коррозии.
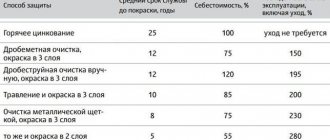
Оцинковка.
Данный вид защиты, использует немалая часть производителей авто. На производстве, поверхность машины покрывают плавленным цинком. При достаточном слое цинка, методика является весьма эффективной. При нарушении металлической структуры, изначально разрушается цинковая поверхность. Этот способ профилактики, защищает авто от воздействия неблагоприятных химикатов.
Полимерная защита.
Пленка, не имеющая цвета, позволяет предотвратить появление ржавчина на поверхности машины. Данный вид защиты, является наиболее удобным и действенным. Пленка предоставляется на клейкой поверхности и легко крепиться на структуру металла. Благодаря отсутствию цвета, пленка пользуется большой популярностью. Используя данный материал, легко защитить пораженную часть автомобиля от нежелательных воздействий.
Ламинирование кузова
защита от коррозии кузова
Уберечь кузов автомобиля от абразивного износа и преждевременной коррозии можно, используя специальную полимерную пленку, которая являет собой клеящийся прозрачный материал. Ламинирование во многих случаях намного практичнее и удобнее, чем иные виды защиты: Ламинирование, часто используют для частичной защиты авто (двери, капот). Процесс нанесения пленки достаточно прост и не потребует много времени. Материал, устойчив к температурному воздействия и надежно фиксируется на поверхности. Благодаря данной методике, можно долгое время сохранять первоначальный вид авто. Данный вид защиты, часто используется перед продажей авто с небольшим пробегом. Пленка надежно защищает поверхность от появления царапин. Часть дилеров, так же используют ламинирование, для сбережения автомобиля при транспортировке.
Катодная защита.
Данная методика, предполагает использование специального устройства. Прибор, поляризует металл, создавая защитный слой. На поверхности кузова, скапливается минусовой заряд, предупреждающий ржавчину. Методика действенна определенный период. При разрушении поляризации поверхности, необходимо повторять процедуру. По этому, катодная защита, работает некоторое время. Данный метод, используется в труднодоступных местах кузова. Некоторые производители, применяют ее в области дна авто, порогов и дверей.
Барьер — защита.
Используя пластиковые элементы защиты (например — в области колес автомобиля), можно предотвратить попадание разрушающих частиц на кузов машины. Преграда, блокирует вылетающие, из под колес частицы песка и камней. Тем самым, лако красочная поверхность сохраняет свою структуру дольше. На сегодняшний день, данная защита, часто устанавливается производителем. Так же, имеется специальная (пластиковая) защита для донной части авто. Некоторые производители, используют барьеры в области стоек и других частей транспортного средства.
Грунтовка.
Один из наиболее популярный видов предупреждения ржавчины — нанесение слоя грунта. Небольшой слой грунта, наноситься между металлом и краской. Данный слой, исключает попадание влаги на металл. Защита, так же, действенна некоторое время. Предотвратить ржавчину полностью она не способна, но существенно замедляет процесс разрушения поверхности.
Защищающая краска.
защита днища
Определенное покрытие, способно не только украсить, но и защитить автомобиль. Лакокрасочное покрытие, одно из наиболее уязвимых. Во время эксплуатации автомобиля, краска постоянно разрушается
При выборе краски, необходимо обратить внимание на определенные ее параметры
Основные требования к ЛКП:
— Высокая прочность покрытия. — Стойкость к стиранию. — Совместимость с грунтом. — Безопасность для здоровья человека (малая токсичность). — Устойчивость к термическому перепаду. Фосфатная защита.
Устойчивость к ржавчине, значительно возрастает при применении фосфатной грунтовки. Данный грунт, включает в себя ряд химических элементов. Совокупность элементов, образуют тонкую защитную поверхность. В данном случае, воздействие внешних факторов, наносит меньший урон металлическому покрытию и делает его более устойчивым.
Коррозия автомобиля, сложна в устранении. Гораздо проще провести профилактику, чем бороться с появившейся ржавчиной. Выбор метода защиты, личное дело каждого автомобилиста. Не стоит экономить на защите кузова автомобиля. Ремонт и восстановление пораженного участка стоит достаточно дорого. Предотвратить нарушение структуры кузова и дорогостоящий ремонт, можно с помощью защитно слоя. Таким образом, вы значительно увеличите срок службы кузовной части авто. Не допускайте появления коррозии, а предотвращайте ее появления. Защитив свой автомобиль, вы останетесь уверенны в сохранении его внешнего вида.
Способы защиты от ржавления
Для борьбы с коварной ржавчиной применяются различные методы. Рассмотрим те из них, который являются наиболее эффективными.
Способ №1
Один из самых популярных методов – это электрохимическая защита чугуна, стали, титана, меди и других металлов. На чем же она основывается?
Электрохимическая обработка металлов представляет собой особый способ, направленный на изменение формы, размеров и шероховатости поверхности путем анодного растворения в электролите под воздействием электротока.
Чтобы обеспечить надежную защиту от ржавчины, необходимо еще перед началом эксплуатации металлических изделий обрабатывать их особым средствами, которые в своем составе содержат различные компоненты органического и неорганического происхождения. Данный метод позволяет предотвратить появление ржавчины на определенное время, однако позже придется обновлять покрытие.
Схема катодной защиты трубопроводов
Электрозащита представляет собой процесс, при котором металлическая конструкция подключается к внешнему источнику постоянного электрического тока. В результате этого на ее поверхности формируется поляризация электродов катодного типа, и все анодные области начинают преобразовываться в катодные.
Электрохимическая обработка металлов может происходить с участием анода или катода. В некоторых случаях происходит попеременная обработка металлического изделия обоими электродами.
Катодная защита от коррозии необходима в тех ситуациях, когда у металла, подлежащего защите, не наблюдается предрасположенность к пассивации. К металлическому изделию подключается источник внешнего тока – специальная станция катодной защиты. Данный метод подходит для защиты газопроводов, а также трубопроводов водоснабжения и отопления. Однако есть у этого метода определенные недостатки в виде растрескивания и разрушения защитных покрытий – это происходит в случаях значительного смещения потенциала объекта в отрицательную сторону.
Способ №2
Электроискровая обработка металлов может осуществляться при помощи установок различных типов – бесконтактной, контактной, а также анодно-механической.
Способ №3
Для надежной защиты газопроводов и других трубопроводов от ржавчины часто применяется такой метод, как электродуговое напыление. Преимущества данного способа очевидны:
- значительная толщина защитного слоя;
- высокий уровень производительности и надежности;
- применение относительно недорогого оборудования;
- несложный технологический процесс;
- возможность применения автоматизированных линий;
- невысокие энергетические затраты.
Среди недостатков данного метода – невысокая эффективность при обработке конструкций в коррозийных средах, а также недостаточная прочность сцепления со стальной основой в некоторых случаях. В любых других ситуациях такая электрозащита очень эффективна.
Способ №4
Для защиты разнообразных металлических конструкций – газопроводов, мостовых сооружений, всевозможных трубопроводов – требуется эффективная антикоррозийная обработка.
Данная процедура осуществляется в несколько этапов:
- тщательное удаление жировых отложений и масел с применением эффективных растворителей;
- очистка обрабатываемой поверхности от солей, растворимых в воде, – выполняется при помощи профессиональных аппаратов высокого давления;
- удаление имеющихся конструкционных погрешностей, выравнивание кромок – это необходимо для предотвращения сколов наносимого лакокрасочного покрытия;
- тщательная очистка поверхности при помощи пескоструйного аппарата – это делается не только для удаления ржавчины, но и для придания нужной степени шероховатости;
- нанесение противокоррозийного материала и дополнительного защитного слоя.
Правильная предварительная обработка газопроводов и всевозможных металлоконструкций обеспечит им надежную защиту от электрохимической коррозии в процессе эксплуатации.
Катодная защита от коррозии своими руками для авто в гараже
Для автомобиля, который неподвижно хранится в гараже, организовать своими руками электрохимический заслон очень просто. Как уже говорилось выше, в качестве катода выступает сама машина. Анодом может быть назначено само здание гаража, если он сделан из металла. Либо это может быть заземляющий контур, если гараж неметаллический, или машина стоит на стоянке. Металлический пол или открытые участки из металла снизу будут препятствовать появлению ржавчины на днище машины.
Заземляющий контур создаётся таким образом — вокруг машины забиваем в землю 4 металлических штыря. Их длина должна быть не менее 1 метра. Натягиваем вокруг этих штырей металлическую проволоку. Контур готов — в отличие от металлического здания он будет взаимодействовать только с днищем вашего авто.
Подключение контура или гаража выполняем через резистор — коммутируем его с положительным разъёмом автомобильного аккумулятора.
Подключаем контур через резистор к аккумулятору
Электрохимическая коррозия металлов и сплавов
| Предмет: | Химия |
| Тип работы: | Курсовая работа |
| Язык: | Русский |
| Дата добавления: | 17.05.2019 |
- Данный тип работы не является научным трудом, не является готовой выпускной квалификационной работой!
- Данный тип работы представляет собой готовый результат обработки, структурирования и форматирования собранной информации, предназначенной для использования в качестве источника материала для самостоятельной подготовки учебной работы.
Если вам тяжело разобраться в данной теме напишите мне в whatsapp разберём вашу тему, согласуем сроки и я вам помогу!
По этой ссылке вы сможете найти много готовых курсовых работ по химии:
| Много готовых курсовых работ по химии |
Посмотрите похожие темы возможно они вам могут быть полезны:
| Химическая коррозия. Жидкостная и газовая коррозия |
| Атмосферная коррозия металлов и способы защиты от атмосферной коррозии |
| Анодные и катодные покрытия. Катодная и анодная защита |
| Основные классы неорганических соединений |
Введение:
Для электрохимической коррозии металл должен находиться в контакте с раствором электролита. В водной среде механизм процесса электрохимической коррозии аналогичен механизму аккумуляторной батареи фонарика. Такой элемент состоит из двух электродов: углеродного — катодного и цинкового — анода, разделенных электролитом. Электрическая энергия генерируется химическими реакциями, которые происходят на каждом электроде. На катоде — химическое восстановление, а на аноде — окисление, при этом цинк превращается в ионы Zn2 +. Чтобы такие процессы продолжались и гальванический элемент работал, необходимо замкнуть цепь. Однако растворение цинка также возможно в разомкнутой цепи, в этом случае роль катода играют мельчайшие примеси в цинке. Такие элементы называются микрокоррозионными. Они играют главную роль в процессе электрохимической коррозии.
Поверхность любого металла состоит из микроэлектродов, короткозамкнутых через сам металл. Микрокоррозионные элементы начинают функционировать, когда металл вступает в контакт с электролитом, что в конечном итоге приводит к коррозийному разрушению металла. Таким образом, коррозийный процесс происходит и протекает в результате работы многих короткозамкнутых гальванических микроэлементов. Причины образования микропар очень разнообразны: неоднородность металлической фазы, жидкой фазы и физические условия. Среди причин неоднородности металлической фазы следует отметить неоднородность самого металла, состав защитных пленок на металле и внутренние напряжения в металле.
Электрохимическое растворение металла представляет собой сложный процесс, состоящий из двух основных процессов:
- Анодный процесс — это процесс перехода ионов металла в раствор, оставляющий на поверхности металла соответствующее количество электронов:
- Катодный процесс — это ассимиляция избыточных электронов атомами или молекулами электролита (деполяризаторы), которые затем восстанавливаются.
Таким образом, электрохимическая коррозия на неоднородной (гетерогенной) металлической поверхности аналогична работе короткозамкнутой гальванической ячейки.
Когда два обратимых электрода с разными потенциалами закрыты в электролите, электроны перетекают от более отрицательного электрода (анода) к менее отрицательному (или более положительному) электроду (катоду). Этот поток электронов уравнивает потенциальные значения замкнутых электродов. Если в этом случае электродные процессы (анод на аноде и катод на катоде) не будут продолжаться, потенциалы электродов будут выровнены, и произойдет полная поляризация. Фактически, анодный и катодный электродные процессы продолжаются, предотвращая наступление полной поляризации из-за потока электронов от анода к катоду, то есть действуют деполяризующие. Отсюда, в частности, и название ионов и молекул раствора, обеспечивающих протекание катодного процесса, — деполяризаторы. Однако из-за отставания электродных процессов от потока электронов в гальваническом элементе потенциалы электродов меняются (сближаются) и короткозамкнутая система, в конечном счете, полностью поляризована
Особенности процесса электрохимической коррозии:
- его подразделение на два одновременно происходящих, но в значительной степени независимых электродных процесса: анодный и катодный;
- зависимость кинетики этих двух электрохимических процессов и, следовательно, скорости коррозии в соответствии с законами электрохимической кинетики от величины потенциала металлического электрода: сдвиг потенциала металла в положительном направлении (например, в результате поляризации от внешнего источника тока) обычно облегчает анодный процесс и усложняет катод; смещение потенциала в отрицательную сторону, наоборот, ускоряет катодный процесс и замедляет анодный;
- возможность локализации электродных процессов в разных областях поверхности агрессивного металла, где облегчается их протекание;
- при локализации электродных процессов материальный эффект коррозии (растворение металла) реализуется в основном на анодных участках коррозионной поверхности металла.
Поляризация, деполяризация. Коррозия металлов с водородной деполяризацией. Коррозия металлов с кислородной деполяризацией
Некоторые металлы, например магний, алюминий, термодинамически нестабильны с термодинамической точки зрения; на практике при определенных условиях они подвергаются коррозии медленно и могут использоваться в качестве конструкционных материалов. Чтобы правильно оценить влияние различных факторов на скорость коррозии, необходимо иметь данные о состоянии равновесия системы и учитывать тот факт, что при прохождении тока через электрод его состояние равновесия нарушается. Поток электрического тока при работе коррозийного микроэлемента обусловлен начальной разностью потенциалов между катодом и анодом, потенциал этого электрода меняется в зависимости от величины и направления внешнего тока.
Значение коррозионного тока после замыкания цепи быстро падает и через определенное время становится постоянным. Поскольку значение омического сопротивления в этом случае невелико и постоянно, уменьшение силы тока коррозии можно объяснить только смешением начальных значений потенциалов, то есть уменьшением их разности. (инжир.). Такое изменение потенциалов в результате протекания тока называется поляризацией, а вещества, уменьшающие поляризацию, называются деполяризаторами. Уменьшение поляризуемости электродов называется деполяризацией.
Анодная поляризация. Существует три основных случая, в зависимости от причин анодной поляризации.
Концентрационная поляризация. Этот тип анодной поляризации обусловлен низкой скоростью диффузии ионов металлов в растворе электролита, что приводит к увеличению концентрации ионов в анодной зоне.
Перенапряжение ионизации металла
Если во время анодного процесса высвобождение ионов металлов в раствор не идет в ногу с удалением электронов, потенциал металла сдвигается в положительном направлении.
Анодная пассивность, заключающаяся в образовании пассивных пленок на поверхности металла. Анодный процесс резко тормозится из-за возникновения явления анодной пассивности. Это может объяснить довольно высокую коррозионную стойкость алюминия и нержавеющих сталей в растворах азотной кислоты. Защитные пленки на аноде могут образовываться в результате осаждения плохо растворимых соединений этого металла на поверхности металла.
Катодная поляризация. Эта поляризация обусловлена перенапряжением катодной реакции, то есть замедлением D + ne- <-> Dne-процесса; концентрационная поляризация, то есть недостаточная скорость подачи или удаления начальных или конечных продуктов реакции на катоде.
Возможны следующие основные типы катодной деполяризации:
- деполяризация ионами;
- разрядка катионов
- восстановление нейтральных молекул:
Коррозия металлов с водородной деполяризацией. Наиболее частыми случаями коррозии на практике являются процессы, происходящие в растворах неокисляющих кислот с выделением водорода — деполяризация водорода или в нейтральных солевых растворах. Иногда оба эти процесса могут выполняться параллельно.
Деполяризация водорода термодинамически возможна в тех случаях, когда равновесный потенциал металла является более отрицательным, чем водородный, при данных условиях.
Процесс разряда ионов водорода на катоде представлен в виде схемы, состоящей из нескольких этапов:
- Диффузия и миграция гидратированных ионов водорода на катод: Н + Н2О = (Н3О) +
- Обезвоживание ионов водорода: (Н3О) + -> Н + + Н2О
- Включение иона водорода в двойной слой
- Разряд водородных ионов: H + + e- -> H
- Рекомбинация атомов водорода в молекулу: H + H = H2
- Образование и отрыв пузырьков от молекул водорода с поверхности катода.
Коррозия металлов с кислородной деполяризацией. Если отсутствуют условия для коррозионного процесса с деполяризацией водорода или в присутствии кислорода в растворе, то процесс восстановления (ионизации) кислорода на катоде, то есть процесс деполяризации кислорода, играет основную роль как деполяризующая реакция.
Термодинамическая возможность процесса деполяризации кислорода: равновесный потенциал металла является более отрицательным, чем равновесный потенциал кислородного электрода в данных условиях.
Процесс деполяризации кислорода протекает в несколько этапов, как и любая электрохимическая гетерогенная реакция.
Методы защиты от коррозии
В зависимости от характера коррозии и условий ее возникновения используются различные методы защиты. Выбор того или иного метода определяется его эффективностью в данном конкретном случае, а также его экономической целесообразностью. Любой метод защиты изменяет ход процесса коррозии, либо снижая скорость, либо полностью ее останавливая.
Защитные покрытия
Большинство металлов и сплавов, как правило, нестабильны в окружающей среде, где они используются. Отдельные металлы, например алюминий, сами защищают от коррозии в некоторых средах в результате образования защитных пленок на их поверхности при взаимодействии с окружающей средой. С помощью защитных покрытий можно изолировать металл от агрессивной среды путем искусственного нанесения пленки на поверхность изделия или, изменяя химический состав поверхности, для придания металлу устойчивости к агрессивной среде. Защитное покрытие должно быть сплошным, непроницаемым для агрессивной среды, иметь высокую адгезию к металлу, равномерно распределяться по всей поверхности и придавать изделию более высокую твердость, износостойкость и жаростойкость. Защитные покрытия также используются для предотвращения механического износа изделий и восстановления размеров деталей машин, а также для защитно-декоративной отделки.
Защитные покрытия делятся на металлические и неметаллические, а также покрытия, полученные путем химической и электрохимической обработки металлических поверхностей.
Металлические покрытия и способы их нанесения
Металлические покрытия на изделиях из металлических или неметаллических (стекло, керамика, пластмассы и т. д.) Материалов наносятся для защиты от коррозии, повышения твердости, электропроводности и придания им красивого внешнего вида. Покрытия наносятся электрохимическим осаждением (гальванический метод), термомеханическим (плакирование), напылением (металлизация) и погружением в расплавленный металл (горячий метод).
По характеру защитного эффекта от коррозии металлические покрытия делятся на катодные и анодные. Катодные покрытия включают покрытия, в которых покрывающий металл имеет более положительный потенциал электрода, чем металл защищаемого изделия, например сталь, покрытая оловом или медью. Если целостность катодного покрытия нарушается, он перестает защищать изделие от коррозии, кроме того, наличие такого металла на поверхности изделия усиливает его коррозию. Анодными покрытиями являются те, в которых металл покрытия имеет больший потенциал отрицательного электрода в данной среде, чем защищенный, например, когда сталь покрыта цинком.
Анодное покрытие защищает основной металл, когда его целостность разрушается, только подвергаясь самому разрушению. Следовательно, требования к герметичности при нанесении анодного покрытия не очень важны, в то время как катодное покрытие должно быть сплошным и непроницаемым для агрессивной среды.
Гальванический метод. Гальванические покрытия широко используются в машиностроении, поскольку их нанесение на изделия обеспечивает долговечные покрытия при низких затратах и потерях металла. Процесс получения гальванического покрытия состоит в отделении и осаждении металла или сплава от водных растворов их солей путем пропускания постоянного электрического тока через электролит. Покрытый продукт в электролизере служит катодом, а анод служит осажденным металлом (растворимые аноды), графитом или металлом, нерастворимым в электролите (нерастворимые аноды). В качестве электролита используются соли этих металлов, металл которых наносится на поверхность защищаемого продукта.
Гальваника может наноситься на изделие толщиной от микрона до нескольких миллиметров. Покрытия очень чистые и равномерно распределены по всей защищаемой поверхности. Метод гальванического покрытия имеет ряд преимуществ перед другими методами и, в частности, отличается простотой контроля толщины покрытия, низким расходом металла, не требует нагрева электролита, обеспечивает осаждение как металлов, так и сплавов, но покрытие, полученное путем этот метод пористый.
Цинкование изделий из чугуна и стали широко применяется на практике. Это объясняется тем, что цинк по отношению к стали в водных растворах служит анодом (анодным покрытием), поэтому при электрохимической коррозии он растворяется и защищает продукт от разрушения. Цинк устойчив к атмосферной коррозии. Толщина покрытий различна и составляет от 3 до 50 мкм.
Кадмий наносится почти исключительно гальваническим способом. Применяется для защиты деталей стального оборудования от коррозии в морской воде, во влажном воздухе, в растворах некоторых солей и щелочей. Толщина кадмиевого покрытия зависит от условий эксплуатации и составляет от 9 до 15 мкм для нормальных условий и до 45 мкм для деталей, подвергающихся воздействию морской и горячей воды.
Олово устойчиво к влажному воздуху и слабым органическим кислотам. По отношению к железу олово является катодным покрытием, поэтому оно защищает стальные изделия от коррозии механически в отсутствие пор. Толщина покрытий колеблется от 1,5 до 20 мкм.
Свинец является химически стойким элементом. Устойчив к серной кислоте (до 75%), растворам ее солей, серосодержащим газам, слабой соляной кислоте. Толщина покрытия колеблется от 30 до 200 мкм.
Медь не устойчива к атмосферной коррозии, так как она легко вступает в реакцию с водяным паром, с окисью углерода (IV) в воздухе, с серосодержащими газами и другими средами. Поэтому он не используется для защиты стали от коррозии, но широко используется для получения многослойных защитных и декоративных покрытий в качестве промежуточного слоя, например, медь-никель-хром. Кроме того, медь используется для улучшения пайки и повышения электропроводности изделий. Толщина медных покрытий составляет 5-30 мкм и более.
Никель в основном используется в качестве защитного и декоративного покрытия, но он способен защищать стальные изделия от коррозии при условии, что полученные пленки являются пористыми. Никелевые покрытия обладают высокой твердостью и износостойкостью. Они устойчивы к действию растворов щелочей, органических кислот, но разрушаются минеральными кислотами и растворами, содержащими аммиак. Толщина покрытий колеблется от 3 до 40 мкм.
Хромированные изделия имеют высокую твердость поверхности, износостойкость, термостойкость и химическую стойкость. Они устойчивы в концентрированной азотной кислоте, щелочных растворах, органических кислотах, сероводороде, растворах многих солей. Хромированные покрытия используются в защитных и декоративных целях, при производстве зеркал, отражателей, прожекторов, для повышения износостойкости изделий и для восстановления размеров деталей. Толщина покрытий в зависимости от назначения составляет 3 — 250 мкм и более.
Серебрение в основном используется для придания деталям высокой электропроводности, для покрытия изделий, используемых в пищевой и художественной промышленности, а также во многих отраслях машиностроения. Серебро применяется для стали, меди, латуни и других материалов.
Золото используется для защиты ценного оборудования и устройств от атмосферной коррозии, в ювелирном и часовом производстве. Применяется для меди и ее сплавов, никеля, стали — после меднения — и других металлов. Изделия с гальваническим покрытием из платины, индия, германия, галлия и других металлов.
Горячий метод. Свойство металлов иметь высокую химическую активность в расплавленном состоянии легло в основу технологии нанесения металлического осадка на продукт. Высокая реакционная способность расплавленного металла в большинстве случаев приводит к образованию сплава с металлом продукта, который является хорошей связующей основой для металла, на который наносится покрытие. Для горячего металлического покрытия заготовка погружается на несколько секунд в ванну с расплавленным металлом, которая смачивает их поверхность. Для горячего покрытия используется металл с более низкой температурой плавления, чем металл, на который наносится покрытие.
Черные металлические детали покрыты свинцом, которые затем широко используются в химической промышленности. Свинцовое покрытие непористое, устойчиво ко многим электролитам и, что важно, к воздействию разбавленных растворов серной кислоты и ее солей, сернистых газов.
Цинк используется для защиты изделий из стали и чугуна от атмосферной коррозии, воды и ряда нейтральных солевых растворов. Цинк наносят на детали, погружая их на 6 — 20 секунд в расплавленный цинк или цинк с добавлением алюминия или олова при 440 — 460 ºС. Олово используется для защиты медных проводов от воздействия серы, для получения белой жести и для локальной защиты поверхности металла во время азотирования.
Алюминий применяется для изделий из железа, стали, чугуна с целью повышения устойчивости к атмосферной и газовой коррозии. Высокие защитные свойства алюминиевого покрытия связаны с наличием на поверхности однородной плотной пленки оксида алюминия, образующейся в результате окисления алюминия под воздействием атмосферного кислорода.
Используя горячий метод нанесения покрытий, невозможно получить отложения равномерной по толщине, а также защитить изделия с узкими отверстиями и резьбой от коррозии. Расход цветных металлов при использовании горячего метода велик, так как образующиеся осадки имеют большую толщину. Кроме того, этот метод позволяет наносить только металлические отложения на мелкие предметы.
Облицовочный. Это процесс защиты от коррозии основного металла или сплава другим металлом (сплавом), который устойчив к агрессивной среде. Два металла могут быть соединены вместе путем литья, прокатки и недеформированной оболочки. Наибольшее применение нашел метод совместной прокатки двух металлов, один из которых (химически стойкий) является защитным. Для облицовки используются металлы или сплавы с хорошей свариваемостью. К ним относятся углеродистые, кислотостойкие стали, дюраль, медные сплавы. В качестве облицовочных материалов используются нержавеющая сталь, алюминий, никель, титан, тантал. Толщина облицовочного слоя составляет от 3 до 60% толщины основного металла.
Метод металлической облицовки является основой для получения материала под названием металлопластик. Его получают путем скатывания или склеивания металлического листа и одного или двух полимерных листов. Металлопласт изготавливается из стали, алюминиевых и магниевых сплавов, а термопластичные полимеры используются в качестве защитного слоя от коррозии: ПВХ, полиизобутилен, полиэтилен, полипропилен и т. д. По стоимости металлопластики намного дешевле и долговечнее, чем нержавеющая сталь, и превосходят его в химической стойкости к агрессивным средам … Спрей металлизации. Это процесс нанесения защитных покрытий на поверхность изделий путем распыления расплавленного металла или другого тугоплавкого материала сжатым воздухом или инертным газом. Металлизация проводится в металлизирующем оборудовании.
Во время металлизации покрытие образуется за счет заклинивания, прилипания расплавленных частиц металла или другого материала к порам и неровным поверхностям детали. Его сила адгезии зависит от размера частиц, скорости их полета и величины их деформации при попадании на поверхность. Покрытие имеет чешуйчатую структуру и высокую пористость, что уменьшается за счет увеличения толщины покрытия, шлифования, полировки и нанесения неметаллических покрытий. Например, пористость цинкового покрытия уменьшается в 10 раз при увеличении его толщины с 0,2 до 0,4 мм.
Основными недостатками металлизации, несмотря на ее простоту, являются высокий расход металла, пористость получаемого покрытия, низкая адгезия покрытия к металлу и сложность регулирования толщины слоя покрытия.
Неметаллические покрытия
Неметаллические покрытия подразделяются на лакокрасочные, покрытия полимерными материалами, резиной, силикатными эмалями, смазками, пастами. Они используются для защиты металлических изделий, оборудования и конструкций от коррозии, изолируют детали электрических машин, защищают изделия от гниения, влаги и придают им красивый внешний вид.
Лакокрасочная. Наибольшее применение неметаллических покрытий наблюдается в лакокрасочных покрытиях. Сырьем для получения лакокрасочных покрытий являются пленкообразующие вещества, наполнители, растворители, пластификаторы, пигменты, катализаторы. Пленкообразующие вещества являются основой покрытия.
Чтобы снизить стоимость покрытия, повысить коррозионную стойкость и жаростойкость, в его состав вводятся наполнители: тальк, слюда, каолин, асбестовая пыль, лонжерон и др. Повышение твердости, термостойкости, механической прочности, гидроизоляции, придания определенный цвет путем введения пигментов в состав покрытия.
Процесс нанесения покрытия состоит из нескольких этапов:
- подготовка поверхности металла к нанесению покрытия;
- нанесение грунтовки, улучшающей адгезию покрытия к металлу;
- нанесение промежуточного слоя для выравнивания поверхности;
- нанесение одного или нескольких слоев покрытия на поверхность изделия;
- полировка покрытия для получения стойкого блеска.
Сушильные масла, лаки, краски, эмали, грунтовки, шпатлевки готовятся из красок и лаков. Лаки представляют собой растворы пленкообразующих веществ в легколетучих органических растворителях. Когда пигменты добавляются в олифы, получают масляные краски. Эмалевые краски готовятся путем введения пигментов в лаки. Для сильной адгезии продукта с покрытием используются грунтовки. Грунтовки придают покрытию антикоррозионные свойства. Устранение следов, бороздок, дефектов достигается с помощью замазки — пасты, состоящей из пигментов, наполнителей, пленкообразующих веществ.
По своему назначению лакокрасочные покрытия подразделяются на те, которые устойчивы к агрессивным средам (то есть устойчивы к атмосферной коррозии, химическим веществам, маслам, бензолу), воздействию нагревания (термостойкие) и плесени; проводящий, противообрастающий, светящийся; декоративные.
Полимерное покрытие. Для защиты от воздействия внешней среды детали, изделия, конструкции покрываются смолами — полимерами. Смолу наносят в виде расплава или суспензии кистью, окунанием, распылением. После нагревания и охлаждения на поверхности детали образуется полимерная пленка толщиной несколько миллиметров.
Гуммирование. Резиновые и эбонитовые покрытия химических устройств, трубопроводов, резервуаров, контейнеров для транспортировки и хранения химических продуктов и т. д. Называются гуммированием. В зависимости от условий технологического процесса, характера окружающей среды, типа и способа нанесения покрытия. Мягкие каучуки, содержащие от 2,0 до 4,0% серы, используются для гуммирующих устройств, подверженных ударам, ударам, внезапным колебаниям температуры или содержащих взвеси, а также для устройств, работающих при постоянной температуре, не подверженных механическим воздействиям, твердых каучуков (эбонитов), содержащих от 40 до 50% серы. Для получения плотного защитного слоя каучук и эбонит очень часто комбинируются.
Электрохимическая защита
Использование антикоррозийных материалов, а также нанесение защитных покрытий не всегда подходят для борьбы с коррозией. Окраска металлоконструкций должна периодически обновляться, что связано с большими затратами. Иногда это невозможно сделать, например, на проложенных в земле трубопроводах и кабелях, сооружениях в морской воде.
Используя электрохимическую защиту, можно предотвратить разрушение трубопроводов, корпусов судов, резервуаров и реакционных аппаратов и т. д. При электрохимической защите постоянный сильный анод (протектор или источник постоянного тока) подключается снаружи к металлическим конструкциям, которые вызывает катодную поляризацию электродов микрогальванических пар на поверхности защищаемого металла, в результате чего анодные участки металла структуры преобразуются в катодные. Это означает, что разрушится не металл конструкции, а прикрепленный анод. Электрохимическая защита подразделяется на катодную и анодную.
Катодная защита
Катодная защита широко используется как в качестве дополнительного (к изоляционному покрытию), так и в качестве самостоятельного средства для защиты от коррозии металлических конструкций подземных сооружений, газопроводов, резервуаров и т. д.
Суть катодной защиты заключается в том, что отрицательный полюс источника постоянного тока или протектора (катода) соединен с защищаемой структурой, а положительный полюс источника тока соединен с металлической или графитовой пластиной (анодом). Коррозионный металл можно рассматривать как короткозамкнутую многоэлектродную ячейку. Переход ионов металлов из анодных секций в раствор и электронов из анодных секций в катодные секции, восстановление деполяризаторов на катоде вызывают появление электрического тока и, как следствие, коррозию металла. Поэтому, подключив отрицательный полюс источника тока к защищенному продукту, мы превращаем его в катод, то есть предотвращаем разрушение. При таком подключении источник постоянного тока будет разряжен, а металлическая пластина, которая является анодом, будет разрушена.
Защитная защита осуществляется путем прикрепления металлической пластины к конструкции, потенциал которой более отрицателен, чем потенциал металла конструкции. Защитная защита применяется для конструкций, работающих в солевых растворах, морской воде. Использование протекторов для защиты оборудования, работающего в водопроводной или речной воде, невыгодно из-за их низкой электропроводности, поскольку в этом случае должны быть установлены большие протекторы. В сильно агрессивных средах нецелесообразно применять такую защиту из-за быстрого разрушения протектора. При защите конструкций из стали используются чугун, протекторы из магния, цинка или сплава, содержащего 90% алюминия и 10% цинка.
Анодная защита
Ряд металлов, таких как хром, никель, титан, цирконий и железные сплавы, содержащие эти металлы, легко переходят в пассивное состояние, которое стабильно поддерживается в окислительных средах. Это свойство имеет большое практическое значение в защите от коррозии. Образование пленок на металлах приводит к отрицательному сдвигу потенциалов активного металла, что снижает скорость коррозии. Следовательно, возможно искусственное создание пассивного состояния поверхности металла за счет анодной поляризации от внешнего источника тока электрической энергии, что снизит скорость коррозии на несколько порядков при минимальном потреблении энергии, поскольку ток очень маленький. Этот тип контроля коррозии называется анодной защитой, которую рекомендуется использовать в очень агрессивных средах. Анодная защита может быть выполнена несколькими способами, но чаще всего простым наложением постоянной ЭДС от внешнего источника тока. Кроме того, в отличие от катодной защиты, положительный полюс источника тока соединен с защищаемым продуктом, а катоды расположены вблизи поверхности продукта. Количество катодов, их размеры и расстояние от изделия должны обеспечивать равномерную анодную поляризацию. Анодная защита используется для предотвращения повреждения изделий из легированной стали. Эффективность анодной защиты можно проследить, если учесть коррозию стали 10Х18Н9Т в 50% -ной серной кислоте при 50 ° С.
В настоящее время анодная защита также используется в промышленности для защиты изделий из углеродистой стали, что увеличивает срок службы оборудования. Использование анодной защиты снижает загрязнение агрессивной среды продуктами коррозии. Например, содержание железа в олеуме в стальном устройстве с анодной защитой составляет всего 0,004%, тогда как в устройстве без анодной защиты концентрация железа в олеуме резко увеличивается и становится равной 0,12%.
Ингибиторы коррозии
Также возможно снизить скорость коррозии металлического оборудования путем изменения состава агрессивной среды. Это достигается путем удаления коррозийных веществ (веществ, которые усиливают коррозию) или путем введения соединений, которые ингибируют, а иногда и полностью останавливают процесс коррозии. Можно удалить из агрессивных веществ, которые повышают скорость коррозии, путем кипячения растворов, пропускания через них инертных газов, химической обработки окружающей среды и т. д.
Кислород, который присутствует в агрессивной среде, наносит большой вред оборудованию, что резко увеличивает скорость коррозии. Поэтому вода или водные растворы солей, где коррозия металлов и сплавов происходит при деполяризации кислорода, подвергается дезоксигенации или деаэрации. Например, образец стали в сырой воде начинает портиться через несколько минут, тогда как после кипячения вода не реагирует со сталью в течение длительного времени. Это потому, что газы, в частности кислород, были удалены из воды. Если такая вода изолирована от контакта с воздухом, то есть растворение кислорода в ней исключено, то сталь не будет подвергаться коррозии в течение многих месяцев и даже лет. Но этот метод снижения скорости коррозии аппаратов и оборудования является громоздким и трудоемким, поэтому он находит ограниченное применение.
Можно уменьшить или полностью устранить коррозию металлического оборудования путем введения соединений в агрессивную среду, что значительно снижает процесс коррозии. Этот метод снижения скорости коррозии называется ингибированием, а вещества, вводимые в среду, называются ингибиторами коррозии или ингибиторами. Ингибирование используется только в системах с постоянным объемом агрессивного раствора, например, при защите резервуаров, цистерн, травильных ванн и т. д. Концентрация ингибитора, вводимого в среду, зависит от состава и свойств среды, температуры, рН. решение и т. д.
Механизм действия ингибиторов коррозии в большинстве случаев носит электрохимический характер, то есть некоторые вещества, вводимые в состав среды, замедляют анодный процесс, а другие замедляют катодный процесс или одновременно обе стадии процесса.
По характеру защитного действия используемые ингибиторы подразделяются на катодные, анодные и органические.
Вещества с окислительными свойствами (хроматы, дихроматы, нитриты и т. д.) Относятся к анодным замедлителям. Они образуют на поверхности анода из металла или сплава пассивные, чаще всего оксидные пленки толщиной ≈0,01 мкм и снижают скорость его растворения.
Катодные замедлители включают вещества, которые могут замедлять отдельные стадии катодного процесса. Например, в процессах, связанных с деполяризацией кислорода, скорость коррозии уменьшается с уменьшением концентрации кислорода в растворе. Поэтому введение поглотителей кислорода в раствор (Na2SO3) снижает скорость коррозии. Коррозия может быть уменьшена с помощью катодных замедлителей для уменьшения поверхности катодных зон. К ним относятся ZnSO4, ZnCl2 и т. д. Уменьшение коррозии при введении этих соединений объясняется образованием нерастворимого соединения Zn (OH) 2 в щелочной среде, которое, осаждаясь на стенках аппарата, изолирует поверхность катода участки от контакта с раствором.
Вывод:
Анодные и катодные замедлители (обычно неорганические соединения) снижают коррозию в нейтральных и щелочных средах, но не оказывают защитного действия в кислых средах.
Органические ингибиторы коррозии включают органические коллоиды, поверхностно-активные вещества и другие соединения. Органические ингибиторы адсорбируются на поверхности металла, а не на всей поверхности, а только на его катоде, активных участках, препятствующих разряду ионов водорода и, как следствие, разрушению металла. Органические замедлители не адсорбируются окисленной поверхностью или продуктами коррозии на ней, поэтому они будут разлагаться под воздействием агрессивной среды. Это свойство органических замедлителей используется при кислотном травлении металлов, когда ржавчина и окалина растворяются без заметной коррозии металла.
Защитный эффект органических замедлителей зависит от природы этих веществ, температуры и их концентрации в агрессивной среде. При повышении температуры их поверхностная адсорбция уменьшается, а защитный эффект резко падает. Концентрация ингибитора в растворе должна быть строго определена.