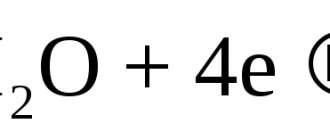Скорость коррозии – многофакторный параметр, который зависит как от внешних условий среды, так и от внутренних свойств материала. В нормативно-технической документации существуют определенные ограничения по допустимым значениям разрушения металла при эксплуатации оборудования и строительных конструкций для обеспечения их безаварийной работы. В проектировании не существует универсального метода определения скорости коррозии. Это связано со сложностью учета всех факторов. Наиболее надежным методом является изучение истории эксплуатации объекта.
Критерии
Вам будет интересно:Процессы изобарный, изохорный, изотермический и адиабатный для идеального газа
В настоящее время в проектировании техники используют несколько показателей скорости коррозии:
- По прямому способу оценки: уменьшение массы металлической детали на единицу поверхности – весовой показатель (измеряется в граммах на 1 м2 за 1 час); глубина повреждений (или проницаемость коррозионного процесса), мм/год; количество выделяющейся газовой фазы продуктов коррозии; продолжительность времени, в течение которого появляется первое коррозионное повреждение; число центров коррозии на единицу площади поверхности, появившихся за определенный срок.
- По косвенной оценке: сила тока электрохимической коррозии; электрическое сопротивление; изменение физико-механических характеристик.
Вам будет интересно:Такие обычные люди, или значение «почему бы и нет»
Первый показатель по прямому методу оценки является наиболее распространенным.
Глубинный показатель коррозии
∏=8,76•v/ρ, где
8,76 — коэффициент для перехода от измерения весового показателя скорости коррозии в расчете на 1 ч к глубинному показателю в расчете на 1 год (24 ч • 360=8760 ч);
v — скорость коррозии, г/(м2•ч);
ρ — плотность, г/см3;
В том случае, если коррозия имеет местный характер, скорость ее не может быть точно охарактеризована весовым или глубинным показателем. При питтинговой коррозии необходимо определять максимальный глубинный показатель. При межкристаллитной коррозии и коррозионном растрескивании скорость коррозии количественно характеризуется механическим показателем коррозии, например, по потере прочности:
Kσ=(σ0–σ1/σ0)•100%, где
σ0 — предел прочности до коррозии;
σ1 — предел прочности после коррозии, рассчитанный по отношению к первоначальной площади сечения металлического образца;
Расчетные формулы
В общем случае весовые потери, определяющие скорость коррозии металла, находят по следующей формуле:
Vkp=q/(St),
где q – уменьшение массы металла, г;
S – площадь поверхности, с которой произошел перенос материала, м2;
t – период времени, ч.
Для листового проката и изготовленных из него обечаек определяют глубинный показатель (мм/год):
H=m/t,
m – глубина проникновения коррозии в металл.
Между первым и вторым показателями, описанными выше, существует следующая зависимость:
H=8,76Vkp/ρ,
где ρ – плотность материала.
Шкала грубой оценки коррозионной стойкости металлов
| Группа стойкости | Глубинный показатель коррозии, мм/год | Балл |
| Совершенно стойкие | 0,001 | 1 |
| Весьма стойкие | 0,001 … 0,005 | 2 |
| 0,005 … 0,010 | 3 | |
| Стойкие | 0,01 … 0,05 | 4 |
| 0,05 … 0,10 | 5 | |
| Пониженно стойкие | 0,1 … 0,5 | 6 |
| 0,5 … 1,0 | 7 | |
| Малостойкие | 1,0 … 5,0 | 8 |
| 5,0 … 10,0 | 9 | |
| Нестойкие | 10,0 | 10 |
Основные факторы, влияющие на скорость коррозии
Вам будет интересно:Шуточные номинации для учителей на выпускной
На скорость разрушения металла влияют следующие группы факторов:
- внутренние, связанные с физико-химической природой материала (фазовая структура, химический состав, шероховатость поверхности детали, остаточные и рабочие напряжения в материале и другие);
- внешние (окружающие условия, скорость движения коррозионно-активной среды, температура, состав атмосферы, наличие ингибиторов или стимуляторов и другие);
- механические (развитие коррозионных трещин, разрушение металла под действием циклических нагрузок, кавитационная и фреттинг-коррозия);
- конструктивные особенности (выбор марки металла, наличие зазоров между деталями, требования к шероховатости).
Физико-химические свойства
Наибольшее значение среди внутренних факторов коррозии имеют следующие:
- Термодинамическая устойчивость. Для ее определения в водных растворах применяют справочные диаграммы Пурбе, по оси абсцисс которых откладывается pH среды, а по оси ординат – окислительно-восстановительный потенциал. Сдвиг потенциала в положительную сторону означает большую устойчивость материала. Ориентировочно она определяется как нормальный равновесный потенциал металла. В реальности материалы корродируют с различной скоростью.
- Положение атома в периодической таблице химических элементов. Металлы, наиболее подверженные коррозии, – это щелочные и щелочноземельные. Скорость коррозии снижается при увеличении атомного номера.
- Кристаллическая структура. Она оказывает неоднозначное влияние на разрушение. Крупнозернистая структура сама по себе не приводит к росту коррозии, но благоприятна для развития межкристаллитного избирательного разрушения границ зерна. Металлы и сплавы с однородным распределением фаз корродируют равномерно, а с неоднородным – по очаговому механизму. Взаимное расположение фаз выполняет функцию анода и катода в агрессивной среде.
- Энергетическая неоднородность атомов в кристаллической решетке. Атомы с наибольшей энергией расположены в углах граней микронеровностей и являются активными центрами растворения при химической коррозии. Поэтому тщательная механическая обработка металлических деталей (шлифовка, полировка, доводка) повышает коррозионностойкость. Данный эффект объясняется также формированием более плотных и сплошных оксидных пленок на гладких поверхностях.
Электрохимическая коррозия.
Электрохимическая коррозия является наиболее распространенным типом коррозии металлов. По электрохимическому механизму коррозируют металлы в контакте с растворами электролитов (морская вода, растворы кислот, щелочей, солей) . В обычных атмосферных условиях и в земле металлы коррозируют также по электрохимическому механизму , т.к. на их поверхности имеются капли влаги с растворенными компонентами воздуха и земли. Электрохимическая коррозия является гетерогенным и многостадийным процессом. Ее причиной является термодинамическая неустойчивость металлов в данной коррозионной среде.
Термодинамика электрохимической коррозии металлов.
Стремлением металлов переходить из металлического состояния в ионное для различных металлов различно. Вероятность такого перехода зависит также от природы коррозионной среды. Такую вероятность можно выразить уменьшением свободной энергии при протекании реакции перехода в заданной среде при определенных условиях.
Следовательно, для электрохимического растворения металла необходимо присутствие в растворе окислителя (деполяризатора, который бы осуществлял катодную реакцию ассимиляции электронов), обратимый окислительно-восстановительный потенциал которого положительнее обратимого потенциала металла в данных условиях.
Катодные процессы при электрохимической коррозии могут осуществляться различными веществами.
- ионами
- оксидами и гидрооксидами (как правило малорастворимыми продуктами коррозии, образованными на поверхности металлов)
- органическими соединениями
молекулами
В коррозионной практике в качестве окислителей-деполяризаторов, осуществляющих коррозию, выступают ионы водорода и молекулы растворенного в электролите кислорода.
При увеличении активности ионов металла (повышение концентрации ионов металла в растворе), потенциал анода возрастает, что приводит к торможению растворения металла. Понижение активности металла, напротив, способствует растворению металла. В ходе коррозионного процесса изменяются не только свойства металлической поверхности, но и контактирующего раствора (изменение концентрации отдельных его компонентов). При уменьшении, например, концентрации деполяризатора, у катодной зоны может оказаться, что катодная реакция деполяризации термодинамически невозможна.
Гомогенные и гетерогенные пути электрохимической коррозии.
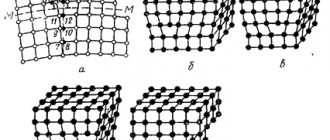
Причину коррозии металлов в растворах, не содержащих одноименных ионов, объясняет теория необратимых потенциалов. Эта теория рассматривает поверхность металлов как однородную, гомогенную. Основной и единственной причиной растворения (коррозии) таких металлов является термодинамическая возможность протекания анодного и катодного актов. Скорость растворения (коррозии) будет определяться кинетическими факторами. Но гомогенную поверхность металлов можно рассматривать как предельный случай, который может быть реализован, например, в жидких металлах. (ртуть и амальгамы металлов). Для твердых металлов такое допущение будет ошибочным, хотя бы потому что различные атомы сплава (и чистого металла) занимают различное положение в кристаллической решетке. Наиболее сильное отклонение от гомогенной конструкции будет наблюдаться при наличии в металле инородных включений, интерметаллидов, границ зерен и т.д. В этом случае, разумеется, поверхность является гетерогенной. Установлено, что даже при наличии на поверхности металла неоднородностей в целом поверхность остается эквипотенциальной.
Таким образом, неоднородность поверхностей сплава не может являться основной причиной общей коррозии металла. Наиболее существенной в подобных случаях является ионизация растворения анодной составляющей вблизи катодной составляющей, это возможно, если на поверхности металлической конструкции возникают гальванические элементы. Рассмотрим некоторые из них:
а) неоднородность металлической фазы, обусловленная неоднородностью сплава, а также в результате микро и макровключений.
б) неоднородность поверхности металла в следствие наличия границ блоков и зерен кристаллов, выход дислокаций на поверхность, анизотропность кристаллов.
в), г) неоднородность защитных пленок на поверхности за счет микро и макропор пленки (в), за счет неравномерного образования на поверхности вторичных продуктов коррозии (г) и др.
Мы рассмотрели два крайних механизма саморастворения металлов: равномерное растворение идеально гомогенной поверхности и растворения (в основном локальное) микроэлементов при пространственном разделении катодных и анодных зон (процессов).
В общем случае, необходимо считаться с возможностью протекания на анодных участках наряду с основными анодными процессами катодных процессов, на катодных же участках могут протекать с пониженной скоростью анодные процессы растворения.
Можно сделать вывод, что нет оснований противопоставлять «гомогенный» и «гетерогенный» пути протекания коррозионных процессов. Правильнее будет их рассматривать как факторы, взаимно дополняющие друг друга. Основной же причиной коррозии металлов остается по-прежнему термодинамическая вероятность протекания в данных условиях на металле анодных процессов ионизации металла и сопряженного с ним катодного процесса деполяризации.
Анодные процессы при электрохимической коррозии металлов.
Термодинамические основы.
Для протекания коррозионного процесса существенным является состояние форма соединения , в котором находится катион металла в растворе. Ионизация металла с последующим переходом в раствор простых компонентов металла представляет лишь одно из возможных направлений анодных процессов. Форма их конкретного состояния во многом определяется как природой металла и контактирующей с ним средой , так и направлением и величиной поляризующего тока (или электродного потенциала). Переходя в раствор, коррозирующий металл вступает в связь либо с растворителем, либо с компонентами раствора. При этом могут образовываться простые и комплексные соединения с различной растворимостью и с различной адгезией к поверхности металла. При высоких положительных значениях потенциала на аноде возможен процесс окисления воды с выделением кислорода. В зависимости от того, какие процессы или их сочетания протекают на аноде, они могут в значительной мере (а иногда и полностью) контролировать суммарный процесс коррозии.
Причины анодного растворения металлов.
Простейшими анодными реакциями являются такие , в результате которых образуются растворимые гидратированные и комплексные катионы,. которые отводятся от анода путем диффузии, миграции (перенос за счет электрического поля) или конвекции.
Полярные молекулы жидкости электростатически взаимодействуют с заряженными ионами, образуют сольватные (в случае воды-гидратные) комплексы. Обладающие значительно меньшим запасом энергии чем ионы в кристаллической решетки металла. Величину этого понижения можно оценить, исходя из соображений предложенных Борном. Полный электрический заряд в вакууме обладает энергией, равной потенциальной энергии. Для определения величины энергии заряда представим, что проводящая сфера радиусом r имеет заряд q. Внесение еще одной части заряда dq в сферу должно быть встречено отталкивающими силами df=qdq/r. Поистине огромное уменьшение энергии иона в водном растворе указывает на устойчивость такого состояния в нем. Таким образом, причиной перехода атомов металла с поверхности и их ионизация является электростатическое взаимодействие (сольватация) ионов металла с полярными молекулами растворителя.
Анодная пассивность металлов.
При значительном торможении анодной реакции ионизации металла скорость коррозионного процесса может понизится на несколько порядков. Такое состояние металла принято называть анодной пассивностью. Пассивность можно определить следующим образом: пассивность — состояние повышенной коррозионной устойчивости металла или сплава (в условиях, когда термодинамически он является реакционно способным), Вызванное преимущественным торможением анодного процесса т.е. может произойти так, что в реальных условиях скорость коррозии «активных» элементов оказывается весьма незначительной в следствии наступления пассивного состояния. Например, титан расположенный левее цинка, и хром, расположенный рядом с цинком, в следствии наступления пассивности оказываются более коррозионностойкими в большинстве водных сред, чем цинк. На склонность к пассивному состоянию влияет природа системы металл-раствор. Наибольшую склонность к переходу в пассивное состояние проявляют Ti,Ni,Al,Mg,Fe,Co и др.
Наступление пассивного состояния приводит к значительному изменению формы анодной поляризационной кривой. Кривая может быть разбита на несколько характерных участков:
Но начиная с В становится возможным процесс образования защитного слоя (фазового или адсорбционного), скорость которого растет при смещении потенциала в положительную сторону. Это приводит к торможению анодного растворения (BD). В точке D, соответствующей потенциалу ( потенциал начала пассивации) скорость образования защитного слоя равна скорости его растворения. Далее идет рост защитного слоя, экранирующего поверхность, скорость анодного растворения резко понижается (DE). В точке Е, соответствующей потенциалу полной пассивации металл оказывается в пассивном состоянии. На участке EF (область пассивного состояния) скорость анодного процесса не зависит от потенциала, а определяется скоростью химического растворения защитной пленки. Ток соответствующий области пассивного состояния, называется током пассивного состояния (i ). Положительнее F возможна ( -потенциал перепассивации) новая ветвь активного растворения с образованием катионов более высокой валентности.
При высоких положительных потенциалах возможен локализованный пробой оксидной пленки — металл начинает растворятся по типу питтинга (PP’) называют потенциалом питтингообразования.
Металл запассивированный в данной среде, может сохраняться в пассивном состоянии некоторое время в непассивирующей среде.
Влияние кислотности среды
Вам будет интересно:Копать или капать? Как правильно написать?
В процессе химической коррозии концентрация ионов водорода оказывает влияние на следующие моменты:
- растворимость продуктов коррозии;
- формирование защитных оксидных пленок;
- скорость разрушения металла.
При рН в интервале значений 4-10 единиц (кислый раствор) коррозия железа зависит от интенсивности проникновения кислорода к поверхности объекта. В щелочных растворах скорость коррозии сначала уменьшается из-за пассивации поверхности, а затем, при рН>13 увеличивается в результате растворения защитной оксидной пленки.
Для каждого вида металла существует своя зависимость интенсивности разрушения от кислотности раствора. Благородные металлы (Pt, Ag, Au) устойчивы к коррозии в кислой среде. Zn, Al быстро разрушаются как в кислотах, так и в щелочах. Ni и Cd устойчивы к щелочам, но легко корродируют в кислотах.
Классификация коррозионных процессов.
- По механизму процесса различают химическую и электрохимическую коррозию металла.Химическая коррозия — это взаимодействие металлов с коррозионной средой, при котором окисляется металл и восстанавливается окислительные компоненты коррозионной среды протекают в одном акте. Так протекает окисление большинства металлов в газовых средах содержащих окислитель (например, окисление в воздухе при повышении температуры).Электрохимическая коррозия — это взаимодействие металла с коррозионной средой, при котором ионизация атомов металла и восстановление окислительной компоненты среды происходит не водном акте, и их скорости зависят от электродного потенциала металла. По такому процессу протекают, например, взаимодействие металла с кислотами.
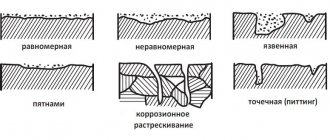
- По характеру коррозионного разрушения.Общая или сплошная коррозия при которой коррозирует вся поверхность металла. Она соответственно делится на равномерную (1а), не равномерную (1б) и избирательную (1в), при которой коррозионный процесс распространяется преимущественно по какой-либо структурной составляющей сплава.Местная коррозия при которой коррозируют определенные участки металла: коррозия язвами — коррозионные разрушения в виде отдельных средних и больших пятен (коррозия латуни в морской воде)
- межкристаллическая коррозия при ней процесс коррозии распространяется по границе металл-сплав (алюминий сплавляется с хромоникелем) и другие виды коррозии.
- Газовая коррозия — это коррозия в газовой среде при высоких температурах. (жидкий металл, при горячей прокатке, штамповке и др.)
1.2 Показатель скорости коррозии.
Для установления скорости коррозии металла в данной среде обычно ведут наблюдения за изменением во времени какой-либо характеристики, объективно отражающей изменение свойства металла.
Чаще всего в коррозионной практике используют следующие показатели.
- Показатель изменения массы — изменение массы образца в результате коррозии отнесенный к единице поверхности металла S и к единице времени (например, г/м ч) в зависимости от условий коррозии различают: отрицательный показатель изменения массы
- положительный показатель изменения массы
Кислородный показатель коррозии — это объем поглощенного в процессе О , отнесенный к Su .
где Ro и R электрическое сопротивление образца соответственно до и после коррозии.
У этого способа есть некоторый недостаток толщина металла во все время испытаний должна быть одинаковой и по этой причине чаще всего определяют удельное сопротивление, т.е. изменение электрического сопротивления на единицу площади образца (см, мм) при длине равной единице. Этот метод имеет ограничения применения (для листового металла не более 3мм). Наиболее точные данные получают для проволочных образцов. Этот метод не пригоден для сварных соединений.
Состав и концентрация нейтральных растворов
Скорость коррозии в нейтральных растворах зависит в большей степени от свойств соли и ее концентрации:
- При гидролизе солей в коррозионной среде образуются ионы, которые действуют как активаторы или замедлители (ингибиторы) разрушения металла.
- Те соединения, которые увеличивают pH, повышают также скорость деструктивного процесса (например, кальцинированная сода), а те, которые снижают кислотность, – уменьшают ее (хлористый аммоний).
- При наличии хлоридов и сульфатов в растворе разрушение активизируется до достижения некоторой концентрации солей (что объясняется усилением анодного процесса под влиянием ионов хлора и серы), а затем постепенно снижается из-за уменьшения растворимости кислорода.
Некоторые виды солей способны образовывать труднорастворимую пленку (например, фосфорнокислое железо). Это способствует защите металла от дальнейшего разрушения. Данное свойство используется при применении нейтрализаторов ржавчины.
Основные показатели коррозии и методы оценки коррозионной стойкости
4>
Коррозия приводит к изменению массы; механических, электрических, оптических, электрохимических свойств; состава и структуры, состояния поверхности металла. Эти изменения характеризует коррозионная стойкость
(химическое сопротивление материалов).
Коррозионная стойкость — способность металла сопротивляться коррозионному воздействию среды.
Коррозионная стойкость определяется качественно и количественно — на основе показателей коррозии (скорость коррозии в данных условиях, время до достижения заданной степени коррозионных поражений), полуколичественно — группой или баллом стойкости по принятой в СНГ 10-бальной шкале. На основе этих показателей определяется срок службы, долговечность и надежность металлоконструкций.
Коррозионным эффектам или интегральным показателям коррозии соответствуют скоростные или дифференциальные показатели
.
Дифференциальные показатели находят как отношение изменения коррозионного эффекта или первую производную от времени графическими или аналитическими методами.
К качественным показателям коррозии
относятся:
— визуальная оценка коррозионной стойкости
— наблюдение внешнего вида образцов с фотографированием, зарисовкой или кратким описанием и наблюдение за изменениями в коррозионно-активной среде;
— микроисследования с целью установления характера коррозионного разрушения, наличие или отсутствие локальных коррозионных поражений (межкристаллитной, питтинговой коррозии, коррозионного растрескивания и т.д.);
— применение специальных реактивов, вызывающих окрашивание анодных и катодных участков корродирующей поверхности металла.
Среди количественных показателей прямым и наиболее надежным способом определения коррозионной стойкости является гравиметрический (весовой) метод,
основанный на изменении массы образцов при испытаниях. Гравиметрическим методом определяется
скорость коррозии —коррозионные потери единицы поверхности металла в единицу времени.
(Скорость коррозии, или скорость реакции ионизации металла, определяется числом грамм–частиц, реагирующих на поверхности металла в единицу времени. Поскольку поверхность металла имеет определенный микрорельеф, площадь “видимой” поверхности S, рассчитанной по геометрическим размерам, меньше истинной поверхности S0, на которой протекает взаимодействие металла с коррозионной средой. Эти площади связаны соотношением: , где q – коэффициент шероховатости. Для идеально гладкой поверхности (например, жидкого металла) коэффициент равен единице и S=S0. Для твердых металлов q>1. Значения S0 и q трудно установить экспериментально, поэтому обычно в расчетах используют площадь “видимой” поверхности S, а число прореагировавших атомов заменяют массой окисленного металла.)
В зависимости от состояния продуктов коррозии используют различные варианты гравиметрического метода. Удельную потерю массы на единицу площадиопределяют по формуле:
, (1.2) где m0
– масса образца до испытаний [
кг,
г],
mτ –
масса образца после испытаний и удаления продуктов коррозии [м2]. Обычно удельную потерю массы выражают в . Для вычисления потери массы по увеличению массы образца необходимо знать состав продуктов коррозии.
При образовании легкоудалемых продуктов коррозии (механическими, химическими или электрохимическими методами), используют отрицательный показатель изменения массы,
или
скорость коррозии в данных условиях :
, (1.3) где m0 и mτ– масса образца до и после коррозионных испытаний и удаления продуктов коррозии соответственно, [г]; S –
площадь окисленной поверхности металла, [м2]; τ
–
время испытаний, [ч]. (Данным методом возможно определение скорости сплошной, равномерной и неравномерной, местной и подповерхностной коррозии).
Если на поверхности металла образуются хорошо сцепленные с поверхностью трудноудаляемые продукты коррозии, то по приросту массы образца можно определить положительный показатель
скорости коррозии:
, (1.4) где m0
и
mτ –
масса образца до и после коррозионных испытаний вместе с продуктами коррозии соответственно, г; S
–
площадь окисленной поверхности металла, м2; τ
–
время испытаний, ч.
Определив состав продуктов коррозии металла, можно пересчитать положительный показатель изменения массы в отрицательный и наоборот:
, (1.5) где AМе
,
Aок
– масса грамм–атома металла и окислителя соответственно;
nМе
и
nок
– валентность металла и окислителя соответственно.
Другим прямым и широко используемым на практике методом определения коррозионной стойкости является скорость проникновения коррозииили глубинный показатель
коррозии
КH
:
, (1.6)
где H — глубина коррозионного разрушения (проникновение коррозии) [мм], определяемая непосредственным измерением (штангенциркулем, микрометром, микроскопом, УЗК и т.п.), в единицу времени — τ
[ч]. (При сплошной коррозии с постоянной скоростью показатель называется
линейной скоростью коррозии, .
Глубинные показатели носят более универсальный характер и ими определяют скорости локальной коррозии).
Зная отрицательный и глубинный показатель можно определить время до уменьшения массы на единицу площади на допустимую величину ( ), и время проникновения коррозии на допустимую глубину ( ).
При равномерной коррозии отрицательный показатель (в г/м2.ч) и глубинный показатель связаны соотношением:
, (1.7) где dMe
– плотность металла, [г/см3].
Для качественной и количественной оценки коррозионной стойкости металла в конкретных условиях рекомендуется использовать шкалу коррозионной стойкости металлов (приложение, табл. 1), в которой единицей коррозионной стойкости является балл. Шкала имеет 10 баллов и носит сравнительный характер.
Волюметрический (объемный) метод
основан на измерении объема выделившего газа в результате коррозии и позволяет определить
водородный показатель коррозии (объем выделившегося в результате коррозионной реакции водорода), и кислородный показатель (объем поглощенного в результате коррозии кислорода). Объемные показатели представляют собой отношение объема ΔV выделившегося или поглощенного газа с единицы поверхности в единицу времени, приведенного к нормальным условиям (Т=273 К, Р=1,013·105 Па):
, (1.8)
Объемный показатель коррозии связан с положительным соотношением:
, (1.9) где МГи VМ– молекулярная масса и объем моля газа (22400 см3) при нормальных условиях; 104 – коэффициент пересчета см3
в
м3
.
К интегральным показателям коррозии относятся механические показатели коррозии, КМ
, отношение изменения механических свойств до и после коррозии в % (например, прочностной):
,
(1.10)
где ΔσВ
=
σ
–
σВ
,
σ
и
σВ
– предел прочности металла до и после коррозионных испытаний соответственно.
Механические показатели применяются для оценки межкристаллитной коррозии, коррозионного растрескивания, коррозионной хрупкости,
и т.п.
Изменение электрического сопротивления
металла при коррозии в течение определенного времени применяют в качестве показателя коррозии:
, (1.11)
где ΔR=Rτ – R0
,
R0
и
Rτ
– электрическое сопротивление образца до и после коррозионных испытаний в течение времени
τ
.
Данный показатель можно использовать как для общей коррозии, так и локальной (межкристаллитной, питтинговой). При использовании этого показателя важно учитывать, что электрическое сопротивление зависит структурного состояния металла (сплава), поэтому оно не должно изменяться в процессе коррозионных испытаний (например, распад твердого раствора какого–либо компонента сплава при высокотемпературных испытаниях).
Другими показателями могут быть ухудшение отражательной способности, время до появления первого коррозионного поражения и т.д.
При локальных видах коррозии (питтинговой, коррозии пятнами, расслаивающей коррозии), а также при коррозии изделий с покрытиями, в качестве показателей коррозионной стойкости используют степень поражения поверхности за определенное время или в единицу времени, или очаговый показатель коррозии
:
КS
= , (1.12)
где Si
и
ni
– площадь и количество коррозионных поражений.
Для оценки коррозионной стойкости покрытий и питтинговой коррозии площадь коррозионных поражений определяют для каждого типоразмера коррозионного очага с последующим ранжированием результатов и оценкой по специальным 10-бальным шкалам коррозионной стойкости, в которых баллы присваиваются в зависимости от степени и количества коррозионных поражений.
Скорость электрохимической коррозии может быть выражена в виде токового показателя коррозии i
– плотности анодного тока, соответствующего скорости данного коррозионного процесса, – применяют для исследования электрохимической коррозии. Связь между связь между величиной
i
(А/см2) и отрицательным показателем изменения массы (г/м2·ч) устанавливается на основе закона Фарадея:
, (1.13)
где n
– валентность металла, переходящего в раствор; F = 26,8 А·ч/г–экв – постоянная Фарадея,
AMe
– атомная масса металла, г; 104 – коэффициент пересчета.
Данный показатель определяется на основе поляризационных кривых или непосредственно – приборами коррозиметрами (например, типа “КМ-МИСиС” и др.) с автоматическим пересчетом на глубинный или весовой показатели.
4>
Дата добавления: 2017-02-13; просмотров: 11171; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Узнать еще:
Замедлители коррозии
Замедлители (или ингибиторы) коррозии различаются по механизму действия на окислительно-восстановительный процесс:
- Анодные. Благодаря им образуется пассивная пленка. К данной группе относятся соединения на основе хроматов и бихроматов, нитратов и нитритов. Последний тип ингибиторов применяется для межоперационной защиты деталей. При использовании анодных замедлителей коррозии необходимо предварительно определить их минимальную защитную концентрацию, так как добавление в небольших количествах может привести к увеличению скорости разрушения.
- Катодные. Механизм их действия основан на снижении концентрации кислорода и соответственно, замедлении катодного процесса.
- Экранирующие. Данные ингибиторы изолируют поверхность металла с помощью образования нерастворимых соединений, отлагающихся в виде защитного слоя.
К последней группе относятся нейтрализаторы ржавчины, которые используются также для очистки от окислов. В их состав, как правило, входит ортофосфорная кислота. Под ее влиянием происходит фосфатирование металла – образование прочного защитного слоя нерастворимых фосфатов. Нейтрализаторы наносят пульверизатором или валиком. Через 25-30 минут поверхность приобретает бело-серый цвет. После высыхания состава наносят лакокрасочные материалы.
Механическое воздействие
Повышению коррозии в агрессивной среде способствуют такие типы механического воздействия, как:
- Внутренние (при формовании или термообработке) и внешние (под воздействием приложенной извне нагрузки) напряжения. В результате возникает электрохимическая неоднородность, происходит снижение термодинамической устойчивости материала и формируется коррозионное растрескивание. Особенно быстро происходит разрушение при растягивающих нагрузках (трещины образуются в перпендикулярных плоскостях) в присутствии анионов окислителей, например, NaCl. Типичным примером устройств, подверженных такому типу разрушения, являются детали паровых котлов.
- Знакопеременное динамическое воздействие, вибрации (коррозионная усталость). Происходит интенсивное снижение предела усталости, образуются множественные микротрещины, которые затем сливаются в одну крупную. Число циклов до разрушения в большей степени зависит от химического и фазового состава металлов и сплавов. Такой коррозии подвержены оси насосов, рессоры, лопатки турбин и другие элементы оборудования.
- Трение деталей. Быстрое корродирование обусловлено механическим износом защитных пленок на поверхности детали и химическим взаимодействием со средой. В жидкости скорость разрушения ниже, чем на воздухе.
- Кавитационное ударное воздействие. Кавитация возникает при нарушении сплошности потока жидкости в результате образования вакуумных пузырей, которые схлопываются и создают пульсирующее воздействие. В результате возникают глубокие повреждения локального характера. Данный тип коррозии часто наблюдается в химических аппаратах.
Конструктивные факторы
При конструировании элементов, работающих в агрессивных условиях, необходимо учитывать, что скорость коррозии возрастает в следующих случаях:
- при контакте разнородных металлов (чем больше разница электродного потенциала между ними, тем выше сила тока электрохимического процесса разрушения);
- при наличии концентраторов механических напряжений (канавки, пазы, отверстия и другие);
- при низкой чистоте обработанной поверхности, так как при этом возникают локальные короткозамкнутые гальванические пары;
- при значительной разнице температуры отдельных частей аппарата (образуются термогальванические элементы);
- при наличии застойных зон (щели, зазоры);
- при формировании остаточных напряжений, особенно в сварных соединениях (для их устранения необходимо предусмотреть термическую обработку – отжиг).
Методы оценки
Существует несколько способов оценки скорости разрушения металлов в агрессивных средах:
- Лабораторные – испытания образцов в искусственно смоделированных условиях, близких к реальным. Их преимуществом является то, что они позволяют сократить сроки исследования.
- Полевые – проводятся в естественных условиях. Занимают длительное время. Преимуществом такого метода является получение информации о свойствах металла в условиях дальнейшей эксплуатации.
- Натурные – испытания готовых металлических объектов в естественной среде.
Источник
Лабораторные методы измерения и приборы контроля коррозии
Показатели коррозии
Для количественного выражения скорости коррозии служат показатели коррозии: массометрический, объёмный механический, токовый и др. Массометрический показатель скорости коррозии — это изменение массы метелла в результате коррозии отнесённое к единице его поверхности, в единицу времени вычисляется по формуле.
Где — масса исходного образца, г; — масса образца после испытания и удаления продуктов коррозии, г; — площадь поверхности образца, м2; — время испытания, ч.
Методы определения скорости коррозии по потерям массы применяют для оценки равномерной. Этими методами невозможно оценивать неравномерную коррозию межкристаллитное и транскристаллитное коррозионные разрушения.
Объёмный показатель коррозии характеризует объем V выделенного или поглощенного в процессии коррозии газа, приведенный к нормальным условиям (T= 273 К, Па) и отнесенный к единице времени
Где -объём поглощенного или выделенного газа, см2; площадь поверхности образца; время испытания, ч.
При переходе металла в продукты коррозии и кислых средах выделяется эквивалентное количество водорода. В нейтральных кислородсодержащих средах при образовании продуктов коррозии поглощенного эквивалентное количество кислорода. Объем выделенного водорода или поглощенного кислорода измеряется с помощью эвдиометра.
Глубинный показательскорости коррозии учитывать уменьшение толщины металла вследствие коррозии, выраженное в линейных единицах и отнесенное к единице времени. Среднее значение глубины коррозионного поражения при равномерной коррозии можно вычислить с помощью массометрического показателя скорости коррозии ;
.
Где плотность металла, г/см3; 8,76- переводной коэффициент.
Это показатель удобен для сравнения скорости коррозии металлов с различным плотностями.
Механический показателькоррозии характеризует изменение какого — либо показателя механических свойств металла (%) за определенное время испытаний.
Например показатель изменения предела прочности определяют по формуле
Где предел прочности металла до коррозии, МПа/м2; фиктивный предел прочности после коррозии за время испытания. МПа/м2.
Токовый показателькоррозии позволяет количество прокорродировавщего металла по формуле Фараден, если известна сила коррозионного тока
Где ток коррозии константа Фарадея; валентность металла в данном коррозионном процессе; А- атомная масса металла, г; время, с; площадь поверхности образца, м2.
При качественной и количественной оценке коррозионной стойкости металлов рекомендуется пользоваться десятибалльной шкалой (ГОСТ 13819–68) (табл.1)
Таблица 1
Десятибалльная шкала коррозионной стойкости металлов (ГОСТ 13819–68)
| Группа стойкости | Скорость коррозии металлов, мм/год | Балл |
| Совершенно стойкие | Менее 0,001 | 1 |
| Весьма стойкие | От 0,001 до 0,005 | 2 |
| От 0,005 до 0,01 | 3 | |
| Стойкие | От 0,01 до 0,05 | 4 |
| От 0,05 до 0,1 | 5 | |
| Пониженностойкие | От 0,1 до 0,5 | 6 |
| От 0,5 до 1,0 | 7 | |
| Малостойкие | От 1,0 до 5,0 | 8 |
| От 5.0 до 10,0 | 9 | |
| Нестойкие | От 10 и выше | 10 |
Химический состав и механические свойства некоторых конструкционных материалов. Наибольшие применение для изготовления оборудования нефтяной и газовой промышленности получили стали и чугуны. Среди сталей наиболее часто встречаются углеродистые, низколегированные и нержавеющие.
Конструкционные углеродистые стали делятся на углеродистую сталь обыкновенного качества и сталь качественную.
Сталь углеродистая обыкновенного качества подразделяется в зависимости от назначения и гарантируемых характеристики на три группы: группа А- сталь с гарантируемыми механическими свойствами (применяется для несварных нагруженных элементов конструкций); группа Б- сталь с гарантируемым химическом составе (применяется для сварных элементов неответственных конструкций); группа В-сталь с гарантируемыми механическими свойствами и химическим составом (применяется для сварных элементов ответственных конструкций).
Таблица 2
Химический состав углеродистой стали обыкновенного качества
| Марки стали | Содержание элементов,% | ||
| Углерод | Марганец | Кремний | |
| БСт1кп | 0,06–0,12 | 0,25–0,50 | Не более 0,05 |
| БСт1пс | 0,06–0,12 | 0,25–0,50 | 0,05–0,17 |
| БСт1сп | 0,06-,012 | 0,25–0,50 | 0,12–0,30 |
| БСт2кп | 0,09–0,15 | 0,25–0,50 | Не более 0,07 |
| БСт2пс | 0,09–0,15 | 0,25–0,50 | 0,05–0,17 |
| БСт2сп | 0,09–0,15 | 0,25–0,50 | 0,12–0,30 |
| БСт3кп | 0,14–0,22 | 0,30–0,60 | Не более 0,07 |
| БСт3пс | 0,14–0,22 | 0,40–0,65 | 0,05–0,17 |
| БСт3сп | 0,14–0,22 | 0,40–0,65 | 0,12–0,30 |
| БСт3Гпс | 0,14–0,22 | 0,80–1,10 | Не более 0,15 |
| БСт4кп | 0,18–0,27 | 0,40–0,70 | Не более 0,07 |
| БСт4кп | 0,18–0,27 | 0,40–0,70 | 0,05–0,17 |
| БСт4кп | 0,18–0,27 | 0,40–0,70 | 0,12–0,30 |
| БСт5пс | 0,28–0,97 | 0,50–0,80 | 0,05–0,17 |
| БСт5Гпс | 0,22–0,30 | 0,80–1,20 | Не более 0,15 |
| БСт6пс | 0,38–0,49 | 0,50–0,80 | 0,05–0,17 |
| БСт6сп | 0,38–0,49 | 0,50–0,80 | 0,15–0,35 |
Лабораторные методы измерений
Лабораторные испытания — это обычно ускоренные испытания, проводимые в определенных, контролируемых условиях, которые могут отличаться от существующих на практике.
Лабораторные коррозионные испытания применяют: при изучении механизма; для оценки стойкости конструкционных материалов и эффективности различных методов защиты от коррозии.
Подготовка образцов. Для гравиметрических коррозионных испытаний размеры образцов ограничивают так, чтобы их можно было взвешивать на аналитических весах. Обычно размеры образцов принимают 40х20х2 или 50х20х2 мм. Для крепления образцов во время испытания в одном из краев пластины сверлят отверстий диаметром 5 мм.
Подготовленные образцы испытывают по методике предусмотренной программой смачивание поверхности образца после погружение его готовить не мене трех образцов. Увеличение число параллельно испытываемых образцов позволяет повысить надежность результатов, особенно в том случае, когда требуется установить относительно небольшое различие в характеристике материала.
Для получения надежной информации об изменении скорости коррозии во времени необходима устанавливать на испытание такое число комплектов образцов, чтобы обеспечивать по крайней мете три периода испытаний.
Удаление продуктов коррозии. Продукты коррозии удаляют после выдержки образцов в растворах, взаимодействующих преимущественно с продуктами коррозии
Визуальное наблюдение коррозионных поражений позволяет фиксировать изменение внешнего вида поверхности металла при этом отмечают время начала появления продуктов коррозии. Их распределение по поверхности металла можно регистрировать последовательным фотографированием.
Для наблюдение распределением катодных и анодных участков по поверхности металла в электролиты вводят специальные реагенты. С помощью K3Fe(CN)6 * 2H2O можно фиксировать анодные участки поверхности по синему окрашиванию прилегающего к ним раствора. Фенолфталеин, введенный в раствор, под действием щелочной реакции на катодных металлической поверхности окрашивается в разовый цвет.
Глубину точечного поражения определяют при помощи оптического микроскопа наведением его на резкость сначала по неповрежденной поверхности, а затем по дну питтинга.
Гравиметрический метод — один из наиболее распространенных методов определения скорости коррозии. Самый простой и доступный способ испытания в электролитах — это испытание в открытом сосуде. В лабораторных исследованных обычно используют минимум 150 мл раствора на 1 см2поверхности образца.
Подготовленные к испытаниям образцы подвешивают на стеклянных крючках или капроновой нити, опускают в сосуды со средой и испытывают при полном частичном или переменном погружении в неподвижный или перемешиваемый электролит, через который можно пропускать воздух, кислород азот или другой газ.
Рис. 1. Схема коррозионных испытаний образцов в открытом сосуде при полном (а), частичном (б), погружении и неподвижный и перемешиваемый (в) раствор; 1-испытаемый образец; 2-подвеска; 3- стеклянный стакан с коррозионным раствором; 4- мешалка.
Рис. 2. Схема работы потенциостата в режиме поддержания постоянного поляризующего тока: 1-источник задающего напряжения; 2-усилитель; 3- миллиамперметр; 4- катукна; 5- рабочий электролит; 6-вспомогательный электрод; 7- вольтметр; 8- электрохимическая ячейка; 9- электрод сравнения.
Литература:
- Саакиян Л. С., Ефремон А. П. и др. Зашита нефтепромыслового оборудования от коррозии. М.:- Недра, 1985 г, 206 с.
- Кац Н. Г., Стариков В. П., Парфенов С. Н. Химическое сопротивление Материалов и защита оборудования нефтегазопереработки от коррозии. М.: Машиностроение. -2011 г.
- Жук Н. П. Курс теории коррозии и защита металлов: учеб. Пособие/ Жук Н. П. -2-е изд., стереотипное. Перепечатка издания 1976.-М:. ООО ТИД «Альянс», 2006.-472.