4.1
Средняя оценка: 4.1
Всего получено оценок: 284.
4.1
Средняя оценка: 4.1
Всего получено оценок: 284.
В твердых кристаллических телах молекулы расположены упорядоченно, образуя кристаллическую решетку, структура которой воспроизводится во всем объеме – такое расположение частиц называется дальним порядком. При нагревании тела кинетическая энергия молекул увеличивается, и при достижении температуры плавления структура решетки начинает разрушаться, твердое тело теряет форму — начинается процесс плавления. При охлаждении происходит отвердевание — переход из жидкой фазы в твердую.
Почему происходит плавление
В твердом состоянии молекулы и атомы находятся в узлах решетки, совершая непрерывные колебания вблизи фиксированного положения. Такие колебания не нарушают кристаллическую структуру. Прочность решетки обеспечивается межмолекулярными связями. В процессе нагрева тела происходит передача тепловой энергии, которая преобразуется во внутреннюю энергию молекул, увеличивая их скорость и частоту колебаний. При достижении некоторого критического значения температуры Tпл (температуры плавления) происходит разрыв межмолекулярных связей, молекулы покидают свои места, что приводит к изменению формы тела, которое начинает переходить в жидкое состояние.
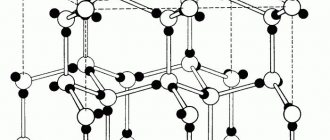
Рис. 1. Примеры строения кристаллических решеток: графит, алмаз,NaCl.
Итак, плавлением называется процесс перехода из твердого состояния в жидкое.
Переходы между фазами
Изучая явления плавления и кристаллизации, следует познакомиться с понятием фазы вещества. Под ней полагают такое состояние материи, которое определяется конкретным строением и физико-химическими свойствами. Необходимо не путать это понятие с агрегатным состоянием. Например, чистый элемент железо может находиться в одном агрегатном состоянии, но иметь при этом разные фазы.
Так, будучи твердым, оно может быть в следующих формах:
- альфа низкотемпературная — имеет объемно центрированную кубическую решетку и обладает магнитными свойствами;
- гамма — имеет кристаллическую решетку кубическую гранецентрированную, немагнитное;
- дельта высокотемпературная — обладает таким же типом решетки, что и альфа-железо, но является немагнитным.
Превращения первого рода
В физике изучены многие виды превращений между фазами, которые сопровождаются определенным тепловым эффектом. Такие переходы носят название превращений первого рода. Выделяют следующие из них:
- из твердого в жидкое — плавление, наоборот — кристаллизация;
- из твердого в газообразное — возгонка, наоборот — десублимация;
- из жидкого в газообразное — кипение, наоборот — конденсация.
Здесь не приведена плазма, которая также относится к одному из агрегатных состояний. Для нее характерны процессы ионизации.
Помимо переходов первого рода существуют превращения второго рода. Последние не характеризуются тепловым эффектом, а связаны лишь с изменением каких-либо свойств вещества, например, магнитности или электрической проводимости.
Энергия Гиббса
Чтобы понимать графики превращений вещества между разными фазами, необходимо владеть понятием энергии Гиббса. Эта физическая величина характеризует стабильность фазы при рассматриваемых условиях. Под последними в большинстве случаев имеют в виду температуру и давление. Для изменения энергии Гиббса ΔG можно записать следующее термодинамическое выражение: ΔG = ΔH — T * ΔS.
Здесь ΔH — это изменение энтальпии или скрытой теплоты во время изучаемого фазового превращения, ΔS — изменение энтропии или меры беспорядка в ходе физического процесса, T — значение абсолютной температуры.
Следует запомнить, что всякий термодинамический процесс является выгодным с энергетической точки зрения, если в результате него изменение свободной энергии Гиббса оказывается отрицательным (ΔG<0), то есть величина G уменьшается.
Помимо энергетического фактора произвольности превращения существует еще кинетический. Любое вещество, в каком бы агрегатном состоянии ни находилось, характеризуется определенным микроскопическим строением. В процессе фазового превращения это строение изменяется. Для этого необходимо, чтобы участвующие в нем частицы имели определенный запас кинетической энергии, который позволит им выполнить пространственную перестройку. Понимание кинетического фактора играет ключевую роль при аморфных и метастабильных превращениях.
Что такое отвердевание
Наблюдения показывают, что если расплавленное вещество охладить, то при достижении температуры Tотв (температура отвердевания) начинается обратный процесс перехода из жидкого состояния в твердое. Этот фазовый переход называется отвердеванием или кристаллизацией. Экспериментально доказано, что для кристаллических тел Tпл = Tотв. “Горячие” молекулы”, при охлаждении теряют скорость и отдают тепло в окружающую среду. Внутренняя энергия уменьшается, частицы под воздействием сил молекулярного взаимодействия начинают “занимать” постоянные места, восстанавливая структуру решетки.
Процессы плавления и отвердевания происходят не скачкообразно, а постепенно, так, что одновременно могут соседствовать твердая и жидкая компоненты. Эксперименты показывают, что до окончания плавления (или отвердевания) всей массы вещества, его температура остается постоянной.
Металлы, температура плавления которых больше 16500С, называют тугоплавкими. Например, температура плавления вольфрама равна 33700С. Поэтому из него делают долговечные нити накаливания для ламп. Тугоплавкие металлы и их сплавы незаменимы в ракетостроении, атомной энергетике, металлургии, космической технике — везде, где необходимы высокие жаропрочные свойства.
Твердые тела и жидкости
С этими агрегатными состояниями вещества каждый человек сталкивается каждый день. Чтобы отчетливо понимать, какие процессы происходят во время плавления твердых тел, кристаллизации жидкостей и их нагревания, необходимо знать об особенностях внутреннего строения этих агрегатных состояний на атомно-молекулярном уровне. Жидкости и твердые вещества имеют одно общее свойство — являются несжимаемыми. Остальные их характеристики отличаются значительно.
Кристаллическое и аморфное состояние
Несмотря на великое многообразие твердых тел, их внутреннее строение относится к одной из двух групп. Выделяют следующие:
- кристаллы;
- аморфы.
И те и другие характеризуются определенной физической формой и способностью оказывать сопротивление внешним механическим нагрузкам.
Кристаллы состоят из упорядоченных ячеек атомов и молекул в пространстве так, что образуется правильная геометрическая решетка, которая называется кристаллической. С помощью трансляций на конкретные векторы можно из одного узла решетки попасть в любой другой. Строгое периодическое строение обуславливает анизотропию физических свойств кристаллов. Их примером является поваренная соль, сталь, лед и другое.
Чистые кристаллы в природе сложно встретить, поэтому они всегда в своем составе содержат примеси, вакансии, дислокации, то есть дефекты, которые нарушают их идеальное геометрическое строение.
Аморфы — это вещества, структурный порядок в которых нарушен. Они не обладают дальним порядком, подобно кристаллам. Однако для них характерен ближний порядок, который обусловлен химическими свойствами соответствующих элементов. Аморфы изотропны. Примером является стекло.
Текучие несжимаемые вещества
Речь идет о жидкостях. Типичное их строение — это хаотическое расположение частиц, которые способны за небольшие промежутки времени перескакивать из одного положения в другое. Этот факт их отличает от твердых тел, где для каждой частицы отведено вполне определенное место, вокруг которого она осуществляет колебания.
Атомы и молекулы жидкости слабо связаны друг с другом в отличие от кристаллов и аморфов. Это позволяет веществу легко принимать произвольную форму при любых необъемных механических воздействиях на него. С другой стороны частицы в жидкостях расположены на достаточно близком друг от друга расстоянии, чтобы взаимодействовать с помощью ван-дер-ваальсовых связей и не давать им разлетаться во все стороны, как молекулам газа.
Если жидкость резко охладить, то можно заморозить все ее частицы в своих позициях. В результате получается аморфное твердое состояние. Оно является метастабильным с энергетической точки зрения, однако для перехода в стабильное состояние необходимо затратить определенную энергию активации (кинетический фактор).
Графическое представление процессов плавления и отвердевания
График плавления и отвердевания кристаллических тел дает наглядное представление о временной зависимости этих фазовых переходов.
Рис. 2. График плавления и отвердевания вода-лед.
Обычная вода является хорошим примером для иллюстрации обсуждаемых явлений. На представленном графике по оси абсцисс отложено время t, а по оси ординат — температура. Пускай изначально, в момент времени t = 0, когда температура льда (кристалла) была равна -400С, начнется подача тепла — нагрев. Рассмотрим далее временную зависимость температурной зависимости T(t):
- На участке АВ, от -400С до 00С (температура плавления льда) существует лед в кристаллическом виде;
- Участок ВС — происходит стадия плавления, присутствуют одновременно лед и вода. Температура остается постоянной, равной 00С;
- СD — в точке С закончилось плавление, существует только жидкая фаза — вода;
- DЕ — в точке D прекратился нагрев, происходит остывание вплоть до точки Е, т.е. до температуры 00С. Присутствует только вода в жидком виде;
- EF — в точке Е, начинается отвердевание, появляются кристаллы льда, но одновременно присутствует и жидкая фаза. Температура остается постоянной, равной 00С;
- FK — в точке F произошло полное отвердевание, остается только лед в кристаллическом виде, температура которого постепенно понижается.
Свойства воды
Прежде чем говорить о температуре таяния льда, стоит рассмотреть основные свойства этой уникальной жидкости.
Итак, воде присущи следующие свойства:
- Отсутствие цвета.
- Отсутствие запаха.
- Отсутствие вкуса (однако качественная питьевая вода имеет приятный вкус).
- Прозрачность.
- Текучесть.
- Способность растворять различные вещества (например, соли, щелочи и т. д.).
- Вода не имеет собственной постоянной формы и способна принимать форму сосуда, в который попадает.
- Способность очищаться посредством фильтрования.
- При нагревании вода расширяется, а при охлаждении сжимается.
- Вода может испаряться, превращаясь в пар, и замерзать, образуя кристаллический лед.
В этом списке представлены основные свойства воды. Теперь разберемся, каковы особенности твердого агрегатного состояния этого вещества, и при какой температуре тает лед.
Что такое удельная теплота плавления
Удельной теплотой плавления λ (греческая буква “лямбда”), называется физическая величина, равная количеству тепла, которое необходимо передать твердому телу массой 1 кг, чтобы полностью перевести его в жидкую фазу. Формула удельной теплоты плавления выглядит так:
$ λ ={Q \over m}$ (1)
где:
m — масса плавящегося вещества, кг;
Q — количество тепла, переданное веществу при плавлении, Дж.
Значения λ для разных веществ определяют экспериментально. Размерность λ следует из формулы (1):
$ [λ] = { [Дж]\over [кг] } $ (2)
Зная λ, можно рассчитать количество тепла Q, которое необходимо сообщить телу массой m для его полного расплавления:
$Q={ λ * m}$ (3)
При отвердевании ровно такое же количество тепла будет возвращено в окружающую среду.
Некоторые вещества при нагревании минуют стадию плавления и сразу испаряются. Такой процесс называют сублимацией или возгонкой. Примером такого вещества может служить кристаллический йод. Обратный переход из газообразного состояния, проходящий без образования жидкой фазы, называется десублимацией. Примерами таких переходов служат образование кристаллов йода из паров йода и выпадение инея и снежинок из водяных паров воздуха.
Рис. 3. Образование узоров инея на стекле.
Вода на Земле
Нельзя сказать, что водяной пар и лед редко встречаются в повседневной жизни. Однако наиболее распространенным является именно жидкое состояние – обычная вода. Специалисты выяснили, что на нашей планете находится более 1 млрд кубических километров воды. Однако не более 3 млн км3 воды принадлежат пресным водоемам. Достаточно большое количество пресной воды «покоится» в ледниках (около 30 млн кубических километров). Однако растопить лед таких огромных глыб далеко не просто. Остальная же вода соленая, принадлежащая морям Мирового океана.
Вода окружает современного человека повсюду, во время большинства ежедневных процедур. Многие считают, что запасы воды неиссякаемы, и человечество сможет всегда использовать ресурсы гидросферы Земли. Однако это далеко не так. Водные ресурсы нашей планеты постепенно истощаются, и уже через несколько сотен лет пресной воды на Земле может не остаться вовсе. Поэтому абсолютно каждому человеку нужно бережно относиться к пресной воде и экономить ее. Ведь даже в наше время существуют государства, в которых запасы воды катастрофически малы.
Плавление аморфных тел
Аморфные тела конкретной температуры плавления не имеют. Строение аморфных тел больше похоже на очень вязкую жидкость, чем на твердое кристаллическое тело. Во время нагревания они будут становиться более текучими, все больше проявляя свойство жидкости. При этом, хрупкость, присущая твердому состоянию, будет исчезать. Одновременно с плавлением, температура аморфных тел будет повышаться.
Важно! Одновременно с плавлением, температура аморфных тел будет непрерывно повышаться. Потому, что такие тела не имеют конкретной температуры плавления.
Примеры аморфных тел
- канифоль (смола хвойных деревьев);
- стекло;
- эбонит;
- сургуч;
- различные пластмассы;
Примечание: Эбонит («Эбенос» др.-греч. — чёрное дерево) – это вулканизированный каучук с добавлением большого количество серы, до 50 % от массы каучука. Цвет эбонита обычно тёмно-бурый или чёрный. Этот материал не проводит электрических ток – то есть, является хорошим изолятором.
Количество теплоты
В такой науке, как физика, часто используется понятие количества теплоты. Данная величина показывает количество энергии, необходимой для нагревания, плавления, кристаллизации, кипения, испарения или конденсации различных веществ. Причем каждый из перечисленных процессов имеет свои особенности. Поговорим о том, какое количество теплоты для нагревания льда требуется в обычных условиях.
Чтобы нагреть лед, нужно сначала его растопить. Для этого необходимо количество теплоты, нужное для плавления твердого вещества. Теплота равняется произведению массы льда на удельную теплоту его плавления (330-345 тысяч Джоулей/кг) и выражается в Джоулях. Допустим, что нам дано 2 кг твердого льда. Таким образом, чтобы его растопить, нам понадобится: 2 кг * 340 кДж/кг = 680 кДж.
После этого нам необходимо нагреть образовавшуюся воду. Количество теплоты для данного процесса рассчитать будет немного сложнее. Для этого нужно знать начальную и конечную температуру нагреваемой воды.
Итак, допустим, что нам требуется нагреть получившуюся в результате плавления льда воду на 50 °C. То есть разница начальной и конечной температуры = 50 °C (начальная температура воды – 0 °C). Тогда следует умножить разность температур на массу воды и на ее удельную теплоемкость, которая равняется 4 200 Дж*кг/°C. То есть количество теплоты, необходимое для нагревания воды, = 2 кг * 50 °C * 4 200 Дж*кг/°C = 420 кДж.
Тогда получаем, что для плавления льда и последующего нагревания получившейся воды нам потребуется: 680 000 Дж + 420 000 Дж = 1 100 000 Джоулей, или 1,1 Мегаджоуль.
Зная, при какой температуре тает лед, можно решить множество непростых задач по физике или химии.
Снег и лед
Лед – это твердое кристаллическое вещество, которое имеет достаточно неустойчивую структуру. Он, как и вода, прозрачен, не имеет цвета и запаха. Также лед обладает такими свойствами, как хрупкость и скользкость; он холодный на ощупь.
Снег также представляет собой замерзшую воду, однако обладает рыхлой структурой и имеет белый цвет. Именно снег каждый год выпадает в большинстве стран мира.
Как снег, так и лед – крайне неустойчивые вещества. Чтобы растопить лед, не нужно прикладывать особых усилий. Когда же он начинает таять?
Плавление кристаллических тел
Чтобы кристаллическое тело начало плавиться, его нужно нагреть до определенной температуры. Одни кристаллические тела будут плавиться при низкой температуре, а другие – при высокой. То есть, у каждого вещества своя температура плавления. Ее можно найти в справочнике физики. При этом, пока вещество не расплавится, его температура изменяться не будет.
Важно! Кристаллические тела имеют конкретную температуру плавления. Пока кристаллическое вещество полностью не расплавится, его температура не изменится!
Примечания:
- Кристаллические вещества плавятся при той же температуре, при которой они будут превращаться в твердое тело (кристаллизоваться).
- Чтобы жидкое вещество начало кристаллизоваться, оно сначала должно остыть до определенной температуры.
- Температура плавления и температура кристаллизации – это одна и та же температура.
Примеры кристаллических тел
- лед;
- свинец;
- алюминий;
- ртуть;
- железо;
- золото;
- серебро;