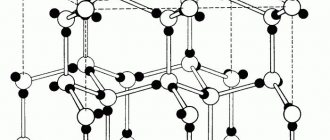
Графит (от др.-греч. γράφω — пишу) – это природный материал, относящийся к классу самородных элементов, аллотропная модификация углерода. Он имеет слоистую структуру. Каждый слой кристаллической решетки графита может по-разному располагаться по отношению друг к другу, образуя политипы.
Графит находит свое применение в производственной и промышленной деятельности. Графитовые изделия отличаются повышенными эксплуатационными характеристиками. Графит устойчив к химическим и природным воздействиям, он достаточно прочный, хорошо проводит электрический ток, отличается низкой твердостью, относительной мягкостью, после воздействия высоких температур затвердевает.
Плотность составляет 2.23 г/см3. Графит имеет металлический блеск и темно-серый цвет. Теплопроводность этого минерала достаточно большая, поэтому его используют для изготовления комплектующих деталей электрооборудования.
Различают месторождения кристаллического графита, связанного с магматическими горными породами или кристаллическими сланцами, и скрытокристаллического графита, образовавшегося при метаморфизме углей.
Структура графита
Гексагональная кристаллическая полиморфная (аллотропная) модификация чистого углерода, наиболее устойчивая в условиях земной коры.
Слои кристаллической решетки могут по-разному располагаться относительно друг друга, образуя целый ряд политипов, с симметрией от гексагональной сингонии (дигексагонально-дипирамидальный вид симметрии), до тригональной (дитригонально-скаленоэдрический в.с.). Кристаллическая решетка графита — слоистого типа.
В слоях атомы С расположены в узлах гексагональных ячеек слоя. Каждый атом С окружен тремя соседними с расстоянием 1,42Α
Различают две модификации графита: α-графит (гексагональный P63/mmc) и β-графит (ромбоэдрический R(-3)m). Различаются упаковкой слоёв. У α-графита половина атомов каждого слоя располагается над и под центрами шестиугольника (укладка …АВАВАВА…), а у β-графита каждый четвёртый слой повторяет первый. Ромбоэдрический графит удобно представлять в гексагональных осях, чтобы показать его слоистую структуру.
β-графит в чистом виде не наблюдается, так как является метастабильной фазой. Однако, в природных графитах содержание ромбоэдрической фазы может достигать 30 %. При температуре 2500-3300 К ромбоэдрический графит полностью переходит в гексагональный.
Кристаллические решетки
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию
.
Источник
Свойства
Хорошо проводит электрический ток. В отличие от алмаза обладает низкой твёрдостью (1 по шкале Мооса). Относительно мягкий. После воздействия высоких температур становится немного твёрже, и становится очень хрупким. Плотность 2,08—2,23 г/см³.
Цвет тёмно-серый, блеск металлический. Неплавкий, устойчив при нагревании в отсутствие воздуха. Жирный (скользкий) на ощупь. Природный графит содержит 10—12 % примесей глин и окислов железа. При трении расслаивается на отдельные чешуйки (это свойство используется в карандашах).
Теплопроводность графита от 278,4 до 2435 Вт/(м*К), зависит от марки графита, от направления относительно базисных плоскостей и от температуры.
Электрическая проводимость монокристаллов графита анизотропна, в направлении, параллельном базисной плоскости, близка к металлической, в перпендикулярном — в сотни раз меньше.
Минимальное значение проводимости наблюдается в интервале 300—1300 К, причём положение минимума смещается в область низких температур для совершенных кристаллических структур. Наивысшую электрическую проводимость имеет рекристаллизованный графит.
Коэффициент теплового расширения графита до 700 К отрицателен в направлении базисных плоскостей (графит сжимается при нагревании), его абсолютное значение с повышением температуры уменьшается. Выше 700 К коэффициент теплового расширения становится положительным.
В направлении, перпендикулярном базисным плоскостям, коэффициент теплового расширения положителен, практически не зависит от температуры и более чем в 20 раз выше среднего абсолютного значения для базисных плоскостей.
Монокристаллы графита диамагнитны, магнитная восприимчивость незначительна в базисной плоскости и велика в ортогональных базисным плоскостях. Коэффициента Холла меняется с положительного на отрицательный при 2400 К.
Графит имеет кристаллическую решетку какую
В приведённой ниже таблице перечислены характерные свойства веществ с атомной и ионной кристаллическими решётками.
Характерные свойства веществ
— твёрдые при обычных условиях;
— в расплавах и растворах проводят электрический ток
| С атомной кристаллической решёткой | С ионной кристаллической решёткой |
Используя данную информацию, определите, какую кристаллическую решётку имеет:
1) хлорид кальция
;
2) графит
.
Запишите ответ в отведённом месте:
1) Хлорид кальция имеет
Хлорид кальция — вещество с ионной химической связью, тугоплавкое (Т пл = 772 °C), проводит электрический ток — имеет ионную кристаллическую решётку.
Графит — вещество с ковалентной неполярной химической связью, нелетучее, твёрдое — имеет атомную кристаллическую решётку.
Ответ: Хлорид кальция — ионная кристаллическая решётка, графит — атомная кристаллическая решётка.
Источник
Морфология
Хорошо образованные кристаллы редки. Кристаллы пластинчатые, чешуйчатые, кривогранные, обычно имеют пластинчатую несовершенную форму. Чаще бывает представлен листочками без кристаллографических очертаний и их агрегатами.
Образует сплошные скрытокристаллические, листоватые или округлые радиально-лучистые агрегаты, реже — сферолитовые агрегаты концентрически-зонального строения. У крупнокристаллических выделений часто наблюдается треугольная штриховка на плоскостях (0001).
История
История минерала графита достаточно запутанная и сложная для изучения, так как минерал очень похож на другие камни. Однако минералоги, изучающие историю камней, всё-таки находят некоторые сведения из истории происхождения и применения графита.
Они считают, что графитовый камень начали применять в средневековые времена. В любом месте на поверхности, где был обнаружен камень, он оставлял четкие жирные пятна. Когда древние люди заметили это, они стали использовать камень для письма и рисования. Позже, благодаря этому свойству, камень стали использовать в Англии. С помощью графитовых мелков английские пастухи делали отметки на шерсти овец, чтобы не упустить их из виду.
Самые первые художники создавали из графита мелки и подобие современных карандашей. С помощью них они писали картины, выполненные в стиле граффити. Инженеры и архитектуры использовали графитовые обломки для построения чертежей при проектировании различных зданий, сооружений, храмов.
Некоторые исследователи нашли первое упоминание о графите 4000 лет до нашей эры. Они утверждают, что минерал применялся первобытными людьми культуры Боян-Морица для украшения глиняной посуды. С помощью графитового камня они окрашивали предметы быта в сероватые и чёрные цвета, а также рисовали на них разнообразные узоры.
Историю названия камня связывают с известным минералогом и химиком Абрамом Вернером. В процессе составления физико-химического описания графита, учёный взял за основу свойство камня оставлять черный цвет за собой. Этим объясняется и древнегреческое название графита, означающее «писать, записывать».
Интересным фактом является и то обстоятельство, что имя первооткрывателя углерода науке до сих пор неизвестно, как и сам факт, какая из его форм – алмаз, графит – была открыта первой. Известно только, что углерод имеет 3 изотопа, два из которых стабильны, а один – радиоактивен и имеет период полураспада больше 5 тыс. лет. Изучение различных учебников химии 18 века тоже не дает четкого ответа о производных углерода. Среди опытов древних химиков часто применялось сжигание различных химических элементов и аллотропных веществ. Так в одном из трудов есть упоминание о сжигании алмаза, где подчеркивалось, что данный минерал лишь один сгорает без остатка. Ученый Лавуазье, проводя подобные опыты пришел к выводу, что алмаз является кристаллической формой углерода. Второй же аллотропный минерал углерода (графит) долгое время считали видоизмененной формой свинца и называли plumbago, пока химик Гитон де Морво осторожно не нагрел алмаз, превратив его в графит, а затем и в угольную кислоту.
Происхождение
Образуется при высокой температуре в вулканических и магматических горных породах, в пегматитах и скарнах. Встречается в кварцевых жилах с вольфрамитом и др. минералами в среднетемпературных гидротермальных полиметаллических месторождениях.
Широко распространён в метаморфических породах — кристаллических сланцах, гнейсах, мраморах. Крупные залежи образуются в результате пиролиза каменного угля под воздействием траппов на каменноугольные отложения (Тунгусский бассейн). Акцессорный минерал метеоритов. Сопутствующие минералы: кварц, пирит, гранаты, шпинель.
Металлический тип
В своём строении напоминает молекулярную, но имеет всё же более прочные связи. Отличие данного типа в том, что на её узлах находятся положительно заряженные катионы. Электроны, которые находятся в межузловом пространстве, участвуют в образовании электрического поля. Они ещё носят название электрического газа.
Простые металлы и сплавы, характеризуются металлическим типом решётки. Для них характерно наличие металлического блеска, пластичность, тепло- и электропроводность. Они могут плавиться при различных температурах.
Источник
Применение
Для изготовления плавильных тиглей, футеровочных плит — применение основано на высокой температурной стойкости графита (в отсутствие кислорода), на его химической стойкости к целому ряду расплавленных металлов.
Применяется в электродах, нагревательных элементах — благодаря высокой электропроводности и химической стойкости к практически любым агрессивным водным растворам (намного выше, чем у благородных металлов).
Для получения химически активных металлов методом электролиза расплавленных соединений, твёрдых смазочных материалов, в комбинированных жидких и пастообразных смазках, наполнитель пластмасс.
Является замедлителем нейтронов в ядерных реакторах, компонентом состава для изготовления стержней для чёрных графитовых карандашей (в смеси с каолином).
Используется для получения синтетических алмазов, в качестве эталона длины нанометрового диапазона для калибровки сканеров сканирующего туннельного микроскопа и атомно-силового микроскопа, для изготовления контактных щёток и токосъёмников для разнообразных электрических машин, электротранспорта и мостовых подъёмных кранов с троллейным питанием, мощных реостатов.
А также прочих устройств, где требуется надёжный подвижный электрический контакт, для изготовления тепловой защиты носовой части боеголовок баллистических ракет и возвращаемых космических аппаратов.
Графит (англ. Graphite) — C
| Молекулярный вес | 12.01 г/моль |
| Происхождение названия | от др.-греч. γράφω — записывать, писать |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
Что такое перлит и эвтектоид
Наблюдения показывают, что этот переход происходит следующим образом: по достижении температур GS по границам Наблюдения показывают, что этот переход происходит следующим образом : по достижении температур GS по границам аустенитовых кристаллов выделяются первые порции α — Fe, т. е. феррита, количество которого постепенно увеличивается.
Так как феррит почти не растворяет углерода, то при переходе γ-Fe -> α-Fe концентрация углерода в остаточном аустените постепенно увеличивается и может быть определена по линии G S в зависимости от температуры. Процесс выделения феррита протекает так до тех пор, пока концентрация углерода не будет соответствовать точке 5, т. е. до С=0,83%, а температура не достигнет t=723°.
В точке S кривая GS пересекается с ES — кривой предельной растворимости углерода в аустените. Поэтому дальнейшее насыщение остаточного аустенита углеродом становится уже невозможным, и последующее охлаждение вызывает окончательный распад аустенита, который совершается при постоянной температуре t=723°.
При этом распаде завершается переход γ- Fe->α-Fe, а выделившийся из кристаллической решетки железа углерод образует частицы цементита F3C. Распад аустенита происходит в стесненном объеме в пределах каждого зерна, поэтому продукты распада (феррит и цементит) образуются в виде тесно перемешанных частиц, обычно в виде чередующихся пластинок феррита и цементита.
Схема изменений структуры сталей при переходе через критические точки
Этот продукт распада аустенита называется перлитом; так как перлит имеет строение, подобное эвтектике, то он называется эвтектоидом. Разница между эвтектикой и эвтектоидом заключается в том, что эвтектика образуется из жидкого раствора, а эвтектоид — из твердого.
Образование перлита начинается и заканчивается при постоянной t=723°. Так ппявляется феррито-перлитовая структура сталей, которая при дальнейшем охлаждении от t=723° не претерпевает больше никаких структурных изменений. На рисунке представлены микроструктуры чистого железа и стали при С =0,15% и при С=0,6% (увеличение 100) после травления по-шрованной поверхности микрошлифа 4% раствором HNO3 в этиловом спирте.
Рис. 1. — феррит в чистом железе. Рис. 2 Доэвтектоидная сталь с содержанием С=0,15%
На рис. 1, где показана микроструктура чистого железа, четко выявились границы между светлыми зернами феррита. На рис. 2 представлена микроструктура строительной стали (С=0,15%); светлые поля — это феррит, темные участки — перлит. На рис. 3 приведена микроструктура машиностроительной стали (С=0,6%), из которой изготовляют оси, валы, шатуны и т. п.; большая часть шлифа занята перлитом, а феррит наблюдается только в виде тонкой сетки. Чем больше углерода, тем больше в структуре стали перлита, состав перлита одинаков (С=0,83%). Строение перлита обычно пластинчатое (рис. 4).
Рис. 3 Доэвтектоидная сталь с содержанием С=0,6%. Рис. 4 Эвтектоидная сталь (пластинчатый перлит).
Феррит, как было указано выше, представляет собой наиболее мягкую пластичную составляющую железоуглеродистых сплавов; цементит, входящий в состав перлита, наиболее твердую и хрупкую, поэтому с увеличением содержания углерода увеличивается прочность и твердость стали, но пластичность и вязкость уменьшаются
Чтобы строительная сталь была достаточно пластичной, количество перлита в ней не должно превосходить 25%, что соответствует содержанию углерода до 0,2%.
В. тех деталях, от которых требуется большая прочность и твердость, но допустимы меньшая пластичность и вязкость (детали машин), применяются стали с большим количеством перлита, с содержанием С до 0,6%. В строительном деле такие стали применяются, например, для изготовления лопат, опорных частей мостовых ферм.
Виды природного графита
- тигельный (используется для производства огнеупорных изделий. Он отличается повышенной теплопроводностью и стойкостью к резким температурным перепадам),
- литейный кристаллический (имеет низкий коэффициент расширения, характеризуется прочностью при высоких температурах, используется при отливе деталей),
- аккумуляторный (применяется как добавка, графит используется для производства электродов, отличается повышенными техническими и химическими свойствами),
- для производства стержней для карандашей (тонкодисперсный, мягкий, не содержит примесей железа),
- элементный (графит используется для производства гальванических элементов, отличается повышенной тепло- и электропроводностью),
- электроугольный,
- для изготовления смазок и электропроводящей резины.
Определение
Кристаллическая решётка — особая структура твёрдого вещества, при которой частицы стоят в геометрически строгом порядке в пространстве. В ней можно обнаружить узлы — места, где расположены элементы: атомы, ионы и молекулы и межузловое пространство.
Твёрдые вещества, в зависимости от диапазона высоких и низких температур, являются кристаллическими или аморфными — они характеризуются отсутствием определённой температуры плавления. При воздействии повышенных температур они размягчаются и постепенно переходят в жидкую форму. К такого рода веществам относятся: смола, пластилин.
В связи с этим можно поделить на несколько видов:
Но при различных температурах одно вещество может иметь различные формы и проявлять многообразные свойства. Это явление называется аллотропной модификацией.
Это интересно: металлы и неметаллы в периодической таблице Менделеева.
Физические свойства
| Цвет минерала | железно-чёрный переходящий в стально-серый |
| Цвет черты | чёрный переходящий в стально-серый |
| Прозрачность | непрозрачный |
| Блеск | полуметаллический |
| Спайность | весьма совершенная по {0001} |
| Твердость (шкала Мооса) | 1-2 |
| Излом | слюдоподобный |
| Прочность | гибкий |
| Плотность (измеренная) | 2.09 — 2.23 г/см3 |
| Радиоактивность (GRapi) | 0 |
Графит
Графит
— минерал из класса самородных элементов, одна из аллотропных модификаций углерода. Распространенный в природе минерал. Встречается обычно в виде отдельных чешуек, пластинок и скоплений, разных по величине и содержанию графита. Различают месторождения кристаллического графита, связанного с магматическими горными породами или кристаллическими сланцами, и скрытокристаллического графита, образовавшегося при метаморфизме углей.
Лечебное влияние
Графит обладает большим количество целебных свойств, что позволяет народной медицине активно применять его в качестве средства от болезней.
- Графит благоприятно воздействует на слои эпидермиса. Он используется при лечении кожных покровов от трещин, рубцов, синяков, экзем.
- Литотерапевты применяют графитовые изделия для лечения болезней в области носовых пазух. Камень помогает избавиться от сухости в слизистой оболочке носа, устранить различные хронические заболевания дыхательных путей, ринит, ларинготрахеит. Графит также используют в качестве профилактики лечения бронхиальной астмы.
- Камни графита способствуют улучшению состояния желудочно-кишечного тракта, налаживают процессы обмена веществ в организме, борются с хроническим гастритом, устраняют изжогу и снижают обострение запоров или диареи.
- Лечебный графит помогает справиться с сильной головной болью, апатией и стрессом.
- Графит оказывает целебное влияние на глаза человека. Маленькие камни снимают воспаление при ячмене, конъюнктивите, а также помогают в лечении катаракты или язвы роговицы.
- Минерал регулирует эмоциональный баланс, снижая уровень злости, вспыльчивости, агрессии, депрессии и неврастении.
Где используется?
Применение графита является неотъемлемой частью некоторых технологических процессов. Используется в таких отраслях, как машиностроение, атомная техника, металлургия, электротехника, химическая промышленность.
графитовые электроды
втулки из графита
При создании химической аппаратуры используются некоторые разновидности графита, пропитанные различными синтетическими смолами. Это вызвано свойством графита не вступать в реакцию с окислителями.
графитовый герметик для насосов
Из искусственного графита изготавливают торцевые уплотнения, подшипники, корпуса реакторов, футеровочные плитки.
Как производят графитовые стержни?
Процесс производства автоматизирован и делится на несколько этапов. Сначала из смеси глины с графитом производят сам грифель. От соотношения пропорций этих материалов зависит твердость будущего карандаша. Чем больше графита, тем мягче карандаш.
Глину дробят и смешивают с теплой водой, затем добавляют жидкое стекло для удаления примесей (песка). Далее в глину добавляется графит по рецептуре. Вся эта масса смешивается со связующим веществом из крахмала.
Стержневую массу доводят до определенной температуры и консистенции. На этом этапе производства должны выполняться строгие правила технологического процесса, в противном случае сырье будет испорчено. Полученное «тесто» пропускается через пресс, в котором формируется через специальные вальцы необходимое изделие с тремя зазорами. В результате этого процесса удаляются пузырьки воздуха. Если этот этап будет происходить с нарушением технологии, то будущий карандаш будет крошиться при нажиме.
Далее масса приобретает нужную форму и склеивается между двумя дощечками. На выходе получается всем нам знакомый карандаш.
Месторождения
Графитовая шахта
Востребованность графита в промышленности очень высока. На сегодня подсчитаны приблизительные запасы во всем мире в размере 600 млн тонн. Самые крупные месторождения графита находятся в Китае, Мексике, России, Чехии, Южной Корее и др. странах. Помимо перечисленных стран, графит добывают и на острове Шри-Ланка. Большие запасы этого минерала найдены и в Украине, в так называемом Завальевском месторождении. Обнаруженные выделения графита промышленно значимы и пользуются большим спросом.
Где и как добывается?
Графит добывают по всему миру. Рейтинг стран по запасам и добыче в мире представлен ниже.
- Китай. Около 780 тыс. т в год. В 2022 году страна стала крупнейшим производителем этого минерала в мире. За год Китай добыл графита столько же, сколько за предыдущие 2 года. Геологическая служба США подсчитала, что на долю этой страны приходится 65% мирового производства и 35% потребления.
- Индия. Добыто 150 тыс. тонн. Запасы месторождений варьируются от штата к штату. 43% запасов находятся в штате Аруначал-Прадеш. Всего в стране занято 8 компаний по добыче и производству графита.
- Бразилия. Добыча составляет 90 тыс. тонн в год. Все ведущие компании-производители являются частными. Уровень добычи остается прежним, но есть предпосылки вытеснения с рынка компаниями из Китая и Индии.
- Канада. Добывается 30 тыс. т графита в год. Спрос на канадский графит растет, особенно после заявления компании Тесла о закупке графита для производства батарей у компаний, сосредоточенных в Канаде.
- Мозамбик. Добыча 23 тыс. тонн. Добыча графита в этой стране выросла с нулевых отметок в 2016 году до представленной в 2022. Темпы добычи постоянно наращиваются, рынок в этом регионе представлен двумя компаниями.
Остальные страны добывают менее 20 тыс. тонн в год. Десятку стран замыкают Россия (6 место), Украина, Пакистан, Норвегия и Мадагаскар. В сумме эти страны добывают около 63 тыс. т графита в год. Рынок графита в мире постоянно растет. Связано это с переходом на электрические батареи во многих отраслях промышленности. Резкий подъем производства электромобилей по всему миру производит стимулирование спроса на графит.
Потребление в мире росло с 2013 по 2022 год, затем случилось понижение спроса на этот минерал. Цены снизились на уровень 2017 года, так как произошел переизбыток предложений и компании снизили производство для стабилизации мировых цен на минерал.