На свете известно очень много разных химических соединений: порядка сотни миллионов. И все они, как люди, индивидуальны. Нельзя найти два вещества, у которых совпадали бы химические и физические свойства при разном составе.
Одними из интереснейших неорганических веществ, существующих на белом свете, являются карбиды. В данной статье мы обсудим их строение, физические и химические свойства, применение и разберём тонкости их получения. Но для начала немного об истории открытия.
История
Карбиды металлов, формулы которых мы приведём ниже, не являются природными соединениями. Это обусловлено тем, что их молекулы склонны распадаться при взаимодействии с водой. Поэтому здесь стоит говорить о первых попытках синтеза карбидов.
Начиная с 1849 имеются упоминания о синтезе карбида кремния, однако некоторые из этих попыток остаются непризнанными. Крупномасштабное производство начал в 1893 году американский химик Эдвард Ачесон по способу, который был затем назван его именем.
История синтеза карбида кальция также не отличается большим количеством сведений. В 1862 году его получил немецкий химик Фридрих Вёлер, нагревая сплавленный цинк и кальций с углём.
Теперь перейдём к более интересным разделам: химическим и физическим свойствам. Ведь именно в них заключена вся суть применения данного класса веществ.
В Инте 2022 году запустят завод по производству карбида кальция
В Инте в 2022 году планируется запуск завода по производству карбида кальция. Об этом «Комиинформу» сообщил глава городского округа Инта – руководитель администрации Владимир Киселев.
«Организация зарегистрировалась в Инте, взяла в аренду помещение, землю, начала ежемесячные отчисления в бюджет округа. Производству планируется запустить в 2022 году, изначально речь идет о создании 70 рабочих мест», — отметил В.Киселев.
Напомним, завод по производству карбида кальция входил в комплексный проект развития моногорода Инта, который команда интинских управленцев защитила после обучения по президентской приоритетной программе «Комплексное развитие моногородов».
Производство карбида кальция было наименее затратным проектом. Карбид кальция – химическое соединение кальция с углеродом, необходимое для производства ацетилена, искусственного каучука или разнообразных минеральных удобрений. Карбид кальция получается сплавлением в электрических печах кокса и негашеной извести. Расплавленный карбид выпускается из печи в специальные формы — изложницы, в которых он затвердевает. Застывший карбид кальция дробится и сортируется на куски определенных размеров. Сырье для производства карбида кальция в окрестностях Инты имеется в неограниченных количествах.
Создание такого производства требовало относительно небольших инвестиций — порядка 200 миллионов рублей. Строительство модульного завода занимает всего девять месяцев. Прибыль от реализации продукции имеет высокую добавленную стоимость.
В.Киселев также напомнил, что одним из достижений 2022 года стало включение указом президента России Инты в арктическую зону.
«Перспективные направления развития Приполярья обсуждаются на самом высоком уровне, — продолжил он. — Российская Арктика сегодня становится специальной экономической зоной. Любой предприниматель, готовый вложить в Арктическую зону не менее 1 млн рублей, сможет получить статус резидента, который открывает доступ к налоговым льготам и неналоговым преференциям. И мы уверены, что желающие построить свой бизнес на севере обязательно найдутся. Глава региона Владимир Уйба говорит об этом на всех уровнях: «Потенциал развития Воркуты и Инты не исчерпан».
Продолжая тему экономического развития города, В.Киселев также рассказал, что после визита главы региона Владимира Уйба в Агрокомплексе «Инта приполярная» наметилась положительная динамика: закрыта вся задолженность по налогам и коммунальным платежам, выплачивается вовремя заработная плата. Верстается новый план развития, в который входит строительство новой фермы для крупного рогатого скота, возобновление яичного производства, модернизация оленеводческого комплекса — более глубокая переработка мяса оленины, обновление имеющейся сельскохозяйственной техники на современную.
Также планируется строительство и ввод в эксплуатацию газовой котельной ПАО «Т плюс». Срок работ — 2021-2023 годы. Во время строительства появятся дополнительные рабочие места, а после ввода объекта в эксплуатацию будет повышена надежность теплоснабжения города и улучшена экологическая ситуация.
Физические свойства
Абсолютно все карбиды отличаются своей твёрдостью. Например, одним из самых твёрдых веществ по шкале Мооса является карбид вольфрама (9 из 10 возможных баллов). К тому же эти вещества очень тугоплавкие: температура плавления некоторых из них достигает двух тысяч градусов.
Большинство карбидов химически инертны и взаимодействуют с небольшим количеством веществ. Они не растворимы ни в каких растворителях. Однако растворением можно считать взаимодействие с водой с разрушением связей и образованием гидроксида металла и углеводорода.
О последней реакции и многих других интересных химических превращениях с участием карбидов мы поговорим в следующем разделе.
Химические свойства
Почти все карбиды взаимодействуют с водой. Какие-то — легко и без нагревания (например, карбид кальция), а какие-то (например, карбид кремния) — при нагревании водяного пара до 1800 градусов. Реакционная способность при этом зависит от характера связи в соединении, о котором мы поговорим позже. В реакции с водой образуются разные углеводороды. Происходит это потому, что водород, содержащийся в воде, соединяется с углеродом, находящимся в карбиде. Понять, какой углеводород получится (а может получиться как предельное, так и непредельное соединение), можно, исходя из валентности содержащегося в исходном веществе углерода. Например, если у нас есть карбид кальция, формула которого CaC2, мы видим, что он содержит ион C22-. Значит, к нему можно присоединить два иона водорода с зарядом +. Таким образом, получаем соединение C2H2 — ацетилен. Таким же образом из такого соединения, как карбид алюминия, формула которого Al4C3, получаем CH4. Почему не C3H12, спросите вы? Ведь ион имеет заряд 12-. Дело в том, что максимальное количество атомов водорода определяется формулой 2n+2, где n — количество атомов углерода. Значит, может существовать только соединение с формулой C3H8 (пропан), а тот ион с зарядом 12- распадается на три иона с зарядом 4-, которые и дают при соединении с протонами молекулы метана.
Интересными представляются реакции окисления карбидов. Они могут происходить как при воздействии сильных смесей окислителей, так и при обыкновенном горении в атмосфере кислорода. Если с кислородом всё понятно: получаются два окисда, то с другими окислителями интереснее. Всё зависит от природы металла, входящего в состав карбида, а также от природы окислителя. Например, карбид кремния, формула которого SiC, при взаимодействии со смесью азотной и плавиковой кислот образует гексафторкремниевую кислоту с выделением углекислого газа. А при проведении той же реакции, но с одной только азотной кислотой, получаем оксид кремния и углекислый газ. К окислителям также можно отнести галогены и халькогены. С ними взаимодействует любой карбид, формула реакции зависит только от его строения.
Карбиды металлов, формулы которых мы рассмотрели — далеко не единственные представители этого класса соединений. Сейчас мы подробнее рассмотрим каждое промышленно важное соединение этого класса и затем поговорим об их применении в нашей жизни.
Система нитрид — карбид
В твердых сплавах нитриды металлов IV и V групп периодической системы элементов обычно появляются в качестве изоморфных спутников соответствующих карбидов. Так, например, монокарбиды титана, циркония, ванадия, ниобия и тантала и твердые растворы этих карбидов часто содержат в твердом растворе до 10% нитридов. Системы из карбидов металлов IV группы и нитридов металлов V группы (и наоборот) изучены лишь недавно. Все эти соединения, кроме нитрида тантала, имеют структур NaCl (B1), и можно ожидать полной их взаимной растворимости, тем более, что разница в периодах решеток невелика (исключение составляет система ZrN—HfN—VC). В системах с участием гексагонального нитрида тантала следует ожидать ограниченной растворимости. При этом аналогично системе WC—TiC компоненты с кубической решеткой растворяются в гексагональной фазе в заметных количествах; обратно же наблюдается весьма, малая растворимость при высоких температурах.
Агте и Moepc готовили прессованные смеси нитридов и карбидов титана и тантала и после частичного оплавления исследовали структуру полученных сплавов. Дувец и Оделл рентгенографически исследовали сплавы, полученные высокотемпературным (2200—2600°) спеканием в атмосфере азота прессованных смесей нитридов и карбидов металлов IV и V групп. Спекание проводилось в высокочастотной или угольной трубчатой печах. Из исследования были исключены системы с монокарбидом циркония (так как он при 2400° в токе азота неустойчив) и с нитридом и карбидом гафния (из-за больших трудностей их получения). Также не исследованы системы с гексагональным мононитридом тантала, так как здесь можно было ожидать лишь ограниченной растворимости.
Нитрид титана — карбид титана.
Кубические кристаллы, образующиеся при доменной плавке железных титанистых руд и впервые описанные Веллером, представляют собой твердый раствор 20% TiC + 80% TiN. Образованию этого твердого раствора в доменной и сталеплавильной печах и вопросам, связанным с его составом, посвящена обширная литература. Pacсматриваемая система имеет большое практическое значение, так как во всех промышленных титановых твердых сплавах присутствуют твердые растворы мононитрида и монокарбида титана.
Агте и Moepc определили методом Пирани температуры плавления различных сплавов системы мононитрид—монокарбид титана. На рис. 83 показаны результаты этих определений; на кривой «температура плавления — состав» имеется максимум при соотношении компонентов 1:1.
Микроструктура такого сплава гомогенна; рентгеноструктурные исследования также показали образование твердого раствора. Непрерывный ряд твердых растворов монокарбида и мононитрида титана был также найден при рентгенографическом исследовании образцов, полученных четырехчасовым спеканием при 2425°. Постоянные решеток в функции состава изменялись прямолинейно в соответствии с правилом Вегарда (рис. 84). Хорошо совпадают с этими данными измерения Гольдшмидта, определившего период решетки твердого раствора 20% TiC+80% TiN в 4,243 А; удельный вес твердого раствора 5,32 г/см3; твердость по шкале Mooca 8—8,5.
Кинетику реакции карбида титана с азотом изучали Зеликман с сотр. Белякова, Комар и Михайлов наблюдали образование твердых растворов TiC и TiN в процессе восстановления двуокиси титана углеродом в атмосфере азота при 1900°.
Джаффи, Огден и Майкьюз изучали совместное влияние углерода и азота на механические свойства титана; Крайхед, Симмонс и Иствуд исследовали механические свойства сплавов Ti-Co-C-N, выплавленных в дуговой вакуумной печи.
Нитрид титана — карбид циркония.
Вследствие активного взаимодействия карбида циркония с азотом при высоких температурах приготовление нужных сплавов данной системы возможно лишь при умеренных температурах и требует длительного времени. Разница в периодах решеток обоих изоморфных компонентов составляет около 10%; это позволяет еще предполагать наличие полной взаимной растворимости.
Нитрид титана — карбид гафния.
Система не исследована. По данным о периодах решеток можно ожидать образования твердых растворов.
Нитрид титана — карбид ванадия.
Смеси с 70—90% карбида ванадия прокаливали 2 часа при 2325°; остальные составы, при 2250°. При 2100° реакция проходила не полностью. Как показывают результаты измерений периодов решеток (см. рис. 84), здесь имеется полная взаимная растворимость.
Нитрид титана — карбид ниобия.
При 2250° процесс образования твердых растворов не завершается. Брикеты, спеченные из смесей обоих компонентов при 2550° (4 часа), показали полную однородность. Компоненты данной системы полностью взаимно растворимы (см. рис. 84).
Нитрид титана — карбид тантала.
Система не исследована. В связи с большой разницей в размерах решеток здесь нельзя ожидать значительной взаимной растворимости.
Нитрид циркония — карбид титана.
Брикетированная смесь компонентов после прокаливания при 2425° не достигала равновесия. Размытые линии на рентгенограммах показали и образцы, отожженные при 2600° в течение 2 час. или при 2650° в течение 1 часа. Все же имеющиеся данные позволяют признать, что компоненты системы образуют неограниченный ряд твердых растворов. Постоянные решеток в функции состава (см. рис. 84) обнаруживают незначительное отклонение на плюс от) прямой Beгарда.
Нитрид циркония — карбид гафния
(тантала). Нитрид гафния — карбиды металлов IV и V групп. Эти системы не исследованы. Исходя из незначительной разности в периодах решеток компонентов, можно предполагать наличие между ними полной взаимной растворимости (за исключением системы нитрид гафния — карбид ванадия).
Нитрид циркония — карбид циркония
. Как уже указывалось, эту систему весьма трудно исследовать. В токе азота при температурах ниже температуры разложения карбида следует ожидать полной растворимости.
Нитрид циркония — карбид ванадия.
Прокаливание брикетов в течение 3 час. при 2450° не привело к взаимодействию компонентов. Их нерастворимость, очевидно, объясняется, как и в системе карбид циркония — карбид ванадия, большой разницей в величине периодов решеток.
Нитрид циркония — карбид ниобия.
Вопреки правилу Юм-Розери (разница в периодах решеток менее 2,5%), смеси, прокаленные в течение 2 час. при 2450°, не образуют твердых растворов. Очевидно, это объясняется медленностью диффузии нитрида циркония. Если в качестве исходных применять смеси металлических порошков с углем, можно ожидать значительной растворимости.
Нитрид ванадия — карбид титана.
После 2 час. прокаливания при 2125° прессованные смеси показали полное растворение. Значения периодов решеток хорошо ложатся на прямую Вегарда (рис. 85).
Нитрид ванадия — карбид циркония.
Система не исследована. Однако компоненты слишком сильно различаются по величине периодов решеток, чтобы можно было предполагать их растворимость.
Нитрид ванадия — карбид гафния
(тантала). Эта система не исследована. Можно предполагать полную взаимную растворимость компонентов, учитывая незначительную разницу в величине периодов их решеток.
Нитрид ванадия — карбид ванадия.
Прессованные смеси, прокаленные при 2200° (2 часа), образуют однородные твердые растворы. Значения периодов их решеток точно ложаться на прямую Вегарда (см. рис. 85).
Нитрид ванадия — карбид ниобия.
В прессованных смесях, отожженных при 2250°, реакция не завершается. Также и после спекания в течение 2 час. при 2375° образцы дают нерезкие рентгеновские линии. Все же можно признать, что имеется полная взаимная растворимость ввиду прямолинейного характера зависимости «постоянная решетки — состав» (ом. рис. 85).
Нитрид ниобия — карбид титана.
Взаимодействие обоих компонентов при 2425° неполно. Резкие рентгеновские линии дают лишь образцы), прокаленные при 2550°. Значения периодов решеток ложатся близко к прямой Вегарда, слегка отклоняясь на плюс (рис. 86). Налицо полная взаимная растворимость.
Нитрид ниобия — карбид циркония.
Вследствие неустойчивости карбида циркония в атмосфере азота при высоких температурах изучение данной системы представляет значительные трудности. Полная взаимная растворимость возможна.
Нитрид ниобия — карбид гафния
(тантала). Системы не исследованы. В связи с незначительной разницей в величине периодов компонентов можно ожидать их полной взаимной растворимости.
Нитрид ниобия — карбид ванадия.
Рентгенограммы образцов, прокаленных в течение 2 час. при 2250°, дают размытые линии. Однако хорошее совпадение параметров решеток различных составов с ожидаемыми по правилу Вегарда (см. рис. 86) свидетельствуют о наличии в данной системе непрерывного ряда твердых растворов.
Нитрид ниобия — карбид ниобия.
Полная взаимная растворимость этих компонентов подтверждается рентгеновским исследованием образцов, прокаленных в течение 2 час. при 2125°. Зависимость «постоянная решетки — состав» близка к прямолинейной (см. рис. 86).
Нитрид тантала — карбиды металлов IV и V групп.
За исключением системы «нитрид тантала — карбид тантала», остальные почти не исследованы. В связи с гексагональной структурой карбида тантала здесь можно предполагать сильное ограничение или даже отсутствие растворимости. По аналогии с системой TiC-WC можно принять, что кубические карбиды растворяют значительные количества гексагонального нитрида тантала, существенно меняющиеся в зависимости от температуры; на стороне нитрида тантала также возможна некоторая растворимость.
Данные определений температуры плавления смесей нитрида и карбида тантала различного состава приведены на рис. 87. Сплав 50:50 имеет двухфазную структуру. Рентгеновское исследование также подтверждает отсутствие полностью однородного твердого раствора.
Недавно Кемпбелл с сотр. получили наращиванием из газовой фазы (TaCl5, азот и углеводороды) отложения, состоящие из нитрида и карбида тантала.
Нитрид урана — карбид урана.
По Рундле с сотр. эта система дает непрерывный ряд твердых растворов.
Резюмируя, можно отметить, что в кубических системах нитрид—нитрид и нитрид — карбид наблюдается полная взаимная растворимость, если разница в размерах атомов металлов не превышает 15% (исключение составляет система нитрид циркония — карбид ниобия). Растворимость в системах нитрид — карбид схематически представлена в табл. 65.
Какие бывают карбиды?
Оказывается, карбид, формула которого, скажем, CaC2, существенно отличается по строению от SiC. И отличие это прежде всего в характере связи между атомами. В первом случае мы имеем дело с солеобразным карбидом. Назван этот класс соединений так потому, что ведёт себя фактически как соль, то есть способен диссоциировать на ионы. Такая ионная связь очень слабая, что и позволяет легко проводить реакцию гидролиза и многие другие превращения, включающие взаимодействия между ионами.
Другим, наверное, более промышленно важным видом карбидов являются ковалентные карбиды: такие как, например, SiC или WC. Они отличаются высокой плотностью и прочностью. А также тугоплавки и инертны к разбавленным химическим веществам.
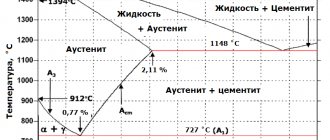
Существуют также металлоподобные карбиды. Их скорее можно рассматривать как сплавы металлов с углеродом. Среди таких можно выделить, например, цементит (карбид железа, формула которого бывает разной, но в среднем она примерно такая: Fe3C) или чугун. Они имеют химическую активность, промежуточную по своей степени между ионными и ковалентными карбидами.
Каждый из этих подвидов обсуждаемого нами класса химических соединений имеет своё практическое применение. О том, как и где применяется каждый из них, мы поговорим в следующем разделе.
Взаимодействие карбидов тугоплавких металлов с углеродом
Карбиды обладают высокими температурами плавления и твердостью, повышенной коррозионной стойкостью и теплопроводностью, низкой скоростью испарения и упругостью паров при высоких температурах, а также рядом других ценных физико-технических характеристик. В структурном отношении карбиды являются наиболее характерными представителями фаз внедрения.
Уменьшение температуры плавления в ряду тугоплавких соединений карбид—>борид—>нитрид—>окисел качественно указывает на то, что прочность связи в карбидах максимальна. В термодинамическом отношении карбиды металлов IV и V групп периодической системы являются наиболее стойкими среди тугоплавких соединений.
Развитие работ по использованию карбидов в контакте с углеграфитовыми материалами в качестве защитных покрытий, а также расширение исследований по получению композиционных карбидо-углеродных материалов вызвало интерес к изучению процессов, происходящих на контактной поверхности карбид — углерод.
Пара углеграфитовый материал — карбид находит применение в конструкциях многих высокотемпературных агрегатов, при эксплуатации которых также необходимо учитывать возможное взаимодействие на контактной границе.
В табл. 35 представлены основные высокотемпературные свойства карбидов металлов IV—VI групп периодической системы.
Тугоплавкость карбидов возрастает при увеличении номера металла и каждой группе, но уменьшается при переходе от IV к VI группе.
Взаимодействуя с углеродом, монокарбиды V группы образуют более тугоплавкие эвтектики, чем карбиды IV группы.
Большинство карбидов являются фазами переменного состава, имеющими широкие области гомогенности. Наиболее значительно от стехиометрического состава могут отклоняться карбиды металлов IV группы. Другим отличием металлов этой группы является то, что они образуют только монокарбиды. Металлы V и VI групп наряду с монокарбидами образуют низшие карбиды типа Ме2С и имеют заметно суженные области гомогенности. Монокарбидам металлов V группы свойственно образовывать структуры с наличием значительного количества дефектов и достижение стехиометрического состава для них практически невозможно. Отклонение от стехиометрического состава должно облегчать протекание диффузии благодаря возникновению значительного количества вакансий в углеродной подрешетке карбида. Действительно, коэффициент диффузии углерода в карбиде ниобия нестехиометрического состава втрое выше, чем в карбиде ниобия состава, близкого к стехиометрическому, однако для карбида циркония наблюдается обратная зависимость — с отклонением от стехиометрического состава коэффициент самодиффузии углерода в карбиде циркония уменьшается. Правда, это в значительной степени связано с тем, что реальные карбиды IV группы с дефицитом по углероду обычно загрязнены кислородом, присутствие которого затрудняет диффузию углерода.
Существует мнение, что в случае предельно насыщенных углеродом монокарбидных фаз коэффициент самодиффузии углерода в карбиде металла IV группы меньше, чем в карбиде металла соответствующего периода V группы. Это связывают с тем, что у карбидов металлов IV группы меньше «просвет» между атомами металлов как по ребру куба, так и по диагонали. Кроме того, эти карбиды соответствующие составу MeC1,0, имеют упорядоченную структуру с минимальным числом дефектов, в отличие от дефектных структур монокарбидов V группы. Однако четкого подтверждения этого предположения в настоящее время нет, но вполне определенно можно сказать, что коэффициент самодиффузии углерода в карбидных фазах при температурах плавления эвтектики сплавов MeC — С возрастает в каждой группе при увеличении периода примерно на порядок.
Низкие значения коэффициентов диффузии углерода в карбидах переходных металлов позволяют рекомендовать их в качестве барьерных слоев, задерживающих карбидизацию металлов или других тугоплавких соединений, работающих в контакте с графитом иди другими углеродными материалами.
При контактном взаимодействии карбид — углерод массоперенос углерода в значительной степени зависит от структуры карбидного материала, т. е. пористости и размера зерен. При наличии значительного количества сообщающихся пор вклад поверхностных процессов в диффузионный поток может быть весьма существенным. Аналогичным образом влияют границы зерен.
Рассматривая процессы, происходящие на контактной поверхности карбид — углерод, необходимо учитывать, что диффузия углерода в карбидной фазе происходит гораздо интенсивнее, чем самодиффузия углерода в сравниваемом графите. При температуре около 2300°К коэффициент диффузии углерода в карбиде на несколько порядков выше, чем коэффициент самодиффузии углерода в графите. Из этого следует, что скорость поступления атомов углерода из объема графита к контактной границе значительно меньше скорости их движения в объеме карбида. Такое различие при длительном высокотемпературном взаимодействии приводит к разрыхлению графита в зоне контакта с карбидом.
При контактном взаимодействии карбид — углерод, кроме температуры плавления эвтектики и скорости диффузионных процессов, необходимо учитывать различие в коэффициентах термического расширения материалов, прочность адгезионного сцепления, влияние среды, в которой происходит взаимодействие, и другие факторы.
В настоящей главе обсуждаются также процессы карбидообразования, происходящие при взаимодействии расплавленных тугоплавких переходных металлов и их паров с графитом.
Обсуждение этих процессов, на первый взгляд, представляется несколько выходящим из круга рассматриваемых вопросов. Однако то обстоятельство, что на контактной границе расплав — графит, как правило, очень быстро образуется карбидный слой и дальнейшее взаимодействие в значительной мере зависит от процессов, происходящих между графитом и карбидом в твердом состоянии, делает оправданным такое обсуждение.
Знание механизма и кинетики взаимодействия графита и карбида при наличии значительного количества жидкого металла или его паров, контактирующих с графитом, необходимо на практике при получении из расплавов или парогазовой фазы защитных карбидных покрытий на графите, при разработке технологических приемов пайки графитовых деталей, подборе углеграфитовых материалов для плавки тугоплавких металлов.
Практическое применение карбидов
Как мы уже обсудили, ковалентные карбиды имеют самый большой диапазон практических применений. Это и абразивные и режущие материалы, и композиционные материалы, используемые в разных областях (например, в качестве одного из материалов, входящих в состав бронежилета), и автодетали, и электронные приборы, и нагревательные элементы, и ядерная энергетика. И это далеко не полный список применений этих сверхтвёрдых карбидов.
Самое узкое применение имеют солеобразующие карбиды. Их реакцию с водой используют как лабораторный способ получения углеводородов. То, как это происходит, мы уже разобрали выше.
Наравне с ковалентными, металлоподобные карбиды имеют широчайшее применение в промышленности. Как мы уже говорили, таким металлоподобным видом обсуждаемых нами соединений являются стали, чугуны и прочие соединения металлов с вкраплениями углерода. Как правило, металл, находящийся в таких веществах, относится к классу d-металлов. Именно поэтому он склонен образовывать не ковалентные связи, а как бы внедряться в структуру металла.
На наш взгляд, практических применений у вышеперечисленных соединений более чем достаточно. Теперь взглянем на процесс их получения.
Получение карбидов
Первые два вида карбидов, которые мы рассмотрели, а именно ковалентные и солеобразные, получают чаще всего одним простым способом: реакцией оксида элемента и кокса при высокой температуре. При этом часть кокса, состоящего из углерода, соединяется с атомом элемента в составе оксида, и образует карбид. Другая часть «забирает» кислород и образует угарный газ. Такой способ очень энергозатратен, так как требует поддержания высокой температуры (порядка 1600-2500 градусов) в зоне реакции.
Для получения некоторых видов соединений используют альтернативные реакции. Например, разложение соединения, которое в конечном итоге даёт карбид. Формула реакции зависит от конкретного соединения, поэтому обсуждать её мы не будем.
Прежде чем завершить нашу статью, обсудим несколько интересных карбидов и поговорим о них подробнее.
Карбиды
Водородные соединения углерода
Химические свойства углерода.
В обычных условиях углерод (особенно алмаз) очень инертен и вступает во взаимодействие только с очень энергичными окислителями. При нагревании химическая активность углерода повышается. В аморфном виде уголь и кокс легко горят на воздухе, образуя углекислый газ CO2. При недостатке кислорода углерод окисляется только до СО. Алмаз способен гореть лишь в чистом кислороде при 700 — 800ºС. Эта способность углерода окисляться при нагревании используется при восстановлении многих металлов из их оксидов.
C + 2F2 = CF4; C + O2 = CO2; 2C + O2 = 2CO;
C другими галогенами углерод непосредственно не соединяется, а соответствующие соединения получают косвенным путем. Четыреххлористый углерод получают пропусканием хлора через сероуглерод при 60ºС в присутствии катализатора FeS: CS2 + 2Cl2 = CCl4 + 2S.
При высокой температуре углерод взаимодействует с серой, азотом и кремнием:
C + 2S = CS2; 2C + N2 = C2N2 или (СN)2; C + Si = SiC (2000ºС).
С металлами углерод реагирует при высоких температурах, образуя карбиды. Карбиды также можно получить при взаимодействии угля с оксидами металлов:
3C + CaO = CaC2 + CO.
Углерод взаимодействует, как восстановитель, и с оксидами других металлов при нагревании: C + 2PbO = 2Pb + CO2.
Углерод растворяется только в кислотах-окислителях при нагревании:
С + 2H2SO4 (конц.) = CO2↑+ 2SO2↑+ 2H2O;
C + 4HNO3 (конц.) = CO2↑ + 4NO2↑ + 2H2O.
Углеводороды являются достаточно стабильными, так как перекрывание малых по размеру валентных орбиталей велико, различие в электроотрицательностях углерода и водорода мало, поэтому образуются прочные ковалентные связи С−Н.
Прямой синтез метана (простейшего углеводорода) можно осуществить только в присутствии катализатора, например мелкодисперсного никеля. Разнообразие углеводородных соединений объясняется способностью углерода к образованию бесконечных линейных и разветвленных цепочек (−С−С−, >С=С< и −C≡C−) замыканию их в циклы с одинарными или кратными связями между атомами углерода как в гомоатомных, так и в гетероатомных соединениях (ароматические соединения с делокализованными π-связями).
Сам метан не реагирует с водой, кислотами и щелочами, с кислородом взаимодействует только при поджигании. Ненасыщенные углеводороды являются более реакционноспособными, чем углеводороды ряда метана. Их примеси могут служить причиной самовоспламенения болотного газа (метана) в природных условиях.
С менее электроотрицательными элементами углерод образует соединения, которые называют карбидами. Их можно разделить на 3 группы.
Ионно-ковалентные карбиды (солеподобные) –к ним относят метаниды и ацетилениды. Метаниды
можно рассматривать как производные метана, содержащие ион С−4 , например карбид бериллия Be2C или карбид алюминия Al4C3. Это тугоплавкие кристаллические вещества, которые реагируют с разбавленными кислотами с выделением метана:
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑.
Ацетилениды
— производные ацетилена состава М+12С2, М+2С2 и М+32(С2)3, содержат ион С2−2 (где М – это s- и d-металлыI и II группы периодической системы или Al+3). Ацетилениды детонируют даже в сухом виде, разлагаются водой и разбавленными кислотами:
CaC2 + 2H2O = Ca(OH)2 + C2H2.
Солеподобные карбиды получают при взаимодействии оксидов металлов с графитом при высокой температуре:
CaO + 3C = CaC2 + CO↑; 2 Al2O3 +9C = Al4C3 + 6CO.
Ацетилениды можно получить обменным взаимодействием ацетилена с солью соответствующего металла.
Металлоподобные карбиды – это карбиды d-металлов IV – VIII групп нестехиометрического состава, который изменяется в широких пределах; проявляют металлические свойства: металлический блеск, высокую твердость, высокие температуры плавления. Карбиды титана, ванадия, ниобия, молибдена и вольфрама характеризуются еще и высокой коррозионной устойчивостью.
Металлоподобные карбиды получают непосредственным взаимодействием металлов или их оксидов с углеродом в электропечах при высокой температуре:
3Fe + C = Fe3C; V2O5 + 7C = 2VC + 5CO.
Карбиды состава M3C (где металл имеет небольшой радиус) термически и химически менее устойчивы, например, разлагаются разбавленными кислотами, выделяя смесь углеводородов с достаточно длинными цепями.
Ковалентные карбиды с атомной кристаллической решеткой – B4C и SiC – продукты частичного замещения атомов углерода в структуре алмаза на атомы бора или кремния. Карбид бора очень тверд, царапает алмаз, химически достаточно инертен. Карборунд по твердости близок к алмазу, но более хрупок, химически стоек и окисляется кислородом только при температуре свыше 1000ºС. При сплавлении со щелочью в присутствии кислорода карборунд разрушается с образованием карбоната и силиката. SiC растворяется только в смеси концентрированных плавиковой и азотной кислот, в царской водке.
Такие карбиды получают в электропечах при очень высокой температуре из смесей соответственно SiO2 или B2O3 с коксом, графитом или сажей.
Применение. Металлические карбиды придают сталям и чугунам твердость, износоустойчивость. Карбиды вольфрама и тантала используют для изготовления режущих инструментов и получения сверхтвердых сплавов. Карборунд используют как абразивный материал, как компонент огнеупорных материалов, в качестве стержней сопротивления в электронагревательных приборах.
Водородные соединения углерода
Химические свойства углерода.
В обычных условиях углерод (особенно алмаз) очень инертен и вступает во взаимодействие только с очень энергичными окислителями. При нагревании химическая активность углерода повышается. В аморфном виде уголь и кокс легко горят на воздухе, образуя углекислый газ CO2. При недостатке кислорода углерод окисляется только до СО. Алмаз способен гореть лишь в чистом кислороде при 700 — 800ºС. Эта способность углерода окисляться при нагревании используется при восстановлении многих металлов из их оксидов.
C + 2F2 = CF4; C + O2 = CO2; 2C + O2 = 2CO;
C другими галогенами углерод непосредственно не соединяется, а соответствующие соединения получают косвенным путем. Четыреххлористый углерод получают пропусканием хлора через сероуглерод при 60ºС в присутствии катализатора FeS: CS2 + 2Cl2 = CCl4 + 2S.
При высокой температуре углерод взаимодействует с серой, азотом и кремнием:
C + 2S = CS2; 2C + N2 = C2N2 или (СN)2; C + Si = SiC (2000ºС).
С металлами углерод реагирует при высоких температурах, образуя карбиды. Карбиды также можно получить при взаимодействии угля с оксидами металлов:
3C + CaO = CaC2 + CO.
Углерод взаимодействует, как восстановитель, и с оксидами других металлов при нагревании: C + 2PbO = 2Pb + CO2.
Углерод растворяется только в кислотах-окислителях при нагревании:
С + 2H2SO4 (конц.) = CO2↑+ 2SO2↑+ 2H2O;
C + 4HNO3 (конц.) = CO2↑ + 4NO2↑ + 2H2O.
Углеводороды являются достаточно стабильными, так как перекрывание малых по размеру валентных орбиталей велико, различие в электроотрицательностях углерода и водорода мало, поэтому образуются прочные ковалентные связи С−Н.
Прямой синтез метана (простейшего углеводорода) можно осуществить только в присутствии катализатора, например мелкодисперсного никеля. Разнообразие углеводородных соединений объясняется способностью углерода к образованию бесконечных линейных и разветвленных цепочек (−С−С−, >С=С< и −C≡C−) замыканию их в циклы с одинарными или кратными связями между атомами углерода как в гомоатомных, так и в гетероатомных соединениях (ароматические соединения с делокализованными π-связями).
Сам метан не реагирует с водой, кислотами и щелочами, с кислородом взаимодействует только при поджигании. Ненасыщенные углеводороды являются более реакционноспособными, чем углеводороды ряда метана. Их примеси могут служить причиной самовоспламенения болотного газа (метана) в природных условиях.
С менее электроотрицательными элементами углерод образует соединения, которые называют карбидами. Их можно разделить на 3 группы.
Ионно-ковалентные карбиды (солеподобные) –к ним относят метаниды и ацетилениды. Метаниды
можно рассматривать как производные метана, содержащие ион С−4 , например карбид бериллия Be2C или карбид алюминия Al4C3. Это тугоплавкие кристаллические вещества, которые реагируют с разбавленными кислотами с выделением метана:
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑.
Ацетилениды
— производные ацетилена состава М+12С2, М+2С2 и М+32(С2)3, содержат ион С2−2 (где М – это s- и d-металлыI и II группы периодической системы или Al+3). Ацетилениды детонируют даже в сухом виде, разлагаются водой и разбавленными кислотами:
CaC2 + 2H2O = Ca(OH)2 + C2H2.
Солеподобные карбиды получают при взаимодействии оксидов металлов с графитом при высокой температуре:
CaO + 3C = CaC2 + CO↑; 2 Al2O3 +9C = Al4C3 + 6CO.
Ацетилениды можно получить обменным взаимодействием ацетилена с солью соответствующего металла.
Металлоподобные карбиды – это карбиды d-металлов IV – VIII групп нестехиометрического состава, который изменяется в широких пределах; проявляют металлические свойства: металлический блеск, высокую твердость, высокие температуры плавления. Карбиды титана, ванадия, ниобия, молибдена и вольфрама характеризуются еще и высокой коррозионной устойчивостью.
Металлоподобные карбиды получают непосредственным взаимодействием металлов или их оксидов с углеродом в электропечах при высокой температуре:
3Fe + C = Fe3C; V2O5 + 7C = 2VC + 5CO.
Карбиды состава M3C (где металл имеет небольшой радиус) термически и химически менее устойчивы, например, разлагаются разбавленными кислотами, выделяя смесь углеводородов с достаточно длинными цепями.
Ковалентные карбиды с атомной кристаллической решеткой – B4C и SiC – продукты частичного замещения атомов углерода в структуре алмаза на атомы бора или кремния. Карбид бора очень тверд, царапает алмаз, химически достаточно инертен. Карборунд по твердости близок к алмазу, но более хрупок, химически стоек и окисляется кислородом только при температуре свыше 1000ºС. При сплавлении со щелочью в присутствии кислорода карборунд разрушается с образованием карбоната и силиката. SiC растворяется только в смеси концентрированных плавиковой и азотной кислот, в царской водке.
Такие карбиды получают в электропечах при очень высокой температуре из смесей соответственно SiO2 или B2O3 с коксом, графитом или сажей.
Применение. Металлические карбиды придают сталям и чугунам твердость, износоустойчивость. Карбиды вольфрама и тантала используют для изготовления режущих инструментов и получения сверхтвердых сплавов. Карборунд используют как абразивный материал, как компонент огнеупорных материалов, в качестве стержней сопротивления в электронагревательных приборах.
Интересные соединения
Карбид натрия. Формула этого соединения C2Na2. Это можно представить скорее как ацетиленид (то есть продукт замещения атомов водорода в ацетилене на атомы натрия), а не карбид. Химическая формула полностью не отражает этих тонкостей, поэтому их надо искать в строении. Это очень активное вещество и при любом контакте с водой очень активно взаимодействует с ней с образованием ацетилена и щёлочи.
Карбид магния. Формула: MgC2. Интересны способы получения этого достаточно активного соединения. Один из них предполагает спекание фторида магния с карбидом кальция при высокой температуре. В результате этого получаются два продукта: фторид кальция и нужный нам карбид. Формула этой реакции достаточно проста, и вы можете при желании ознакомиться с ней в специализированной литературе.
Если вы не уверены в полезности изложенного в статье материала, тогда следующий раздел для вас.
Что такое карбид. Свойства карбида. Применение карбида
Забава детства. Так многие вспоминают о карбиде, особенно бывшие мальчишки, а ныне, конечно, взрослые мужчины.
Они брали камешки на строительных рынках. Покупать не покупали, а так, таскали с развалов и из кузовов грузовиков.
Добычу клали в бутылки, заливали водой, закрывали, встряхивали. Оставалось кинуть тару и полюбоваться взрывом.
Любовались и белесыми пузырями, которые карбид давал, попадая в лужи. Однако, кому обязаны таким весельем, сорванцы прошлых лет, зачастую не знали.
Что такое карбид? Попробуем ответить на вопрос, кажущийся неважным в детстве.
Что такое карбид
Карбит – не конкретное вещество, а группа соединений элементов с углеродом. Последний должен быть более электроотрицательным, чем «сосед».
Это обязательное условие, исключающее из ряда карбидов галогениды и оксиды углерода.
Под электроотрицательностью понимается способность атома сдвигать к себе электроны других веществ.
Электротрицательность углерода равна 2,6. Это данные шкалы Полинга. Она выстроена с учетом, что ионность в ковалентной связи делает эту связь прочнее.
Получается, электротрицательность вторых элементов в карбидах должна быть меньше 2,6.
Большинство подходящих элементов – металлы. Но, около 15% карбидов их не содержат.
Внешне карбиды – кристаллические, как правило, бесцветные, прозрачные вещества. Блеск у них алмазный.
Им соединения обязаны углероду, который является основой не только карбидов, но и алмазов.
По сути, герои статьи являются бриллиантами, в которых часть атомов замещена другими элементами.
Есть и цветные дуэты с углеродом, к примеру, карбид железа. Это всем знакомый цемент. Окрас у соединения серый.
Получается, свойства карбидов могут разниться. Несовпадения рассмотрим в главе «Виды». Пока же, изучим общие характеристики класса соединений.
Свойства карбида
К общим свойствам карбидов относится твердость. Она может быть больше, или меньше, но всегда выше среднего.
У некоторых представителей группы показатель близок к корунду и алмазу. Это самые твердые минералы на земле.
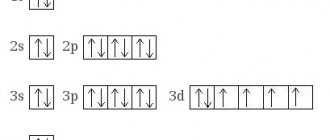
Особенно отличились карбиды переходных металлов. Это элементы побочных подгрупп периодической системы. У всех переходных металлов есть электроны на d- и f-орбиталях.
Обобщает карбиды и высокая температура плавления. Как правило, она выше, чем у входящего в соединение металла.
Если он из переходных, размягчение может начинаться лишь при 3000 градусов Цельсия.
Интересно, что температура плавления поднимается вместе с номером группы, к коей принадлежит «сосед» углерода.
Наиболее тугоплавкими являются карбиды с элементами из 5-7-ой групп таблицы Менделеева.
Где карбид можно понять по структуре соединений. Их решетки, зачастую, дефектны.
Это значит, есть отклонения от теоретической схемы, разрывы и смещения. Именно поэтому свойства карбидов могут в 100, а то и 1000 раз разниться с высчитанными по формулам.
Так, многие соединения класса устойчивы к коррозии и не растворяются в большинстве кислот.
Виды карбидов
Основных видов карбидов три. Первый – ковалентные соединения. Валентность – предрасположенность к определенному числу химических связей.
Ковалентная связь – это перекрытие валентных облаков разных элементов. То есть, у них образуются общие электронные пары. Именно такие лежат в основе ковалентных карбидов.
К ковалентным относятся карбиды лишь двух элементов: брома и кремния. Оба соединения химически инертны. Их межатомные связи прочны.
В итоге, карбиды группы трудно расплавить, — решетка не хочет рушиться. Прочность связи делает оба соединения твердыми.
Карбид брома даже соперничает с алмазом. Некоторые образцы углеродного соединения царапают бриллианты, то есть, тверже них.
Карбид кремния алмаз не «побеждает», но свои достойные 8 баллов по шкале Мооса имеет.
Растворяют ковалентные карбиды лишь плавиковая кислота, концентрированная азотная и царская водка. Окисление карбидов группы происходит лишь при нагреве до 1000 градусов.
Второй вид карбидов – ионный. Его, так же, именуют солеобразным. Все образованны металлами 1-ой и 2-ой групп таблицы Менделеева.
В класс включен и карбид алюминия. Соединения группы разлагаются не только кислотами, но и водой.
Камешки, заставляющие «закипать» лужи, к примеру, — карбид кальция. Он, кстати, довольно токсичен, может разъесть слизистые. Зачем же его завозят на строительные рынки, поймем в следующей главе.
При реакции ионных карбидов с водой выделяется водород. В жидкости формируется и выпадает в осадок гидроксид металла.
Реакция протекает бурно. Резкий выброс на поверхность воды водорода и дает то самое пузырение.
Третий вид карбидов – ионно-ковалентно-металлические, попросту, металлоподобные.
Такие соединения формируются элементами 4-ой, 5-ой, 6-ой, 7-ой групп периодической системы. Исключения: — карбиды никеля, кобальта и железа.
Если у ковалентных карбидов химическая активность низкая, а у ионных – высокая, то у третьего вида соединений она средняя.
Примечательно строение молекул. Их основа – атомы металла. Атомы же углерода находятся в пустотах между ними.
Поэтому, к примеру, карбид вольфрама называют внедренным. Имеется в виду, что углерод внедрился в кристаллическую решетку металла.
Такое строение обеспечивает рекордную прочность и высокую температуру плавления. Еще одно известное соединение группы – карбид титана.
Применение карбида
Карбид титана стал основой безвольфрамовых, но столь же твердых сплавов.
К тому же, соединение служит покрытием инструментария, в основном, промышленного и строительного.
Такое напыление сводит к минимуму износ деталей и позволяет обрабатывать ими даже самые твердые материалы.
Карбид кремния, так же, используют в качестве абразива. В природном виде, коим является минерал муассанит, соединение цениться ювелирами, причем, выше чем близкий по виду и свойствам фианит.
Карбид кальция нужен при сварочных работах. Из соединения получают ацетилен. Карбид служит его источником, а заодно, и топливом для машин кислородной сварки.
Ацетилен – газ. Одного его достаточно для работы аппаратов. Но, есть еще и вода. Карбид кальция вступает с ней в бурную реакцию.
Итог – не только пузырьки, нравящиеся детям, но и обилие тепла – еще одного источника энергии.
Карбид бора применяют в качестве огнеупора. Температура плавления соединения составляет почти 2500 градусов.
Прочность карбида позволяет добавлять его в бронежилеты. Защитить материал способен не только от пуль, но и радиации.
Поэтому, один из ответов на вопрос, где взять карбид бора, — в защитных экранах, задерживающих излучение.
Список карбидов и их роли в жизни общества может занять многие страницы. Соединений несколько десятков и у каждого из них есть применение, причем, не одно. Нет и единственной схемы получения карбидов.
Придется ограничиться общими фразами. Однако, и в них есть толика полезной информации.
Получение карбидов
Большинство карбидов именно получают, а не добывают. Первый синтез проведен в начале 19-го столетия.
Англичанин по фамилии Дэви получил карбид калия. В 1863-ем создали карбид меди.
Он оказался неустойчивым, в отличие от третьего синтезированного соединения углерода с железом.
Смотря на опытные образцы, ученые не могли понять, где найти карбид за пределами лабораторий.
Минералы, в которых металлы соединены с углеродом открыли лишь в начале 20-го века.
Кроме муассанита, геологи нашли когенит – смесь карбида кобальта с никелем и железом.
Судя по дате открытия карбидных минералов, они не являются распространенными.
Поэтому, в промышленных масштабах героев статьи до сих пор синтезируют. Масса карбида может получиться, к примеру, из древесного угля и оксидов металлов.
Они преобразуются в карбиды при помощи вольтовой дуги и электрической печи.
Цена карбида
Карбид кальция купить предлагают примерно за 40-90 рублей за килограмм. Соединение углерода с бором стоит от 100-та рублей за кило.
Купить карбид кремния предлагают примерно по 160 рублей за 1000 граммов.
А вот за кило карбида гафния придется выложить около 21 000 рублей, причем, при оптовых закупках.
То есть, стоимость материала во многом зависит от присутствующего в нем металла, или неметалла. Существует даже карбид золота.
Он, кстати, способен взорваться при простом пересыпании порошка. Так что, даже за большую цену, доставить сырье потребителю – задача не из легких.
Как это может быть полезно в жизни?
Ну, во-первых, знание химических соединений никогда не может быть лишним. Всегда лучше быть вооружённым знанием, чем остаться без него. Во-вторых, чем больше вы знаете о существовании определённых соединений, тем лучше понимаете механизм их образования и законы, которые позволяют им существовать.
Перед тем как перейти к окончанию, хотелось бы дать несколько рекомендаций по изучению этого материала.