Химическое соединение, имеющее формулу Al₄C₃, называется карбидом алюминия. Его внешний вид представлен желтоватым кристаллоидным веществом. Соединение является очень устойчивым к воздействию внешней среды, температура плавления алюмокарбида — 1400 °С, а относительная плотность составляет 2,36 г/см³. Структурная решетка Al₄C₃ сложно устроена, в её состав входят атомы углерода. Они выступают там в виде анионов. Карбид алюминия, как и другие неорганические соединения, имеет множество сфер применения. Это вещество относится к первой группе, отличие которой состоит в неизменённой валентности, типичной для металла в норме.
Карбид алюминия: получение вещества
Вещество можно получить при соединении металла с углеродом, которые необходимо поместить в дуговую печку. В составе карбида кальция тоже имеется незначительное содержание Al₄C₃. При получении электролитов соединение является продуктом коррозии графита. Реакция оксида алюминия с углеродом образует Al₄C₃. Следующим способом получения этого вещества является одновременное прокаливание кокса и алюминия при температуре от 1800 градусов. Его добывают специально обученные пиротехники и химики. Нельзя пытаться получить карбид алюминия в домашних условиях, а также в лабораториях, не предназначенных для этого.
Структура [ править ]
Карбид алюминия имеет необычную кристаллическую структуру, которая состоит из чередующихся слоев Al 2 C и Al 2 C 2 . Каждый атом алюминия координирован с 4 атомами углерода, образуя тетраэдрическое расположение. Атомы углерода существуют в 2 различных связывающих средах; один — деформированный октаэдр из 6 атомов Al на расстоянии 217 . Другой — искаженная тригонально-бипирамидальная структура из 4 атомов Al при 190–194 пм и пятого атома Al при 221 пм. [3] [4] Другие карбиды ( номенклатура IUPAC : метиды ) также обладают сложной структурой.
Реакции [ править ]
Карбид алюминия гидролизуется с выделением метана . Реакция протекает при комнатной температуре, но быстро ускоряется при нагревании. [5]
Al 4 C 3 + 12 H 2 O → 4 Al (OH) 3 + 3 CH 4
Подобные реакции происходят с другими протонными реагентами: [1]
Al 4 C 3 + 12 HCl → 4 AlCl 3 + 3 CH 4
Реактивное горячее изостатическое прессование (опрокидывание) при ≈40 МПа соответствующих смесей Ti, Al 4 C 3 графита в течение 15 часов при 1300 ° C дает преимущественно однофазные образцы Ti 2 AlC 0,5 N 0,5 , 30 часов при 1300 ° C. C дает преимущественно однофазные образцы Ti 2 AlC (карбид титана-алюминия ). [6]
Физические и химические свойства
Основным свойством вещества является его способность к взаимодействию с водой, кислородом и гидроксидом натрия. Кроме того, карбид алюминия может плавиться, преломляться и растворяться. Он имеет энтальпию образования ∆Н = -209 (S = 88,95), энергию Гиббса = -196 т, мольную теплоёмкость = 116,8. Показатель преломления карбида алюминия = 2,7 для 20 градусов. Al₄C₃ может вступать в связь со многими химическими элементами, образуя всем известные соединения, необходимые в промышленности. Примером является один из природных газов – метан. Его можно получить, если смешать карбид алюминия с водой. При этом Н2О выступает в качестве растворителя для металла, в результате основное соединение разлагается.
Алюминий. Химия алюминия и его соединений
1. Положение алюминия в периодической системе химических элементов 2. Электронное строение алюминия 3. Физические свойства 4. Нахождение в природе 5. Способы получения 6. Качественные реакции 7. Химические свойства 7.1. Взаимодействие с простыми веществами 7.1.1. Взаимодействие с галогенами 7.1.2. Взаимодействие с серой 7.1.3. Взаимодействие с фосфором 7.1.4. Взаимодействие с азотом 7.1.5. Взаимодействие с углеродом 7.1.6. Горение 7.2. Взаимодействие со сложными веществами 7.2.1. Взаимодействие с водой 7.2.2. Взаимодействие с минеральными кислотами 7.2.3. Взаимодействие с серной кислотой 7.2.4. Взаимодействие с азотной кислотой 7.2.5. Взаимодействие с щелочами 7.2.6. Взаимодействие с окислителями
Оксид алюминия 1. Способы получения 2. Химические свойства 2.1. Взаимодействие с основными оксидами 2.2. Взаимодействие с основаниями 2.3. Взаимодействие с водой 2.4. Взаимодействие с кислотными оксидами 2.5. Взаимодействие с кислотами 2.6. Взаимодействие с восстановителями 2.7. Вытеснение более летучих оксидов из солей
Гидроксид алюминия 1. Способы получения 2. Химические свойства 2.1. Взаимодействие с кислотами 2.2. Взаимодействие с кислотными оксидами 2.3. Взаимодействие с щелочами 2.4. Разложение при нагревании
Соли алюминия
Бинарные соединения алюминия
Алюминий
Положение в периодической системе химических элементов
Алюминий расположен в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение алюминия и свойства
Электронная конфигурация алюминия в основном состоянии:
+13Al 1s22s22p63s23p1 1s 2s 2p 3s 3p
Электронная конфигурация алюминия в возбужденном состоянии:
+13Al* 1s22s22p63s13p2 1s 2s 2p 3s 3p
Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.
Температура плавления 660оС, температура кипения 1450оС, плотность алюминия 2,7 г/см3.
Алюминий — один из наиболее ценных цветных металлов для вторичной переработки. На протяжении последних лет, цена на лом алюминия в пунктах приема непреклонно растет. По ссылке можно узнать о том, как сдать лом алюминия.
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Бокситы Al2O3 · H2O
(с примесями
SiO2, Fe2O3, CaCO3)
— гидрат оксида алюминия.
Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.
Способы получения
Алюминий
образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для
промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970оС) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
Al2O3 → Al3+ + AlO33-
На катоде происходит восстановление ионов алюминия:
Катод: Al3+ +3e → Al0
На аноде происходит окисление алюминат-ионов:
Анод: 4AlO33- — 12e → 2Al2O3 + 3O2
Суммарное уравнение электролиза расплава оксида алюминия:
2Al2O3 → 4Al + 3O2
Лабораторный способ
получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → Al + 3KCl
Качественные реакции
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами. При этом образуется белый аморфный осадок гидроксида алюминия.
Например, хлорид алюминия взаимодействует с гидроксидом натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
Al(OH)3 + NaOH = Na[Al(OH)4]
Обратите внимание, если мы поместим соль алюминия в избыток раствора щелочи, то белый осадок гидроксида алюминия не образуется, т.к. в избытке щелочи соединения алюминия сразу переходят в комплекс:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также выпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4+
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотретьздесь.
Химические свойства
1. Алюминий – сильный восстановитель. Поэтому он реагирует со многими неметаллами.
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
2Al + 3I2 → 2AlI3
1.2. Алюминий реагирует с серой с образованием сульфидов:
2Al + 3S → Al2S3
1.3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды:
Al + P → AlP
1.4. С азотом алюминий
реагирует при нагревании до 1000оС с образованием
нитрида:
2Al + N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
4Al + 3C → Al4C3
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
4Al + 3O2 → 2Al2O3
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
2.1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует. И мы уже упоминали, почему:из-за образования оксидной пленки. А вот если алюминий очистить от оксидной пленки (например, амальгамировать), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода:
2Al0 + 6H2+O → 2Al+3(OH)3 + 3H20
Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути (II):
3HgCl2 + 2Al → 2AlCl3 + 3Hg
Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль и водород.
Например, алюминий бурно реагирует с соляной кислотой:
2Al + 6HCl = 2AlCl3 + 3H2↑
2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2Al + 6H2SO4(конц.) → Al2(SO4)3 + 3SO2 + 6H2O
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
10Al + 36HNO3 (разб) → 3N2 + 10Al(NO3)3 + 18H2O
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
8Al + 30HNO3(оч.разб.) → 8Al(NO3)3 + 3NH4NO3 + 9H2O
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами. При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑
Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → 2NaAlO2 + 3H2↑ + 2Na2O
2.6. Алюминий восстанавливает менее активные металлы из оксидов. Процесс восстановления металлов из оксидов называется алюмотермия.
Например, алюминий вытесняет медь
из
оксида меди (II). Реакция очень экзотермическая:
2Al + 3CuO → 3Cu + Al2O3
Еще пример: алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
2Al + 3Na2O2 → 2NaAlO2 + 2Na2O
8Al + 3KNO3 + 5KOH + 18H2O → 8K[Al(OH)4] + 3NH3
10Al + 6KMnO4 + 24H2SO4 → 5Al2(SO4)3 + 6MnSO4 + 3K2SO4 + 24H2O
2Al + NaNO2 + NaOH + 5H2O → 2Na[Al(OH)4] + NH3
Al + 3KMnO4 + 4KOH → 3K2MnO4 + K[Al(OH)4]
4Al + K2Cr2O7 → 2Cr + 2KAlO2 + Al2O3
Оксид алюминия
Способы получения
Оксид алюминия можно получить различными методами:
1. Горением алюминия на воздухе:
4Al + 3O2 → 2Al2O3
2. Разложением гидроксида алюминияпри нагревании:
2Al(OH)3 → Al2O3 + 3H2O
3. Оксид алюминия можно получить разложением нитрата алюминия:
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
Химические свойства
Оксид алюминия — типичный амфотерный оксид. Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида алюминия с основными оксидами образуются соли-алюминаты.
Например, оксид алюминиявзаимодействует с оксидом натрия:
Na2O + Al2O3 → 2NaAlO2
2. Оксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом оксид алюминия проявляет кислотные свойства.
Например, оксид алюминиявзаимодействует с гидроксидом натрия
в расплаве с образованием
алюмината натрия и воды:
2NaOH + Al2O3 → 2NaAlO2 + H2O
Оксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
3. Оксид алюминия не взаимодействует с водой.
4. Оксид алюминия взаимодействуетс кислотными оксидами (сильных кислот). При этом образуются соли алюминия. При этом оксид алюминия проявляет основные свойства.
Например, оксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
Al2O3 + 3SO3 → Al2(SO4)3
5. Оксид алюминия взаимодействует с растворимыми кислотами с образованием средних и кислых солей.
Например, оксид алюминия реагирует с серной кислотой:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
6. Оксид алюминия проявляет слабые окислительные свойства.
Например, оксид алюминия реагирует с гидридом кальция с образованием алюминия, водорода и оксида кальция:
Al2O3 + 3CaH2 → 3CaO + 2Al + 3H2
Электрический ток восстанавливает алюминий из оксида (производство алюминия):
2Al2O3 → 4Al + 3O2
7. Оксид алюминия — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната натрия:
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
Гидроксид алюминия
Способы получения
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например, хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Na[Al(OH)4] + СО2 = Al(OH)3 + NaНCO3
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например, хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
AlCl3 + 3KOH(недост.) = Al(OH)3↓+ 3KCl
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами. Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
2AlBr3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaBr
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S↑ + 6NaCl
Химические свойства
1. Гидроксид алюминия реагирует с растворимыми кислотами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например, гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия
:
Al(OH)3 + 3HNO3 → Al(NO3)3 + 3H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Al(OH)3 + 3HBr → AlBr3 + 3H2O
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия
:
2Al(OH)3 + 3SO3 → Al2(SO4)3 + 3H2O
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом гидроксид алюминия проявляет кислотные свойства.
Например, гидроксид алюминиявзаимодействует с гидроксидом калия
в расплаве с образованием
алюмината калия и воды:
KOH + Al(OH)3 → KAlO2 + 2H2O
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
Al(OH)3 + KOH → K[Al(OH)4]
4. Гидроксид алюминия разлагается при нагревании:
2Al(OH)3 → Al2O3 + 3H2O
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.
Соли алюминия
Нитрат и сульфат алюминия
Нитрат алюминия при нагревании разлагается на оксид алюминия, оксид азота (IV) и кислород:
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
Сульфат алюминия при сильном нагревании разлагается аналогично — на оксид алюминия, сернистый газ и кислород:
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
Комплексные соли алюминия
Для описания свойств комплексных солей алюминия — гидроксоалюминатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоалюминат на две отдельные молекулы — гидроксид алюминия и гидроксид щелочного металла.
Например, тетрагидроксоалюминат натрия разбиваем на гидроксид алюминия и гидроксид натрия:
Na[Al(OH)4] разбиваем на NaOH и Al(OH)3
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы алюминия реагируют с кислотными оксидами.
Например, гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид алюминия не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Na[Al(OH)4] + CO2 → Al(OH)3↓ + NaHCO3
Аналогично тетрагидроксоалюминат калия реагирует с углекислым газом:
K[Al(OH)4] + CO2 → Al(OH)3 + KHCO3
По такому же принципу тетрагидроксоалюминаты реагирует с сернистым газом SO2:
Na[Al(OH)4] + SO2 → Al(OH)3↓ + NaHSO3
K[Al(OH)4] + SO2 → Al(OH)3 + KHSO3
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид алюминия реагирует с сильными кислотами.
Например, с соляной кислотой:
Na[Al(OH)4] + 4HCl(избыток) → NaCl + AlCl3 + 4H2O
Правда, под действием небольшого количества (недостатка) сильной кислоты осадок все-таки выпадет, для растворения гидроксида алюминия кислоты не будет хватать:
Na[Al(OH)4] + НCl(недостаток) → Al(OH)3↓ + NaCl + H2O
Аналогично с недостатком азотной кислоты выпадает гидроксид алюминия:
Na[Al(OH)4] + HNO3(недостаток) → Al(OH)3↓ + NaNO3 + H2O
Комплекс разрушается при взаимодействии с хлорной водой (водным раствором хлора) Cl2:
2Na[Al(OH)4] + Cl2 → 2Al(OH)3↓ + NaCl + NaClO + H2O
При этом хлор диспропорционирует.
Также комплекс может прореагировать с избытком хлорида алюминия. При этом выпадает осадок гидроксида алюминия:
AlCl3 + 3Na[Al(OH)4] → 4Al(OH)3↓ + 3NaCl
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-алюминат:
Na[Al(OH)4] → NaAlO2 + 2H2O↑
K[Al(OH)4] → KAlO2 + 2H2O
Гидролиз солей алюминия
Растворимые соли алюминия и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Al3+ + H2O = AlOH2+ + H+
II ступень: AlOH2+ + H2O = Al(OH)2+ + H+
III ступень: Al(OH)2+ + H2O = Al(OH)3 + H+
Однако сульфиды, сульфиты, карбонаты алюминия и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Al2(SO4)3 + 6NaHSO3 → 2Al(OH)3 + 6SO2 + 3Na2SO4
2AlBr3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + CO2↑ + 6NaBr
2Al(NO3)3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 6NaNO3 + 3CO2↑
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 6NaCl + 3CO2↑
Al2(SO4)3 + 3K2CO3 + 3H2O → 2Al(OH)3↓ + 3CO2↑ + 3K2SO4
2AlCl3 + 3Na2S + 6H2O → 2Al(OH)3 + 3H2S↑ + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Алюминаты
Соли, в которых алюминий является кислотным остатком (алюминаты) — образуются из оксида алюминия при сплавлении с щелочами и основными оксидами:
Al2O3 + Na2O → 2NaAlO2
Для понимания свойств алюминатов их также очень удобно разбить на два отдельных вещества.
Например, алюминат натрия мы разделим мысленно на два вещества: оксид алюминия и оксид натрия.
NaAlO2 разбиваем на Na2O и Al2O3
Тогда нам станет очевидно, что алюминаты реагируют с кислотами с образованием солей алюминия:
KAlO2 + 4HCl → KCl + AlCl3 + 2H2O
NaAlO2 + 4HCl → AlCl3 + NaCl + 2H2O
NaAlO2 + 4HNO3 → Al(NO3)3 + NaNO3 + 2H2O
2NaAlO2 + 4H2SO4 → Al2(SO4)3 + Na2SO4 + 4H2O
Под действием избытка воды алюминаты переходят в комплексные соли:
KAlO2 + H2O = K[Al(OH)4]
NaAlO2 + 2H2O = Na[Al(OH)4]
Бинарные соединения
Сульфид алюминия под действием азотной кислоты окисляется до сульфата:
Al2 S3 + 8HNO3 → Al2(SO4)3 + 8NO2 + 4H2O
либо до серной кислоты (под действием горячей концентрированной кислоты):
Al2 S3 + 30HNO3(конц. гор.) → 2Al(NO3)3 + 24NO2 + 3H2SO4 + 12H2O
Сульфид алюминия разлагается водой:
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
Карбид алюминия также разлагается водой при нагревании на гидроксид алюминия и метан:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
Нитрид алюминия разлагается под действием минеральных кислот на соли алюминия и аммония:
AlN + 4HCl → AlCl3 + NH4Cl
Также нитрид алюминия разлагается под действием воды:
AlN + 3H2O → Al(OH)3↓ + NH3
Сферы применения карбида алюминия
Al₄C₃ используется в различных видах промышленности. При получении алюмокарбида с помощью частиц графита образуется очень прочный материал. Инструменты, в состав которых входит это соединение, имеют такую же твёрдость, как топаз. Обычно алюмокарбид добавляют в режущие предметы, используемые на станках, в качестве медицинского оборудования и т. д. Помимо этого, данное соединение — необходимый материал в пиротехнике. Оно используется в указанной сфере с давнего времени, и до сих пор не нашлось ему замены. Здесь алюмокарбид необходим для получения искр. Его присутствие в пиротехнических работах зависит от того, для чего и в каком количестве используется порох. Ещё одной сферой применения вещества является химическая промышленность, где соединение необходимо для образования различных продуктов, в частности органических газов.
Примеры решения задач
| Задание | Молярная масса соединения азота с водородом равна 32 г/моль. Определите молекулярную формулу вещества, массовая доля азота в котором составляет 85,7%. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
Вычислим массовую долю водорода в соединении:
ω (H) = 100% — ω(N) = 100% — 85,7% = 14,3%.
Обозначим количество моль элементов, входящих в состав соединения за «х» (азот), «у» (водород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
Значит простейшая формула соединения азота с водородом будет иметь вид NH2 и молярную массу 16 г/моль [M(NH2) = Ar(N) + 2×Ar(H) = 14+ 2×1 = 14 + 2 = 16 г/моль].
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Значит индексы атомов азота и водорода должны быть в 2 раза выше, т.е. формула вещества будет иметь вид N2H4. Это гидразин.
| Задание | Установите массовую формулу вещества, содержащего 26,5% калия, 35,4% хрома и 38,1% кислорода. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
Обозначим количество моль элементов, входящих в состав соединения за «х» (калий), «у» (хром) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(K)/Ar(K) : ω(Cr)/Ar(Cr) : ω(O)/Ar(O);
Значит формула соединения калия, хрома и кислорода будет иметь вид KCrO4. Это хромат калия.
Источник
Что такое метан?
Данное соединение относится к группе органических, по структуре оно является простым углеводородом и имеет формулу СН4. Метан мало реагирует с водой, не имеет запаха и цвета. Газ относится к группе алканов, достаточно устойчив к воздействию различных химических реакций. Считается, что метан неопасен для здоровья человека, тем не менее некоторые учёные утверждают обратное. У людей, имеющих постоянный контакт с газом, наблюдаются изменения со стороны центральной нервной системы. Метан является взрывоопасным, поэтому на промышленных производствах необходимо тщательно следить за его концентрацией в воздухе. В связи с тем, что газ не имеет запаха, заметить утечку достаточно трудно. По этой причине на предприятиях устанавливают специальные датчики, регистрирующие его уровень.
Физические свойства
При выборе практически любого материала следует уделять больше всего внимания физическим свойствам. У рассматриваемого они следующие:
- Соединение имеет кристаллическую структуру.
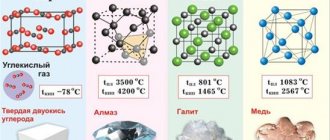
- Показатель температуры плавления составляет 2300 °С. Стоит учитывать, что подобная цифра свойственна только чистому составу. Добавление в состав различных примесей приводит к тому, что температура плавления существенно падает.
Стоит учитывать, что карбид кальция в большинстве случаев находится в твердом состоянии. Кроме этого, цвет может варьироваться от серого до коричневого цвета. Физические свойства карбида кальция определяют его широкое применение в самых различных отраслях промышленности.
Способы получения метана
В связи с тем, что газ является природным соединением, его не всегда добывают лабораторным путём. Метан получается в анаэробных условиях, это осуществляется в результате бродильных процессов в болотах, кишечнике животных, чересчур влажной земле. По словам учёных, один из спутников Сатурна содержит на своей поверхности жидкие смеси, содержащие этот газ. Также метан является одной из составляющих частей атмосфер крупных планет. Самое большое содержание метана наблюдается в природном, рудничном и болотном газах. В промышленных условиях газ получают путём гидрирования и коксования угля.
Добыча метана осуществляется и в лабораториях. Один из способов его получения – это нагревание уксусной кислоты и гидроксида натрия (или извести). Последнее вещество также соединяют с ацетатом в результате плавления, в результате чего тоже образуется метан. Оба способа не требуют присутствия воды. Третий метод получения газа – это гидролиз, которому подвергается карбид алюминия. Метан в этом случае образуется быстрее. Метод гидролиза является также менее затратным, так как не требует воздействия высоких температур.
КАРБИДЫ, профессиональные вредности
КАРБИДЫ, профессиональные вредности
,— соединения углерода с металлами и нек-рыми неметаллами, которые могут оказывать неблагоприятное действие на организм человека. Естественные К. обнаруживаются в составе глубинных пород земной коры, иногда в метеоритах. Получают К. гл. обр. нагреванием порошков металлов и углерода (уголь, сажа) в среде инертного или восстановительного газа. К. применяются в ядерной технике, космонавтике, электронике, в технике высоких температур, машиностроении, металлургии, а также для получения ацетилена (см. Ацетилен) и цианамида (см. Дефолианты).
По характеру взаимодействия с водой К. подразделяют на разлагаемые и неразлагаемые. К разлагаемым водой относят К. щелочных и щелочноземельных металлов (кальция, стронция, бария), а также магния, бериллия, алюминия, лантаноидов и актиноидов. К не разлагаемым водой относят ковалентные К. бора и кремния, а также К. d-переходных металлов IV — VIII групп периодической системы Д. И. Менделеева.
В производстве К. возможно выделение пыли исходных компонентов, готового продукта и газов (окиси углерода). Имеет место интенсивное тепловыделение.
Пыль разлагаемых водой К. (особенно CaC2) вызывает раздражение слизистой оболочки дыхательных путей, в особенности полости носа, а также слизистых оболочек глаза. Дополнительное токсическое действие обусловлено вдыханием ацетилена. При попадании на кожу, особенно влажную, пыль К. вызывает раздражение, изъязвления и воспалительную реакцию. При получении и применении К. кальция предусматривают мероприятия по предупреждению поступления в воздух пыли, ацетилена и других газов. Необходима защита кожи и слизистых оболочек при работе с разлагаемыми водой К.
В производстве изделий из К. используют технологию порошковой или плазменной металлургии. Обработку изделий из К. осуществляют абразивным, ультразвуковым или электроискровым способами. При дроблении К., взвешивании компонентов шихты, просеве, загрузке и выгрузке, упаковке, обработке образуется аэрозоль дезинтеграции. При обслуживании электродуговых печей регистрируется низкочастотный шум (см. Шум). При отливке расплавленных К. возможно выделение паров углеводородов и окиси углерода.
Применения карбида алюминия в производственной химии
Помимо гидролиза соединения, его можно использовать и в качестве реагента. Такое применение карбида алюминия необходимо для определения содержания некоторых веществ. В частности, так можно обнаружить ценный газ — тритий, который присутствует в воде. Помимо этого, из карбида алюминия можно получить комбинированную соль. Она получается, как и метан, путём соединения вещества с водой. Данная соль называется тетрагидроксоалюминат натрия. Она необходима для придания окраски тканям. Производство и применение карбида очень важны для различных сфер промышленности, поэтому затраты на его получение достаточно велики. Средства на приобретение вещества выделяются государством.
Химические свойства карбида алюминия. Химические реакции карбида алюминия:
Химические свойства карбида алюминия аналогичны свойствам карбидов других металлов . Поэтому для него характерны следующие химические реакции:
1. реакция карбида алюминия и водорода:
В результате реакции образуются алюминий и метан.
2. реакция карбида алюминия и кислорода:
В результате реакции образуются оксид алюминия и оксид углерода (IV).
3. реакция карбида алюминия и хлора:
В результате реакции образуются хлорид алюминия и хлорид углерода (IV) (тетрахлорметан).
4. реакция карбида алюминия, гидроксида натрия и воды:
В результате реакции образуются тетрагидроксоалюминат натрия и метан.
5. реакция карбида алюминия и азотной кислоты:
В результате реакции образуются нитрат алюминия и метан .
Аналогичные реакции карбида алюминия происходят и с другими кислотами.
6. реакция разложения карбида алюминия (реакция карбида алюминия и воды):
В результате реакции разложения карбида алюминия (реакции карбида алюминия и воды) образуются гидроксид алюминия и метан. Данная реакция представляет собой лабораторный способ получения метана.
7. реакция термического разложения карбида алюминия:
Al4C3 → 4Al + 3C (t > 2200 о С).
В результате реакции термического разложения карбида алюминия образуются алюминий и углерод .
Что такое карбид?
Самодельные бомбы. Вот, что приходит на ум первым делом, когда слышим слово карбид. И нет, занимались производством этих опасных игрушек не предприятия оборонной промышленности, а, как правило, мальчишки, лет так десяти.
Лет двадцать назад это было излюбленное развлечение у подростков. Это сейчас все сидят за своими планшетами, а тогда миром правил пытливый ум ребенка, который норовил все испробовать на практике.
Для того, чтобы почувствовать себя Рембо, требовалось раздобыть один чудо-камешек. Находили их дети чаще всего на стройках. А дальше все было просто: пластиковый сосуд, камень, вода, плотно закрученный колпачок. Все это рьяно трясли, и в лучшем случае, отбрасывали куда подальше. А в худшем «снаряд» разрывало прямо в руках, тогда травм было не избежать.
Читать также: Алюминий это сплав или металл
Были и более безопасные пути использовать находку, к примеру, просто бросить в лужицу, тогда можно было наблюдать нечто похожее на действие современных бомбочек для ванны. Так что это за популярная «игрушка». Большинство из нас считали, что таким, как мы его знаем, карбид произвела природа. Но на самом деле это не так. И сегодня Вы в этом убедитесь.
Итак, вещество это всегда очень твердое, плюс ко всему, чтобы его расплавить, нужно приложить недюжинные усилия. На вид это темные, светлые, зеленоватые камни, либо порошок, все зависит от состава. Срок его годности недолог, как правило это полгода. Уложить емкости в общий склад не получится, у таких потенциально опасных веществ должен быть свой отсек.
Как Вы уже знаете, карбид постоянно норовит взорваться. Причем, некоторым соединениям даже особых условий не надо. Достаточно просто пересыпать порошок из тары в тару, как он может неожиданно рвануть.
Нахождение в природе
Природный алюминий состоит практически полностью из единственного стабильного изотопа 27Al со следами 26Al, радиоактивного изотопа с периодом полураспада 720 тыс. лет, образующегося в атмосфере при бомбардировке ядер аргона
протонами космических лучей.
По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры.
В природе алюминий встречается только в соединениях (минералах). Некоторые из них:
- Бокситы — Al2O3 • H2O (с примесями SiO2, Fe2O3, CaCO3)
- Нефелины — KNa3[AlSiO4]4
- Алуниты — KAl(SO4)2 • 2Al(OH)3
- Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
- Корунд — Al2O3
- Полевой шпат (ортоклаз) — K2O×Al2O3×6SiO2
- Каолинит — Al2O3×2SiO2 × 2H2O
- Алунит — (Na,K)2SO4×Al2(SO4)3×4Al(OH)3
- Берилл — 3ВеО • Al2О3 • 6SiO2
В природных водах алюминий содержится в виде малотоксичных химических соединений, например, фторида алюминия. Вид катиона или аниона зависит, в первую очередь, от кислотности водной среды. Концентрации алюминия в поверхностных водных объектах России колеблются от 0,001 до 10 мг/л.
Транспортировка и хранение
Порошок карбида кальция при воздействии влаги практически моментально разлагается. При этом образуется ацетилен, который при большой концентрации горюч и взрывоопасный. Именно поэтому нужно уделять довольно много внимания хранению карбида кальция, для чего часто применяют бидоны и специальные барабаны. К другим особенностям хранения отнесем следующие моменты:
- Выделяющийся ацетилен легче воздуха, поэтому скапливается вверху. Стоит учитывать, что он обладает наркотическими действиями, может самовоспламеняться.
- При производстве большого объема вещества особое внимание уделяется технике безопасности. Для фасовки применяются специальные упаковки.
- Для открытия упаковки следует использовать инструменты, которые не становятся причиной образования искр.
- Если вещество попадает на кожу или слизистую оболочку, то его нужно сразу удалить. При этом пострадавшая поверхность обрабатывается специальным кремом или другим защитно-заживляющим веществом.
- По установленным правилам, транспортировка может проводится исключительно при применении крытого транспортного средства. При этом проводить доставку по воздуху запрещается.
Контейнер для транспортировки
Установленные правила также запрещают хранить карбид кальция вместе с другими химическими веществами и источниками тепла. Это связано с тем, что образующиеся газы могут вступать в химическую реакцию с другими химическими веществами и возгораться.