Химические свойства щелочных металлов: взаимодействие, получение
Щелочные металлы находятся в первой группе периодической таблицы. Атомы этих элементов содержат один электрон на внешнем энергетическом уровне. Он расположен на большом расстоянии от ядра. Как и все металлы являются восстановителями и легко отдают электрон. Характерна степень окисления равная +1. В группе сверху вниз наблюдается увеличение металлических свойств. За счет растущей энергии ионизации способность отдавать электроны, а следовательно, электроотрицательность возрастают снизу вверх.
Франций является самым активным металлом, так как у него электрон находится на самом далеком расстоянии от ядра. Соответственно, его способность к восстановлению самая высокая.
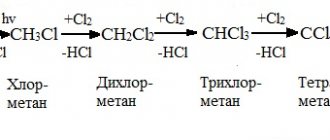
- В нормальных условиях щелочные металлы взаимодействуют с кислородом. Они очень активны в таких реакциях, поэтому их хранят под слоем вазелинового масла. Продукты реакции могут быть оксидами или пероксидами.
4Li + O2 → 2Li2O 2Na + O2 → Na2O2 - Щелочные металлы вступают с водой в реакцию при нормальных условиях. Водород вытесняется из воды, и в качестве продукта реакции образуется растворимое основание – щелочь. Для распознавания щелочи можно использовать индикатор — фенолфталеин. При добавлении в раствор он окрашивается в малиновый цвет. Реакции с водой протекают очень бурно, литий «взрывается» в воде, натрий «кипит». При этом водород выделяется в виде белого пара клубами.
2Na + 2H2O → 2NaOH + H2↑ 2Li + 2H2O → 2LiOH + H2↑ - Вступают в реакции с галогенами, образуя галогениды.
2K + Cl2 → 2KCl 2Na + Cl2 → 2NaCl - Характерно взаимодействие с водородом при нагревании, продуктом реакции являются гидриды. Например, продуктом реакции калия и водорода будет гидрид калия.
H2↑ + 2K → 2KH - С серой при нагревании образуют сульфиды. Это твердое, бесцветное вещество, растворимое в воде.
2Na + S → Na2S - При нагревании происходит реакция с фосфором, фосфиды являются продуктом.
3K + P → K3P - Литий и натрий могут вступать в реакцию с углеродом при нагревании. В результате образуются карбиды. Остальные щелочные металлы в эти реакции не вступают.
2Li + 2C → Li2C2 - С азотом при обычных условиях реагирует только литий, с остальными щелочными металлами реакция возможна только при нагревании.
6Li + N2 → 2Li3N - Взаимодействуют со спиртами, образуя алкоголяты.
2C2H5OH + 2Na = 2C2H5ONa + H2↑Многие щелочные металлы способны взаимодействовать с разбавленными кислотами до образования водорода. Однако, реакция протекает стадийно, т.е. сначала металл реагирует с водой до образования щелочи, а затем происходит нейтрализация щелочи кислотой. Взаимодействие с кислотами сопровождается взрывом и поэтому такие реакции на практике не проводятся.
Получение
- Основным методом получения щелочных металлов является электролиз галогенидных расплавов. При этом чаще всего используются хлориды, входящие в состав природных минералов.
- Другими способами получения щелочных металлов могут быть получение из его оксидов и солей.
Например, натрий можно получить путем кальцинирования соды с углем.Na2CO3 + 2C → 2Na + 3CO↑
Литий получают из его оксида при повышении температуры до 300°С.
2Li2O + Si + 2CaO → 4 Li + Ca2SiO4
От Турции до Египта
История открытия металла затерялась в веках. Кто первый обнаружил металл, кто догадался «обстучать» самородок, чтоб из него получилось лезвие или другой инструмент — неизвестно. Тем более никто не знает, кто додумался «сварить» самородок и залить жидкий металл в форму.
Следующая загадка — кто первым стал плавить из руды металл. Зато известно, что самые древние находки медных изделий и шлак от плавки археологи нашли в современной Турции. Древность несусветная — им до 10 000 лет.
Почему медь?
Племена, жившие в Европе в древности, называли медь и любые металлы «мида». В старинных русских текстах слово «медь» также встречается. Ученые считают слово родственным древнегерманскому «smid» (кузнец); либо производным от Мидия — страны на территории нынешнего Ирана.
По-латыни медь называют купрум (aes cuprium), от острова Кипр. Там было богатое месторождение металла. Плиний пишет:
«…Известно, сколь долго римский народ пользовался лишь медной монетой. Сама древность свидетельствует о важном значении этого металла».
Долгое время главная расхожая монета Римской империи называлась асс (aes).
Сейчас «медь» и «купрум» мирно делят принадлежность к цветному металлу.
Химические свойства щелочноземельных металлов: взаимодействие, получение
Главную подгруппу второй группы периодической системы химических элементов образуют металлы, которые получили название щелочноземельных.
Так названы они потому, что гидраты их окислов («земель»), подобно гидратам окислов щелочных металлов, являются щелочами.
Внешний электронный слой их атомов состоит из двух электронов. Отдавая их, атомы этих металлов превращаются в ионы, несущие две единицы положительного заряда. Во всех своих соединениях металлы подгруппы бериллия положительно двухвалентны. В периодической таблице они соседствуют с щелочными металлами. Поэтому эти элементы проявляют высокую химическую активность, уступая в ней только щелочным металлам. Свойства металла повышаются с увеличением порядкового номера.
- Вступают в реакции с кислородом, продуктом реакции становятся оксиды, исключение барий, он образует пероксид BaO2. Бериллий и магний взаимодействуют с кислородом только при очень высоких t, так как покрыты тонкой защитной оксидной пленкой.
2Ca + O2 → 2CaOВ приведенной выше реакции кусочек кальция сгорает с образованием белого дыма при нагревании. Он образован тончайшими твердыми частицами оксида кальция.
- Подобно щелочным металлам взаимодействуют с водой, но менее активно. В результате образуется гидрат оксида и вытесняется водород.
Ca + 2H2O → 2Ca(OH)2 + H2↑Фенолфталеин окрашивается в полученном растворе в малиновый цвет. Этот пример оправдывает ожидаемое сходство в химических свойствах щелочноземельных и щелочных металлов: оба взаимодействуют с водой с выделением водорода. Гидраты оксидов щелочноземельных металлов, как и щелочи, являются щелочами, то есть они растворимы в воде.
- Все металлы, кроме бериллия, вступают в реакцию с галогенами. Бериллий взаимодействует с галогенами только при повышенных температурах. Продуктом реакции являются галогениды.
Ca + Cl2 → CaCl2 - При нагревании с водородом реагируют все щелочноземельные металлы, кроме бериллия. В результате образуются гидриды.
Ca + H2 → CaH2 - Реагируют с серой, в результате чего образуются сульфиды.
Ca + S → CaS - Взаимодействуют с азотом при нагревании, за исключением магния. Он реагирует с азотом в нормальных условиях. Продуктом реакции являются нитриды.
3Be + N2 → Be3N2 3Mg + N2 → Mg3N2
- Могут вступать в реакции с кислотами, в результате образуют соли соответствующей кислоты и водород.
Be + H2SO4 (разб.) → BeSO4 + H2↑
Получение
Основными способами получения металлов второй группы главной подгруппы являются электролиз расплавов, алюминотермия и вытеснение из их солей другими более активными металлами.
CaO + Al → Al2O3 + Ca
MgBr2 + Ca → CaBr2 + Mg
Ищем медь
Запасы металла на земле немалые. В их число входит самородная медь (ее скопления могут достигать 400 тонн — бери готовую).
Нет самородной, к услугам человека содержащие медь минералы:
Химические свойства алюминия
Алюминий находится в третьей группе периодической системы элементов. Заряд ядра атома алюминия +13, на внешнем электронном слое три электрона.
По строению атомов и положению в периодической системе можно предположить, что у элементов третьей группы металлические свойства должны быть выражены слабее, чем у элементов второй группы. Это действительно так.
При химических реакциях атом алюминия отдает три электрона внешнего слоя, обращаясь в трех зарядный положительный ион Al3+. Поэтому во всех его устойчивых соединениях алюминий положительно трехвалентен. Его соединения проявляют амфотерные свойства.
Алюминий – химически активный металл и проявляет себя как восстановитель. Однако его активность снижает оксидная пленка, которая образуется на его поверхности. Поэтому во многих реакциях пленка сначала удаляется, а затем осуществляется взаимодействие с веществами. Рассмотрим на конкретных примерах химические свойства алюминия.
- Алюминий соединяется с кислородом воздуха и при нагревании и при обыкновенной температуре. На его поверхности быстро образуется тончайшая плотная пленка окиси алюминия. Она трудно проницаема для газов и защищает металл от дальнейшего окисления.
В раздробленном состоянии и при повышенной температуре алюминий бурно реагирует с кислородом с выделением большого количества тепла. В результате образуется окись алюминия.4Al + 3O2 → 2Al2O3
- Со многими неметаллами реакции происходят при нагревании.
2Al + 3S → Al2S3 Al + P → AlP 2Al + N2 → 2AlN 4Al + 3C → Al4C3 - С водой взаимодействует при удалении оксидной пленки. Реакция протекает энергично, вытесняя водород из воды.
2Al + 6H2O → 2Al(OH)3↓ + 3H2 - Взаимодействие с кислотами. Опустим алюминиевые стружки в пробирку с соляной или разбавленной серной кислотой. Алюминий растворяется, вытесняя из кислоты водород и образуя соль.
2Al + 6HCl → 2AlCl3 + 3H2↑ 2Al +3H2SO4(разб.)→ Al2(SO4)3 + 3H2↑С концентрированной азотной и серной кислотой не реагирует. Поэтому концентрированная азотная кислота хранится в алюминиевых емкостях и транспортируется в алюминиевых резервуарах.
С разбавленной азотной кислотой вступает в реакцию с образованием
N2O, N2 или NH4NO3. 8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O
- Поскольку алюминий обладает амфотерными свойствами, он характеризуется реакциями со щелочами.
2Al + 2NaOH + 10H2O → 2Na[Al(H2O)2(OH)4] + 3H2↑ - Алюминий взаимодействует с окислами большинства металлов, вытесняя менее активный металл. Этот метод используется в промышленности для получения металлов и называется алюминотермией.
2Al + Fe2O3 → 2Fe + Al2O3
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Как выплавить купрум
- пирометаллургический (с его помощью производят 90% металла);
- гидрометаллургический, оставшиеся 10%.
Гидрометаллургия состоит из единственного этапа — обработки руды (обычно бедной) разбавленной серной кислотой с последующим выделением из раствора металлической меди. При этом все попутные вещества из руды просто пропадают.
Пирометаллургия сложнее, там несколько этапов:
- Обогащение методом флотации и окислительного обжига.
- Плавка на штейн при температуре до 1500 градусов. Здесь уже выделяют черновой металл, а также сопутствующие серебро, золото, никель.
- Огневое рафинирование — очистка полученного металла от примесей до чистоты 99,5%.
- Электролитическое рафинирование, доведение чистоты до 99,95%.
Месторождения и добыча
Происхождение медных руд разнообразное. Они бывают оксидные, сульфидные, смешанные. Больше всего на земле сульфидных руд (около 90%), в них богатые руды. Не уступают содержанием металла окисленные минералы.
Крупные месторождения есть в Чили (прогнозируемые запасы больше 5 миллионов тонн).
Богатейшие месторождения самородной меди находятся в США (озеро Верхнее), на острове Ванкуве (Канада), Корокоро (Боливия).
Самородная «космическая» медь найдена в метеоритах и на Луне.
В России добыча металла ведется в Красноярском крае (все тот же «Норникель»).
Применение металла: от телеграфа до фейерверков
Широкое применение меди началось после изобретения телеграфа. Понадобились огромные объемы металла для телеграфных проводов. С этого времени наш герой не покидает первого места в рейтинге электротехнических металлов.
Применение меди основано на ее свойствах. Электропроводка в старых домах; сейчас дорогой металл заменяют на дешевый алюминий. А вот в приборах медные проводки присутствуют. Компьютеры оснащены медными теплоотводами.
Сантехническое оборудование, холодильная техника, кондиционеры — везде задействован цветной металл с его замечательными свойствами.
Корабли и кораблики гордятся медными трубопроводами (в них течет жидкость и газ).
А во многих странах медные трубы применяют для водо- и газоснабжения зданий.
Без меди не будет твердого припоя (это «клей» для металлов).
Диоскурид писал: «Из детской мочи и кипрской меди приготовляется припой для золота».
Япония считает медные трубы газопроводов сейсмостойкими.
Медь применяют как лигатуру для золотых сплавов; чистое золото слишком мягкий и склонный к истиранию металл.
Оранжевый цветной металл дает синий цвет пиротехническим изделиям.
Чего мы не знали о меди
Одно из преимуществ удивительного металла — изготовленные из него инструменты не дают искр при ударе. Разумно использовать их там, где есть вероятность взрыва.
Шведские ученые придумали способ захоронения радиоактивных отходов. Сейчас на это тратятся огромные средства. А можно просто помещать радиоактивный хлам в медные капсулы с толщиной стенок 5 сантиметров. По расчетам, коррозия их разрушит не раньше, чем через полмиллиона лет.
Многие знают, что Статуя Свободы (та самая, с факелом и в короне) изготовлена из меди. Не целиком, конечно, цветной металл только сверху, внутри стальные конструкции. Ходили слухи, что изготовлена она из уральского металла, но… Официально признано, что тот цветмет из Норвегии.
Вот случай, когда вроде полезное свойство нашего героя стало недостатком. Норвежское грузовое судно затонуло по вине медной руды, которую и везло. Виновата электрохимия. Медь из руды создала гальваническую пару с металлическим корпусом судна, электролитом послужили испарения морской воды. Возникший ток спровоцировал такую коррозию, что она проела обшивку, и в трюмы хлынула вода.
Модникам и модницам
Секрет джинсов «Gold Vision-3000» в медном биокорсете. Медные нити, «встроенные» в модные штаны, помогают предотвращать сосудистые патологии, стимулируют работу органов малого таза. А они влияют на пищеварение, половую функцию, кроветворение, уменьшают вредное воздействие бытовых приборов, влияние электромагнитных полей.
Сплавы, лигатуры…
Медь входит в состав множества сплавов:
- мельхиор;
- латунь;
- бронза;
- латтен (латон);
- нейзильбер (применяют в ювелирном деле);
- абиссинское золото;
- французское золото;
- северное золото.
Свойства металла, входящих в сплав, позволяют металлургам «сочинять» требуемые характеристики.
Медь стоит недешево, потому производители предпочитают медные сплавы (там, где это возможно).
В некоторых областях сплавы (особенно с алюминием) уверенно обогнали чистый металл. «Маме»-меди не сравниться с коррозионной стойкостью, прочностью, ковкостью сплавов.
Голубая кровь
Это выражение слышали все. Не все знают, что кровь голубого цвета есть в действительности, но не у людей. Белок гемоцианин окрашивает в голубой цвет кровь моллюсков, многоножек, паукообразных. Сам гемоцианин — аналог гемоглобина, который делает нашу кровь красной.
Без нашего героя человек не смог бы выжить и как биологический вид. Металл способствует усвоению белков, углеводов, укрепляет иммунитет. Не зря наши прабабки варили варенье в медных тазах, ведь металл обладает антисептическими свойствами.
Ионы металла обладают антигрибковыми и противовирусными свойствами, способны проникать через клеточную мембрану и уничтожают распространителей заразы.
Уже существует ткань, содержащая медные нити. Вечернего платья и костюма из нее не сошьешь, вот в больницах она необходима. Материал разработали в Чили.