Алюминий — химический элемент III группы периодической системы Менделеева (атомный номер 13, атомная масса 26,98154). В большинстве соединений алюминий трехвалентен, но при высоких температурах он способен проявлять и степень окисления +1. Из соединений этого металла самое важное — оксид Al2O3.
Алюминий — серебристый-белый металл, легкий (плотность 2,7 г/см3), пластичный, хороший проводник электричества и тепла, температура плавления 660oC. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминий химически активен (на воздухе покрывается защитной оксидной пленкой — оксидом алюминия. Оксид алюминия (Al2O3) надежно предохраняет металл от дальнейшего окисления. Но если порошок алюминия или алюминиевую фольгу сильно нагреть, то металл сгорает ослепительным пламенем, превращаясь в оксид алюминия. Алюминий растворяется даже в разбавленных соляной и серной кислотах, особенно при нагревании. А вот в сильно разбавленной и концентрированной холодной азотной кислоте алюминий не растворяется. При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты — соли, содержащие алюминий в составе аниона:
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
Алюминий, лишенный защитной пленки, взаимодействуют с водой, вытесняя из нее водород:
2Al + 6H2O = 2Al(OH)3 + 3H2
Образующийся гидроксид алюминия реагирует с избытком щелочи, образуя гидроксоалюминат:
Al(OH)3 + NaOH = Na[Al(OH)4].
Суммарное уравнение растворения алюминия в водном растворе щелочи имеет следующий вид:
2Al + 2NaOH +6H2O = 2Na[Al(OH)4] + 3H2.
Алюминий активно взаимодействует и с галогенами. Гидроксид алюминия Al(OH)3 — белое, полупрозрачное, студенистое вещество.
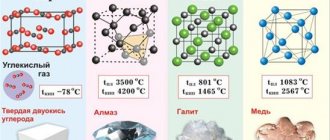
В земной коре содержится 8,8% алюминия. Это третий по распространенности в природе элемент после кислорода и кремния и первый — среди металлов. Он входит в состав глин, полевых шпатов, слюд. Известно несколько сотен минералов Al (алюмосиликаты, бокситы, алуниты и другие). Важнейший минерал алюминия — боксит содержит 28-60% глинозема — оксида алюминия Al2O3.
В чистом виде алюминий впервые был получен датским физиком Х. Эрстедом в 1825 году, хотя и является самым распространенным металлом в природе.
Производство алюминия осуществляется электролизом глинозема Al2O3 в расплаве криолита NaAlF4 при температуре 950oC.
Алюминий применяется в авиации, строительстве, преимущественно в виде сплавов алюминия с другими металлами, электротехнике (заменитель меди при изготовлении кабелей и т.д.), пищевой промышленности (фольга), металлургии (легирующая добавка), алюмотермии и т.д.
Характеристики алюминия
- Плотность алюминия — 2,7*103 кг/м3;
- Удельный вес алюминия — 2,7 г/cм3;
- Удельная теплоемкость алюминия при 20oC — 0,21 кал/град;
- Температура плавления алюминия — 658,7oC ;
- Удельная теплоемкость плавления алюминия — 76,8 кал/град;
- Температура кипения алюминия — 2000oC ;
- Относительное изменение объема при плавлении (дельтаV/V) — 6,6%;
- Коэффициент линейного расширения алюминия (при температуре около 20oC) : — 22,9 *106(1/град);
- Коэффициент теплопроводности алюминия — 180ккал/м*час*град;
Модули упругости алюминия и коэффициент Пуассона
| Наименование материала | Модуль Юнга, кГ/мм2 | Модуль сдвига, кГ/мм2 | Коэффициент Пуассона |
| Алюминиевая бронза, литье | 10500 | 4200 | — |
| Алюминиевая проволока тянутая | 7000 | — | — |
| Алюминий катаный | 6900 | 2600-2700 | 0,32-0,36 |
Отражение света алюминием
Числа, приведенные в таблице, показывают, какая доля света в %, падающего перпендикулярно к поверхности, отражается от нее.
| Наименование волн | Длина волны | Отражение света, % |
| Ультрафиолетовые | 1880 | 25 |
| 2000 | 31 | |
| 2510 | 53 | |
| 3050 | 64 | |
| 3570 | 70 | |
| Видимые | 5000 | — |
| 6000 | — | |
| 7000 | — | |
| Инфакрасные | 8000 | — |
| 10000 | 74 | |
| 50000 | 94 | |
| 100000 | 97 |
Типичные механические свойства деформируемых алюминиевых сплавов.
Типичные механические свойства деформируемых алюминиевых сплавов.
(044)490-04-88
Таблица из «Промышленные деформируемые, спеченные и литейные алюминиевые сплавы. Справочное руководство.» отв. ред. Ф. И. Квасов, И. Н. Фриляндер.
| Сплав и его состояние | Вид полуфабриката | E | σ0,2 | σв | δ | ψ | τcp | HB | σ-1 |
| (кгс/мм2) | % | (кгс/мм2) | |||||||
| ¹ знакопеременный изгиб на базе 5×108 циклов, остальные — на базе 2×107 циклов | |||||||||
| Алюминиевые сплавы низкой и средней прочности | |||||||||
| АДМ | Прессованные и катанные | 7100 | 3 | 8 | 35 | 80 | 5,5 | 25 | 3,5¹ |
| АД1Н | То же | 7100 | 15 | 10 | 6 | 60 | 7,0 | 32 | 5,5¹ |
| АМцМ | Катанные | 7100 | 5 | 13 | 23 | 70 | 8,0 | 30 | 5¹ |
| АМцП | » | 7100 | 13 | 18 | 10 | 55 | 10 | 40 | 6,5¹ |
| АМцН | » | 7100 | 18 | 22 | 5 | 50 | 11 | 55 | 7¹ |
| АМг1М | Прессованные и катанные | 6900 | 5,0 | 12 | 28 | – | 10 | 30 | 7¹ |
| АМг1Н | Катанные | 7000 | 19 | 21 | 5 | – | 12 | 55 | 9,5¹ |
| АМг2М | » | 7000 | 9 | 19 | 23 | 30 | 12,5 | 45 | 11¹ |
| АМг2Н2 | » | 7000 | 21 | 25 | 8 | – | 14 | 68 | 12,5¹ |
| АМг2Н | » | 7100 | 23 | 28 | 5 | – | 16,5 | 77 | 14¹ |
| АМг3М | » | 7000 | 12 | 23,5 | 22 | – | 15,5 | 58 | 11,5 |
| АМг3Н2 | » | 7000 | ≥23 | 27 | 8 | – | 16 | 75 | 13¹ |
| АМг4М | » | 6900 | 14 | 27 | 23 | – | 16 | – | 13,5 |
| АМг4Н2 | » | 6900 | 24 | 32 | 12 | – | 19 | – | – |
| АМг5М | » | 6900 | 18 | 30 | 20 | – | 18 | 65 | 14 |
| АМг5Н | » | 7000 | 32 | 42 | 10 | – | 22 | 100 | 15,5¹ |
| АМг6М | » | 7000 | 17 | 34 | 20 | 25 | 21 | – | 13 |
| АМг6Н | » | 7000 | 28 | 38 | 6 | – | – | – | – |
| АД31Т | Прессованные | 7100 | 8 | 17 | 20 | – | – | – | 7,0¹ |
| АД31Т1 | » | 7100 | 20 | 24 | 10 | – | 16 | 80 | 9 |
| АД33Т | » | 7100 | 14 | 24 | 20 | – | 16,5 | 65 | 10,5 |
| АД33Т1 | » | 7100 | 27 | 31 | 12 | 25 | 19 | 95 | 11 |
| АД35Т | » | 7100 | 18 | 27 | 15 | – | 15,5 | 60 | – |
| АД35Т1 | » | 7100 | 28 | 33 | 8 | 35 | 18 | 95 | 11 |
| АВТ1 | » | 7100 | 29 | 35 | 12 | 20 | 21 | 95 | 11,5 |
| Алюминиевые сплавы средней прочности | |||||||||
| Сплав и его состояние | Вид полуфабриката | E | σ0,2 | σв | δ | ψ | τcp | HB | σ-1 |
| (кгс/мм2) | % | (кгс/мм2) | |||||||
| Д1Т | Штамповки | 7100 | 25 | 41 | 15 | 30 | 27 | 110 | 12,5¹ |
| Д16Т | Катанные | 6900 | 29 | 44 | 19 | – | 28 | 120 | 12,5 |
| Д16Т1 | » | 6900 | 40 | 45 | 7 | – | 27 | – | 12,5 |
| Д16Т1Н | » | 6900 | 46 | 50 | 5,5 | – | 28,5 | – | 12,5 |
| Д16Т | Прессованные | 7200 | 38 | 52 | 12 | 15 | 30 | 130 | 14¹ |
| Д19Т | Катанные | 6900 | 30 | 44 | 20 | – | – | – | |
| Д19ТН | » | 6900 | 36 | 48 | 13 | – | – | – | |
| Д19Т | Прессованные | 7200 | 34 | 46 | 12 | – | 29 | 120 | |
| М40Т | Катанные | 7000 | 25 | 39 | 18 | – | – | – | |
| » | Прессованные | 7100 | 31 | 41 | 12 | 17 | – | – | |
| ВАД1Т | Катанные | 6900 | 28 | 44 | 18 | – | – | – | 12 |
| » | Прессованные | 7200 | 36 | 50 | 13 | – | – | – | 14 |
| Д20Т1 | Катанные | 6900 | 30 | 42 | 11 | 26 | 10,5¹ | ||
| Д29Т1Н | » | 6900 | 36 | 45 | 10 | 29 | 10,5¹ | ||
| Д20Т1 | Прессованные | 6900 | 28 | 42 | 10 | 35 | 27 | 100 | 13 |
| Д21Т1 | Поковки и штамповки | 7000 | 35 | 43 | 9 | 18 | |||
| 1201 | Катанные | 30 | 42 | 12 | |||||
| 1205 | Катанные | 40 | 50 | 9 | |||||
| ВД17Т1 | Штамповки: | 7200 | 34 | 52 | 17 | 20 | 115 | 16 | |
| продольное направление | |||||||||
| поперечное направление | 7200 | 30 | 44 | 17 | 20 | ||||
| В92Т1 | Катанные | 6900 | 30 | 40 | 10 | ||||
| Прессованные | 7000 | 34 | 45 | 10 | 11 | 15 | |||
| 1915Т1 | Катанные | 6800 | 28 | 36 | 11 | ||||
| Прессованные | 7000 | 32 | 38 | 10 | |||||
| 1420Т1 | Катанные | 7500 | 27 | 44 | 9 | ||||
| Прессованные | 7600 | 31 | 46 | 9 | 12 | ||||
| 1911Т1 | Катанные | 6800 | 35 | 42 | 12 | ||||
| Прессованные | 7000 | 42 | 50 | 15 | |||||
© «М-Комплект» 2007 — 2017
www.metmk.com.ua
Оксид алюминия Al2O3
Оксид алюминия Al2O3, называемый также глиноземом, встречается в природе в кристаллическом виде, образуя минерал корунд. Корунд обладает очень высокой твердостью. Его прозрачные кристаллы, окрашенные в красный или синий цвет, представляют собой драгоценные камни — рубин и сапфир. В настоящее время рубины получают искусственно, сплавляя с глиноземом в электрической печи. Они используются не столько для украшений, сколько для технических целей, например, для изготовления деталей точных приборов, камней в часах и т.п. Кристаллы рубинов, содержащих малую примесь Cr2O3, применяют а качестве квантовых генераторов — лазеров, создающих направленный пучек монохроматического излучения.
Корунд и его мелкозернистая разновидность, содержащая большое количество примесей — наждак, применяются как абразивные материалы.
Способы получения
Оксид алюминия можно получить различными методами:
1. Горением алюминия на воздухе:
4Al + 3O2 → 2Al2O3
2. Разложением гидроксида алюминия при нагревании:
2Al(OH)3 → Al2O3 + 3H2O
3. Оксид алюминия можно получить разложением нитрата алюминия:
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
Химические свойства
Оксид алюминия — типичный амфотерный оксид. Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида алюминия с основными оксидами образуются соли-алюминаты.
Например, оксид алюминия взаимодействует с оксидом натрия:
Na2O + Al2O3 → 2NaAlO2
2.Оксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом оксид алюминия проявляет кислотные свойства.
Например, оксид алюминия взаимодействует с гидроксидом натрия в расплаве с образованием алюмината натрия и воды:
2NaOH + Al2O3 → 2NaAlO2 + H2O
Оксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
3. Оксид алюминия не взаимодействует с водой.
4. Оксид алюминия взаимодействует с кислотными оксидами (сильных кислот). При этом образуются соли алюминия. При этом оксид алюминия проявляет основные свойства.
Например, оксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
Al2O3 + 3SO3 → Al2(SO4)3
5.Оксид алюминия взаимодействует с растворимыми кислотами с образованием средних и кислых солей.
Например, оксид алюминия реагирует с серной кислотой:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
6. Оксид алюминия проявляет слабые окислительные свойства.
Например, оксид алюминия реагирует с гидридом кальция с образованием алюминия, водорода и оксида кальция:
Al2O3 + 3CaH2 → 3CaO + 2Al + 3H2
Электрический токвосстанавливает алюминий из оксида (производство алюминия):
2Al2O3 → 4Al + 3O2
7. Оксид алюминия — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната натрия:
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
Производство алюминия
Основным сырьем для производства алюминия служат бокситы, содержащие 32-60% глинозема Al2O3 . К важнейшим алюминиевым рудам относятся также алунит и нефелин. Россия располагает значительными запасами алюминиевых руд. Кроме бокситов, большие месторождения которых находятся на Урале и в Башкирии, богатым источником алюминия является нефелин, добываемый на Кольском полуострове. Много алюминия находится и в месторождениях Сибири.
Алюминий получают из оксида алюминия Al2O3 электролитическим методом. Используемый для этого оксид алюминия должен быть достаточно чистым, поскольку из выплавленного алюминия примеси удаляются с большим трудом. Очищенный Al2O3 получают переработкой природного боксита.
Основное исходное вещество для производства алюминия — оксид алюминия. Он не проводит электрический ток и имеет очень высокую температуру плавления (около 2050oC), поэтому требуется слишком много энергии.
Необходимо снизить температуру плавления оксида алюминия хотя бы до 1000oC. Такой способ параллельно нашли француз П. Эру и американец Ч. Холл. Они обнаружили, что глинозем хорошо растворяется в раплавленном криолите — минерале состава AlF3 .3NaF. Этот расплав и подвергают элктролизу при температуре всего около 950oC на алюминиевых производствах. Запасы криолита в природе незначительны, поэтому был создан синтетический криолит, что существенно удешевило производство алюминия.
Гидролизу подвергают расплавленную смесь криолита Na3 [AlF6 ] и оксида алюминия. Смесь, содержащая около 10 весовых процентов Al2O3 , плавится при 960oC и обладает электропроводностью, плотностью и вязкостью, наиболее благоприятствующими проведению процесса. Для дополнительного улучшения этих характеристик в состав смеси вводят добавки AlF3, CaF2 и MgF2. Благодаря этому проведение электролиза оказывается возможным при 950oC.
Эликтролизер для выплавки алюминия представляет собой железный кожух, выложенный изнутри огнеупорным кирпичем. Его дно (под), собранное из блоков спресованного угля, служит катодом. Аноды (один или несколько) располагаются сверху: это — алюминиевые каркасы, заполненные угольными брикетами. На современных заводах электролизеры устанавливаются сериями; каждая серия состоит из 150 и большего числа электролизеров.
При электролизе на катоде выделяется алюминий, а на аноде — кислород. Алюминий, обладающий большей плотностью, чем исходный расплав, собирается на дне эликтролизера, откуда его периодически выпускают. По мере выделения металла, в расплав добавляют новые порции оксида алюминия. Выделяющийся при электролизе кислород взаимодействует с углеродом анода, который выгорает, образуя CO и CO2.
Первый алюминиевый завод в России был построен в 1932 году в Волхове.
Гидроксид алюминия
Способы получения
1. Гидроксид алюминия можно получить действием раствора аммиакана соли алюминия.
Например, хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
2.Пропусканием углекислого газа, сернистого газа или сероводородачерез раствор тетрагидроксоалюмината натрия:
Na[Al(OH)4] + СО2 = Al(OH)3 + NaНCO3
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например, хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
AlCl3 + 3KOH(недост.) = Al(OH)3↓+ 3KCl
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами. Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например:бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
2AlBr3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaBr
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S↑ + 6NaCl
Химические свойства
1. Гидроксид алюминия реагирует с растворимыми кислотами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например, гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
Al(OH)3 + 3HNO3 → Al(NO3)3 + 3H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Al(OH)3 + 3HBr → AlBr3 + 3H2O
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
2Al(OH)3 + 3SO3 → Al2(SO4)3 + 3H2O
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом гидроксид алюминия проявляет кислотные свойства.
Например, гидроксид алюминия взаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
2KOH + Al(OH)3 → 2KAlO2 + 2H2O
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
Al(OH)3 + KOH → K[Al(OH)4]
4. Гидроксид алюминия разлагается при нагревании:
2Al(OH)3 → Al2O3 + 3H2O
Видеоопытвзаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.
Механические свойства алюминиевых сплавов
Прочность на смятие алюминиевых сплавов
Прочность на смятие алюминия также трудно определять, испытывать и связывать с обычными прочностными свойствами, как и для других металлов. Смятие часто является важным критерием для конструкций с применением соединений на заклепках и болтах и поэтому «прочность на смятие» является широко признанной характеристикой. Прочность на смятие весьма произвольно определяют как давление (на единицу эффективной площади смятия), прилагаемое шпилькой в круглом отверстии. Это отверстие предварительно раздают на 2 % от исходного диаметра (рисунок 1). Эта прочность для большинства алюминиевых сплавов составляет 1,8 от прочности при растяжении (временного сопротивления) (рисунок 2).
Рисунок 1
Рисунок 2
Прочность на срез алюминиевых сплавов
Схема нагружения при испытании на срез приведена на рисунке 3. Для деформируемых алюминиевых сплавов отношение прочности на срез к прочности при растяжении различается в зависимости от химического состава и метода изготовления от 0,5 до 0,75 (см. рисунок 2). В случае отсутствия данных по прочности на срез ее обычно принимают 0,55 от прочности при растяжении.
Рисунок 3
Заклепки из марок алюминия и сплавов Al—Mn (серия 3ххх) изготовляют методами холодной деформации с достижением прочности на срез до 200 МПа. Заклепки из термически упрочняемых сплавов изготовляют в отожженном состоянии, затем сразу подвергают закалке и естественному старению с достижением прочности на срез до 260 МПа.
Сопротивление материала местной пластической деформации, возникающей при внедрении в него более твердого тела – индентора — является приблизительным индикатором состояния сплава и поэтому широко применяется при контроле продукции. Для алюминиевых сплавов применяют методы Бринелля (стальной шарик), Викерса (алмазная пирамидка) и Шора (падающий алмазный конус). Твердость по Бринеллю изменяется от 20 единиц для чистого алюминия до 175 единиц для термически упрочненного сплава 7075 (см. рисунок 2). По показаниям твердости, как правило, не вычисляют их прочность при растяжении, как это обычно делают для сталей, так как для алюминиевых сплавов соотношение этих двух характеристик далеко от постоянного.
Соли алюминия
Нитрат и сульфат алюминия
Нитрат алюминия при нагревании разлагается на оксид алюминия, оксид азота (IV) и кислород:
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
Сульфат алюминия при сильном нагревании разлагается аналогично — на оксид алюминия, сернистый газ и кислород:
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
Комплексные соли алюминия
Для описания свойств комплексных солей алюминия — гидроксоалюминатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоалюминат на две отдельные молекулы — гидроксид алюминия и гидроксид щелочного металла.
Например, тетрагидроксоалюминат натрия разбиваем на гидроксид алюминия и гидроксид натрия:
Na[Al(OH)4] разбиваем на NaOH и Al(OH)3
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы алюминия реагируют скислотными оксидами.
Например, гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид алюминия не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Na[Al(OH)4] + CO2 → Al(OH)3↓ + NaHCO3
Аналогично тетрагидроксоалюминат калия реагирует с углекислым газом:
K[Al(OH)4] + CO2 → Al(OH)3 + KHCO3
По такому же принципу тетрагидроксоалюминаты реагирует с сернистым газом SO2:
Na[Al(OH)4] + SO2 → Al(OH)3↓ + NaHSO3
K[Al(OH)4] + SO2 → Al(OH)3 + KHSO3
А вот под действиемизбытка сильной кислотыосадок не выпадает, т.к. амфотерный гидроксид алюминия реагирует с сильными кислотами.
Например, с соляной кислотой:
Na[Al(OH)4] + 4HCl(избыток) → NaCl + AlCl3 + 4H2O
Правда, под действием небольшого количества (недостатка) сильной кислотыосадок все-таки выпадет, для растворения гидроксида алюминия кислоты не будет хватать:
Na[Al(OH)4] + НCl(недостаток) → Al(OH)3↓ + NaCl + H2O
Аналогично с недостатком азотной кислоты выпадает гидроксид алюминия:
Na[Al(OH)4] + HNO3(недостаток) → Al(OH)3↓ + NaNO3 + H2O
Комплекс разрушается при взаимодействии схлорной водой(водным раствором хлора) Cl2:
2Na[Al(OH)4] + Cl2 → 2Al(OH)3↓ + NaCl + NaClO + H2O
При этом хлор диспропорционирует.
Также комплекс может прореагировать с избытком хлорида алюминия. При этом выпадает осадок гидроксида алюминия:
AlCl3 + 3Na[Al(OH)4] → 4Al(OH)3↓ + 3NaCl
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-алюминат:
Na[Al(OH)4] → NaAlO2 + 2H2O↑
K[Al(OH)4] → KAlO2 + 2H2O
Гидролиз солей алюминия
Растворимые соли алюминия и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Al3+ + H2O = AlOH2+ + H+
II ступень: AlOH2+ + H2O = Al(OH)2+ + H+
III ступень: Al(OH)2+ + H2O = Al(OH)3 + H+
Однако сульфиды, сульфиты, карбонаты алюминия и их кислыесоли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Al2(SO4)3 + 6NaHSO3 → 2Al(OH)3 + 6SO2 + 3Na2SO4
2AlBr3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + CO2↑ + 6NaBr
2Al(NO3)3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 6NaNO3 + 3CO2↑
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 6NaCl + 3CO2↑
Al2(SO4)3 + 3K2CO3 + 3H2O → 2Al(OH)3↓ + 3CO2↑ + 3K2SO4
2AlCl3 + 3Na2S + 6H2O → 2Al(OH)3 + 3H2S↑ + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Алюминаты
Соли, в которых алюминий является кислотным остатком (алюминаты) — образуются из оксида алюминия при сплавлении с щелочами и основными оксидами:
Al2O3 + Na2O → 2NaAlO2
Для понимания свойств алюминатов их также очень удобно разбить на два отдельных вещества.
Например, алюминат натрия мы разделим мысленно на два вещества: оксид алюминия и оксид натрия.
NaAlO2 разбиваем на Na2O и Al2O3
Тогда нам станет очевидно, что алюминаты реагируют скислотами с образованием солей алюминия:
KAlO2 + 4HCl → KCl + AlCl3 + 2H2O
NaAlO2 + 4HCl → AlCl3 + NaCl + 2H2O
NaAlO2 + 4HNO3 → Al(NO3)3 + NaNO3 + 2H2O
2NaAlO2 + 4H2SO4 → Al2(SO4)3 + Na2SO4 + 4H2O
Под действием избытка воды алюминаты переходят в комплексные соли:
KAlO2 + H2O = K[Al(OH)4]
NaAlO2 + 2H2O = Na[Al(OH)4]
Бинарные соединения
Сульфид алюминия под действием азотной кислоты окисляется до сульфата:
Al2 S3 + 8HNO3 → Al2(SO4)3 + 8NO2 + 4H2O
либо до серной кислоты (под действием горячей концентрированной кислоты):
Al2 S3 + 30HNO3(конц. гор.) → 2Al(NO3)3 + 24NO2 + 3H2SO4 + 12H2O
Сульфид алюминия разлагается водой:
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
Карбид алюминия также разлагается водой при нагревании на гидроксид алюминия и метан:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
Нитрид алюминия разлагается под действием минеральных кислот на соли алюминия и аммония:
AlN + 4HCl → AlCl3 + NH4Cl
Также нитрид алюминия разлагается под действием воды:
AlN + 3H2O → Al(OH)3↓ + NH3
Свойства крылатого металла
Алюминий (Aluminium) имеет несчастливый 13 номер в периодической таблице Менделеева. Однако на счастливую судьбу металла это не повлияло.
Этот легкий серебристый металл послушно поддается механической обработке и литью, имеет большую тягучесть.
Редкая способность — быстро образовывать окисные пленки на поверхности чистого металла. Но эти пленки не слишком хорошо защищают от коррозии. Надежнее химическое и электрохимическое оксидирование. Формула оксидной пленки А12Оз.
Химические и физические характеристики алюминия:
- плотность 2,7 г/см3;
- температура плавления 660°С;
- кипит цветной металл при температуре 2518°С;
- строение кристаллической решетки гранецентрированное, кубическое;
- степени окисления 0; +3.
С помощью металлического алюминия (его взаимодействия с оксидами металлов) получают трудновосстанавливаемые металлы. Этот метод называется алюминотермия.
| Свойства атома | |
| Название, символ, номер | Алюминий / Aluminium (Al), 13 |
| Группа, период, блок | 13, 3, |
| Атомная масса (молярная масса) | 26,9815386(8)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s2 3p1 |
| Электроны по оболочкам | 2, 8, 3 |
| Радиус атома | 143 пм |
| Химические свойства | |
| Ковалентный радиус | 121 ± 4 пм |
| Радиус Ван-дер-Ваальса | 184 пм |
| Радиус иона | 51 (+3e) пм |
| Электроотрицательность | 1,61 (шкала Полинга) |
| Электродный потенциал | −1,66 В |
| Степени окисления | 0; +3 |
| Энергия ионизации | 1‑я: 577,5 (5,984) кДж/моль (эВ) 2‑я: 1816,7 (18,828) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Термодинамическая фаза | Твёрдое вещество |
| Плотность (при н. у.) | 2,6989 г/см³ |
| Температура плавления | 660 °C, 933,5 K |
| Температура кипения | 2518,82 °C, 2792 K |
| Уд. теплота плавления | 10,75 кДж/моль |
| Уд. теплота испарения | 284,1 кДж/моль |
| Молярная теплоёмкость | 24,35[2] 24,2[3] Дж/(K·моль) |
| Молярный объём | 10,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 4,050 Å |
| Температура Дебая | 394 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 237 Вт/(м·К) |
| Скорость звука | 5200 м/с |
| Номер CAS | 7429-90-5 |
Алюминий имеет один стабильный изотоп, 27Al.
Микроструктура алюминия на протравленной поверхности слитка, чистотой 99,9998 %, размер видимого сектора около 55×37 мм.
Неправда, но хорошо придумано
В печатных изданиях, а сейчас и в интернете гуляет история о крестьянине, который вел «крамольные беседы о полете на Луну». Крестьянина (или мещанина), по одним сведениям Петрова, по другим Никифорова, сослали в киргизский поселок Байконур» Якобы известие о факте напечатано был в Московских губернских новостях», в 1848 году. Сейчас, когда с космодрома Байконура ушли в космос не один десяток спутников и станций, этот факт выглядит пророческим и мистическим.
Вот только это неправда. Дотошные читатели перерыли подшивки этой газеты, и заметки такой не обнаружили. Это просто красивая легенда.
Алюминиевые сплавы, плюсы и минусы
Кодовый символ, указывающий, что алюминий может быть вторично переработан.
Чистый алюминий в строительных конструкциях применять нецелесообразно. Прочностные характеристики у него «так себе». А вот алюминиевые сплавы — другое дело. Сейчас известны и используются около 60 сплавов. Можно выбрать для любых нужд, на любой вкус.
Классификация сплавов проводится по составу, свойствам, по способности к термической обработке.
Добавки меди, магния и марганца, цинка существенно улучшают характеристики сплава в сравнении с чистым металлом. Этими металлами чаще всего легируют алюминий. Титан, литий, ванадий, церий, скандий, некоторые редкоземельные элементы для легирования применяются реже, но свойства этих сплавов также востребованы в промышленности.
Дюраль
Дюралюмины — сплавы алюминия с медью (4%), магнием (0,5%) и небольшого количества железа, марганца, кремния. Недостаток дюралей — подверженность коррозии; с ней справляются, применяя анодирование, плакировку, авиационную грунтовку, окрашивание.
Востребованные свойства сплава: хорошая статическая и усталостная прочность, высокая вязкость разрушения.
Широко применяется в деталях и конструкциях, где большую роль играет масса изделия. Главные потребители сплава — авиация, судостроение, космонавтика.
Для любознательных: дюралюминий придумали в 1909 году. «Папа» сплава — А. Вильм.
Сплав 7075
Разрабатывался компанией Sumitomo Metal Corporation (Япония) в строжайшей тайне.
Представляет соединение алюминия с цинком (до 6%), магния (2-2,5%), меди (до 1,5%). В тот же сплав добавлены титан, кремний, марганец, хром, железо. Добавки эти составляют не более 0,5%, но свой вклад в свойства сплава вносят.
Сплав сравним по прочности со сталью, но легче ее в три раза.
Модификации сплава:
- 7075-0;
- 7075-06;
- 7075-Т651;
- 7075-Т7;
- 7075-АСР.
Сплавы устойчивы к коррозии, хорошо полируются.
Применяются в производстве винтовок для армии и граждан. Промышленности автомобильная, авиационная, морская активно используют сплав. Его минус — достаточно высокая цена.
Сплавов разных много
В России довольно много сплавов с разными свойствами:
- D1, D16, 1161, 1163 — алюминий, магний, медь;
- АМГ1 — АМГ6, сплав алюминия и магния;
- AD31, AD33, AD35, AB — алюминий, кремний, магний. Список легко продолжить.
Старость в радость
Не всегда старость — это плохо. Металл — как человек или вино; с возрастом свойства алюминия меняются; он становится лучше, крепче, сильнее.
Естественное старение металла происходит при нормальных условиях; можно сказать, что металл «дозревает».
Искусственное старение проходит при термообработке и пластическом деформировании.
Термическая обработка бывает разных видов. Выбор зависит от назначения будущего сплава.
| Вид термообработки | Что дает термообработка |
| Закалка с полным искусственным старением | Высокая прочность сплава, но некоторое снижение пластичности |
| Закалка со стабилизирующим старением | Хорошая прочность, довольно высокая стабильность структуры |
| Закалка с последующим смягчающим отпуском | Хорошая пластичность, но снижение прочности сплава |
| Искусственное старение | Повышает прочность сплава, улучшает возможность обработки резанием |
| Отжиг | Повышение пластичности, уменьшение остаточных напряжений металла |
| Закалка | Улучшает прочностные характеристики |
| Закалка и неполное искусственное старение | Повышает прочность при сохранении пластичности |
Механические свойства алюминиевых сплавов Амг, АМц
Механические свойства алюминиевого сплава АМц зависят от температуры горячей прокатки. Увеличение температуры прокатки уменьшает временное сопротивление разрыву и увеличивает временое сопротивление разрыву. Эта зависимость верна для полуфабрикатов в любом состоянии: горячекатанном, холоднокатанном и отожженном.
Механические свойства листов АМц в горячекатанном и отожженом состоянии после холодной прокатки, обжатие 80%
| Состояние | Температура горячей прокатки, °C | |||
| 480 — 500 | 350 — 380 | |||
| σв, МПа | δ , % | σв, МПа | δ , % | |
| Горячекатанное | 157 | 19,3 | 204 | 12,7 |
| Отожженное при Т, °C: | ||||
| 350 | 110 | 21,0 | 200 | 9,0 |
| 400 | 110 | 22,0 | 160 | 12,0 |
| 500 | 110 | 23,0 | 130 | 19,0 |
Гарантируемые механические характеристики полуфабрикатов из сплава АМц
| Полуфабрикаты | Состояние | σв, МПа | δ , % | τср, МПа |
| не менее | ||||
| Листы толщиной, мм: | М | |||
| 0,3–3,0 | 100–150 | 22 | – | |
| 3,0–6,0 | 100–150 | 20 | – | |
| 0,3–6.5 | Н2 (П) | 150–220 | 6 | – |
| 0,3–0,5 | Н | 190 | 1 | – |
| 0,5–0,8 | 190 | 2 | – | |
| 0,8–1,2 | 190 | 3 | 30 | |
| 1,2–1,6 | 190 | 4 | 40 | |
| Трубы всех размеров | М | 130 | – | – |
| Н | 140 | – | – | |
| Профили всех размеров | М | 170 | 16 | 160 |
| Прутки | ГП | 170 | 16 | – |
| Проволока для заклепок | Без ТО | – | – | 70 |
| Плиты толщиной 11–25мм | ГК | 120 | 15 | – |
Сплавы алюминия с магнием (манганалии) не упрочняются термической обработкой. В помышленности применяют большую группу сплавов системы Al-Mg: АМг1, АМг2, АМг3, АМг4, АМг5, АМ6, АМг61 и др. Полуфабрикаты из этих сплавов обладают высокой пластичностью и невысокой прочность по сравнению с термически упрочняемыми сплавами типа Д16 или В95. Манганалии хорошо свариваются всеми видами сварки. Они стойкие к коррозии в морской атмосфере.
Прочность сплавов алюминия с магнием Al-Mg повышают нагартовкой полуфабрикатов: увеличивается временное сопротивление разрыву и предел текучести, при снижении пластичности. Степень нагартовки 35% не уменьшает высокую коррозионную стойкость АМг-сплавов и не влияет на свариваемость. Околошовная зона АМг-сплавов из-за нагрева при сварке имеет характеристики отожженого материала.Увеличение содержания магния в сплавах до 6% приводит к резкому росту прочностных характеристик, особенно предела текучести. После концентрации Mg выше 5,5% (АМг6) рост предела текучести существенно замедляется. Пластичность уменьшается до 4% магния, а затем медленно повышается.
Манганалии сохраняют высокие коррозионные свойства при любых нагревах, если содержание магния не превышает 4,5%. В сплавах с 5-7% Mg по границам зерен выделяется при закалке и старении β-фаза Al3Mg2, которая создает местные очаги коррозии. Сплошное выделение β-фазы предотвращают отжигом при 310-325°С, при котром β-фаза равномерно распадается по всему зерну. Такая структура растравливается равномерно в электролите.
Сплавы АМг4, АМг5, АМ6, АМг61 — наиболее прочные сплавы системы алюминий-магний. Они обладают высокой технологической пластичностью, но быстро нагартовываются в процессе холодной деформации, а также высокими значениями σв и σ0,2.
Гарантируемые (не менее) механические свойства катаных полуфабрикатов из сплавов системы Al—Mg
| Сплав | Состояние | Полу | Толщина, мм | σв | σ0,2 | δ, % | |
| МПа | |||||||
| АМг2 | М | Листы | 0,5–1,0 | 165 | – | 16 | |
| 1,0–10,5 | 165 | – | 18 | ||||
| Н2 | 0,5–1,0 | 235–314 | 145 | 5 | |||
| 1,0–5,0 | 235–314 | 145 | 6 | ||||
| 5,0–10,0 | 225 | 135 | 6 | ||||
| Н | 0,5–1,0 | 265 | 215 | 3 | |||
| 1,0–10,5 | 265 | 215 | 4 | ||||
| ГК, без ТО | 5,0–10,5 | 175 | – | 7 | |||
| Плиты | 11,0–25,0 | 175 | – | 7 | |||
| 25,0–80,0 | 155 | – | 6 | ||||
| АМг3 | М | Листы | 0,5–0,6 | 195 | 90 | 15 | |
| 0,6–5,5 | 135 | 100 | 15 | ||||
| 4,5–10,5 | 185 | 80 | 15 | ||||
| Н2 | 0,5–1,0 | 245 | 195 | 7 | |||
| 1,0–5,0 | 245 | 195 | 7 | ||||
| 5,5–10,5 | 235 | 175 | 6 | ||||
| Без ТО | 5,0–6,0 | 185 | 80 | 12 | |||
| 6,0–10,5 | 185 | 80 | 15 | ||||
| Без ТО | Плиты | 11,0–25,0 | 185 | 70 | 12 | ||
| 25,0–80,0 | 165 | 60 | 11 | ||||
| АМг5 | М | Листы | 0,5–0,6 | 275 | 135 | 15 | |
| 0,6–4,5 | 275 | 145 | 15 | ||||
| 4,5–10,5 | 275 | 130 | 15 | ||||
| Без ТО | 5,0–6,0 | 275 | 130 | 12 | |||
| 6,0–10,5 | 275 | 130 | 15 | ||||
| Плиты | 11,0–25,0 | 265 | 115 | 13 | |||
| 25,0–80,0 | 255 | 105 | 12 | ||||
| АМг6 | М | Листы | 0,5–0,6 | 305 | 145 | 15 | |
| 0,6–10,5 | 315 | 155 | 15 | ||||
| Без ТО | 5,0–10,5 | 315 | 155 | 15 | |||
| Плиты | 11,0–25,0 | 305 | 145 | 11 | |||
| 25,0–50,0 | 295 | 135 | 6 | ||||
| 50,0–80,0 | 275 | 125 | 4 | ||||
| 01570 | М | Листы | 0,8–2,3 | 400 | 270 | 13 | |
| 2,5–4,5 | 360 | 240 | 13 | ||||
| Н2 | 0,8–2,3 | 410 | 320 | 6 | |||
| Н | 0,8–2,3 | 460 | 410 | 4 | |||
Гарантируемые механические характеристики прессованных прутков, труб и профилей из сплавов системы Al—Mg в состоянии без термической обработки
| Сплав | Полуфабрикаты | σв, МПа | σ0,2, МПа | δ , % |
| не менее | ||||
| АМг2 | Прутки | 175 | – | 13 |
| Трубы | 155 | 60 | 10 | |
| АМг3 | Профили | 175 | 75 | 12 |
| Прутки | 175 | 75 | 13 | |
| Трубы | 180 | 70 | 15 | |
| АМг5 | Профили | 255 | 115 | 15 |
| Прутки | 265 | 118 | 15 | |
| Трубы | 255 | 110 | 15 | |
| АМг6 | Профили, прутки | 315 | 155 | 15 |
| Панели | 315 | 155 | 15 | |
| Трубы | 315 | 145 | 15 | |
| АМг61(1561) | Профили | 330 | 205 | 11 |
| Прутки | 330 | 155–205 | 11 | |
| Панели | 330 | 185 | 11 | |
| 01570 | Прутки | 402 | 245 | 14 |
| Профили | 392 | 255 | 14 | |
Гарантируемые механические характеристики поковок и штамповок из сплавов системы Al—Mg в отожженном состоянии в зависимости от направления волокна (Д, П, В)
| Сплав | Толщина, мм | σв, МПа | σ0,2, МПа | δ , % | НВ | |||||
| Д | П | В | Д | П | Д | П | В | |||
| Примечание. Направление волокна: Д — долевое; П — поперечное; В — высотное (по толщине).Показатели штампуемости листов толщиной 2 мм при различных операциях формообразования | ||||||||||
| Поковки | ||||||||||
| АМг2 | До 75 | 165 | 145 | 135 | – | – | 15 | 13 | 11 | 44,0 |
| АМг3 | До 75 | 185 | 165 | 155 | 70 | – | 15 | 12 | 10 | 44,0 |
| АМг6 | До 75 | 316 | 305 | 305 | 135 | 130 | 15 | 14 | 14 | 63,5 |
| 76–100 | 295 | 295 | 295 | 130 | 130 | 14 | 14 | 14 | 63,5 | |
| 100–300 | 285 | 285 | 285 | 120 | 120 | 11 | 11 | 11 | 63,5 | |
| Штамповки | ||||||||||
| АМг2 | До 75 | 165 | 145 | 135 | – | – | 15 | 12 | 10 | 44,0 |
| АМг3 | До 75 | 185 | 165 | 155 | 70 | – | 15 | 12 | 10 | 44,0 |
| АМг5 | До 75 | 275 | – | – | 145 | – | 15 | – | – | 63,5 |
| АМг6 | До 75 | 315 | 305 | 305 | 155 | 130 | 15 | 14 | 14 | 63,5 |
| 76–100 | 295 | 295 | 295 | 130 | 130 | 14 | 14 | 14 | 63,5 | |
| 100–300 | 285 | 285 | 285 | 120 | 120 | 11 | 11 | 11 | 63,5 | |
Коэффициенты для вытяжки, штамповки и радиус гибки
| Сплав и состояние | Вытяжка | Отбортовка | Выдавка | Радиус при гибке на 90° | ||||
| К пр | К раб | К пр | К раб | К пл | К сф | R min, мм | R раб, мм | |
| Примечание. К пр и К раб — предельный и рабочий коэффициенты вытяжки; К пл и К сф — коэффициенты плоского и сферического выдавливания; R min и R раб — соответственно минимальный и рабочий радиусы гиба. | ||||||||
| АМг1М | 2,02 — 2,05 | — | 1,65 — 1,70 | — | 0,29 — 0,30 | 0,4 — 0,39 | (0,7 — 0,9) ∙ s | — |
| АМг2М | 2,0 — 2,6 | 1,8 — 1,85 | 1,52 — 1,56 | 1,32 — 1,40 | 0,23 — 0,26 | 0,36 — 0,42 | (0,6 — 1,0) ∙s | (1,0 — 1,5) ∙s |
| АМг3М | 1,92 | 1,86 | 1,86 | 1,63 | 0,22 — 0,25 | 0,36 — 0,32 | 1s | 2 ∙s |
| АМг4М | 1,85 — 1,90 | 1,65 — 1,70 | 1,5 — 1,65 | 1,35 — 1,45 | 0,17 — 0,19 | — | (1,0 — 1,55) ∙ s | (1,5 — 2,5) ∙ s |
| АМг5М | 1,7 — 1,87 | 1,85 — 2,02 | 1,3 — 1,5 | 1,42 — 1,62 | 0,24 — 0,29 | 0,37 — 0,46 | (0,6 — 1,0) ∙s | (2,0 — 2,5) ∙s |
| АМг6М | 2,0 — 2,06 | 1,8 — 1,85 | 1,52 — 1,56 | 1,32 — 1,40 | 0,22 — 0,25 | 0,35 — 0,40 | (0,6 — 1,0) ∙s | 2 ∙s |
| АМг6Н | 1,4 | — | 1,16 | — | — | — | 5 ∙s | |
Радиус гибки: Радиус цилиндрической поверхности оправки, которая входит в контакт с внутренней поверхностью изделия при гибке. В случае свободных или полусвободных изгибов до 180°, когда используется клин или блок, радиус загиба – соответствует половине толщины клина или блока. (Источник: «Металлы и сплавы. Справочник.» Под редакцией Ю.П. Солнцева; НПО «Профессионал», НПО «Мир и семья»; Санкт-Петербург, 2003 г.)
www.metmk.com.ua
Минералы, месторождения…а самородный алюминий?
Запасы алюминия в природе огромны. Среди металлов он держит первое место по распространенности. Но «общительность», активность элемента привела к тому, что в чистом виде металл практически отсутствует.
Производство алюминия в миллионах тонн.
Минералов, содержащих алюминий, много:
- бокситы;
- глиноземы;
- полевые шпаты;
- нефелины;
- корунды.
Так что добыча алюминиевого сырья не составляет большого труда.
Если все запасы на Земле истощатся (что сомнительно), то алюминий можно добывать из морской воды. Там его содержание составляет 0,01 мг/л.
Кто захочет увидеть самородный алюминий, тому придется опускаться в жерла вулканов.
Происхождением такой металл из самых глубин нашей планеты.
Как производят крылатый металл
Производство металла можно разделить на две стадии.
- Первая — добыча бокситов, их дробление и отделение кремния при помощи пара.
- Вторая стадия: глинозем смешивают с расплавленным криолитом и воздействуют на смесь электротоком. В процессе реакции жидкий алюминий оседает на дне ванны.
Образовавшийся металл отливают в слитки; далее он отправляется потребителям или на производство сплавов и высокочистого алюминия.
Метод энергозатратный, «кушает» много электричества.
Бывает технический и сверхчистый
Полученный алюминий называется техническим или нелегированным. В нем содержание чистого металла не менее 99%. Его потребляет электронная промышленность, он необходим в производстве теплообменных и нагревательных устройств, осветительного оборудования.
Часть этого металла отправляется на дополнительную очистку, «рафинирование». В результате имеем металл высокой чистоты, с содержанием алюминия не менее 99,995%.
Его употребляют в электронике, в производстве полупроводников. Кабельное производство, химическое машиностроение сейчас не обойдется без сверхчистого алюминия.
Интересно: до открытия промышленного способа получения алюминия он был редкостью и стоил дороже золота. Нашего великого химика, Д.И. Менделеева, британцы почтили подарком. Это были аналитические весы (вещь, незаменимая для химика), у которых чашечки изготовили из золота и алюминия.
Металл для крыльев
Без такого металла, как алюминий, невозможно покорение неба. Крыльев людям не дано, а летать хочется человеку с давних времен. Не напрасно миф об Икаре живет с античных времен. Попытки взлететь предпринимались неоднократно.
Но прорыв случился в 1903 году, когда романтики неба и замечательные механики братья Райт подняли в воздух самолетик. Этот самолет открыл путь в небо.
Применение
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость (на воздухе алюминий мгновенно покрывается прочной плёнкой Al2O3, которая препятствует его дальнейшему окислению), высокая теплопроводность, неядовитость его соединений. В частности, эти свойства сделали алюминий чрезвычайно популярным при производстве кухонной посуды, алюминиевой фольги в пищевой промышленности и для упаковки. Первые же три свойства сделали алюминий основным сырьём в авиационной и авиакосмической промышленности (в последнее время медленно вытесняется композитными материалами, в первую очередь, углеволокном).
Основной недостаток алюминия как конструкционного материала — малая прочность, поэтому для упрочнения его обычно сплавляют с небольшим количеством меди и магния (сплав называется дюралюминий).
Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при напылении проводников на поверхности кристаллов микросхем. Меньшую электропроводность алюминия (3,7·107 См/м) по сравнению с медью (5,84·107 См/м), для сохранения одинакового электрического сопротивления, компенсируют увеличением площади сечения алюминиевых проводников. Недостатком алюминия как электротехнического материала является образование на его поверхности прочной диэлектрической оксидной плёнки, затрудняющей пайку и за счёт ухудшения контактного сопротивления вызывающей повышенное нагревание в местах электрических соединений, что, в свою очередь, отрицательно сказывается на надёжности электрического контакта и состоянии изоляции. Поэтому, в частности, 7-я редакция Правил устройства электроустановок, принятая в 2002 году, запрещает использовать алюминиевые проводники сечением менее 16 мм².
- Благодаря комплексу свойств широко распространён в тепловом оборудовании.
- Алюминий и его сплавы не приобретают хрупкость при сверхнизких температурах. Благодаря этому он широко используется в криогенной технике. Однако известен случай приобретения хрупкости криогенными трубами из алюминиевого сплава из-за их гибки на медных кернах при разработке РН Энергия.
- Высокий коэффициент отражения в сочетании с дешевизной и лёгкостью вакуумного напыления делает алюминий оптимальным материалом для изготовления зеркал.
- В производстве строительных материалов как газообразующий агент.
- Алитированием придают коррозионную и окалиностойкость стальным и другим сплавам, например, клапанам поршневых ДВС, лопаткам турбин, нефтяным платформам, теплообменной аппаратуре, а также заменяют цинкование.
- Сульфид алюминия используется для производства сероводорода.
- Идут исследования по разработке пенистого алюминия как особо прочного и лёгкого материала.
В качестве восстановителя
- Как компонент термита, смесей для алюмотермии.
- В пиротехнике.
- Алюминий применяют для восстановления редких металлов из их оксидов или галогенидов.
- Ограничено применяется как протектор при анодной защите.
Сплавы на основе алюминия
В качестве конструкционного материала обычно используют не чистый алюминий, а разные сплавы на его основе. Обозначение серий сплавов в данной статье приведена для США (стандарт H35.1 ANSI) и согласно ГОСТ России. В России основные стандарты — это ГОСТ 1583 «Сплавы алюминиевые литейные. Технические условия» и ГОСТ 4784 «Алюминий и сплавы алюминиевые деформируемые. Марки». Существует также UNS маркировка и международный стандарт алюминиевых сплавов и их маркировки ISO R209 b.
Алюминиевый профиль.
- Алюминиево-магниевые Al-Mg (ANSI: серия 5ххх у деформируемых сплавов и 5xx.x у сплавов для изделий фасонного литья; ГОСТ: АМг). Сплавы системы Al-Mg характеризуются сочетанием удовлетворительной прочности, хорошей пластичности, очень хорошей свариваемости и коррозионной стойкости. Кроме того, эти сплавы отличаются высокой вибростойкостью.
В сплавах этой системы, содержащих до 6 % Mg, образуется эвтектическая система соединения Al3Mg2 c твёрдым раствором на основе алюминия. Наиболее широкое распространение в промышленности получили сплавы с содержанием магния от 1 до 5 %.
Рост содержания Mg в сплаве существенно увеличивает его прочность. Каждый процент магния повышает предел прочности сплава на 30 МПа, а предел текучести — на 20 МПа. При этом относительное удлинение уменьшается незначительно и находится в пределах 30—35 %.
Сплавы с содержанием магния до 3 % (по массе) структурно стабильны при комнатной и повышенной температуре даже в значительно нагартованном состоянии. С ростом концентрации магния в нагартованном состоянии структура сплава становится нестабильной. Кроме того, увеличение содержания магния свыше 6 % приводит к ухудшению коррозионной стойкости сплава.
Для улучшения прочностных характеристик сплавы системы Al-Mg легируют хромом, марганцем, титаном, кремнием или ванадием. Попадания в сплавы этой системы меди и железа стараются избегать, поскольку они снижают их коррозионную стойкость и свариваемость.
- Алюминиево-марганцевые Al-Mn (ANSI: серия 3ххх; ГОСТ: АМц). Сплавы этой системы обладают хорошей прочностью, пластичностью и технологичностью, высокой коррозионной стойкостью и хорошей свариваемостью.
Основными примесями в сплавах системы Al-Mn являются железо и кремний. Оба этих элемента уменьшают растворимость марганца в алюминии. Для получения мелкозернистой структуры сплавы этой системы легируют титаном.
Присутствие достаточного количества марганца обеспечивает стабильность структуры нагартованного металла при комнатной и повышенной температурах.
- Алюминиево-медные Al-Cu (Al-Cu-Mg) (ANSI: серия 2ххх, 2xx.x; ГОСТ: АМ). Механические свойства сплавов этой системы в термоупрочненном состоянии достигают, а иногда и превышают, механические свойства низкоуглеродистых сталей. Эти сплавы высокотехнологичны. Однако у них есть и существенный недостаток — низкое сопротивление коррозии, что приводит к необходимости использовать защитные покрытия.
В качестве легирующих добавок могут применяться марганец, кремний, железо и магний. Причем наиболее сильное влияние на свойства сплава оказывает последний: легирование магнием заметно повышает пределы прочности и текучести. Добавка кремния в сплав повышает его способность к искусственному старению. Легирование железом и никелем повышает жаропрочность сплавов второй серии.
Нагартовка этих сплавов после закалки ускоряет искусственное старение, а также повышает прочность и сопротивление коррозии под напряжением.
- Сплавы системы Al-Zn-Mg (Al-Zn-Mg-Cu) (ANSI: серия 7ххх, 7xx.x). Сплавы этой системы ценятся за очень высокую прочность и хорошую технологичность. Представитель системы — сплав 7075 является самым прочным из всех алюминиевых сплавов. Эффект столь высокого упрочнения достигается благодаря высокой растворимости цинка (70 %) и магния (17,4 %) при повышенных температурах, резко уменьшающейся при охлаждении.
Однако существенным недостатком этих сплавов является крайне низкая коррозионная стойкость под напряжением. Повысить сопротивление коррозии сплавов под напряжением можно легированием медью.
Нельзя не отметить открытой в 1960-е годы закономерности: присутствие лития в сплавах замедляет естественное и ускоряет искусственное старение. Помимо этого, присутствие лития уменьшает удельный вес сплава и существенно повышает его модуль упругости. В результате этого открытия были разработаны новые системы сплавов Al-Mg-Li, Al-Cu-Li и Al-Mg-Cu-Li.
- Алюминиево-кремниевые сплавы (силумины) лучше всего подходят для литья. Из них часто отливают корпуса разных механизмов.
- Комплексные сплавы на основе алюминия: авиаль.
Алюминий как добавка в другие сплавы
Алюминий является важным компонентом многих сплавов. Например, в алюминиевых бронзах основные компоненты — медь и алюминий. В магниевых сплавах в качестве добавки чаще всего используется алюминий. Для изготовления спиралей в электронагревательных приборах используют (наряду с другими сплавами) фехраль (Fe, Cr, Al). Добавка алюминия в так называемые «автоматные стали» облегчает их обработку, давая чёткое обламывание готовой детали с прутка в конце процесса.
Ювелирные изделия
Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Так, Наполеон III заказал алюминиевые пуговицы, а Менделееву в 1889 году были подарены весы с чашами из золота и алюминия. Мода на ювелирные изделия из алюминия сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.
В Японии алюминий используется в производстве традиционных украшений, заменяя серебро.
Столовые приборы
По приказу Наполеона III были изготовлены алюминиевые столовые приборы, которые подавались на торжественных обедах ему и самым почётным гостям. Другие гости при этом пользовались приборами из золота и серебра.
Затем столовые приборы из алюминия получили широкое распространение, со временем использование алюминиевой кухонной утвари существенно снизилось, но и в настоящее время их всё ещё можно увидеть лишь в некоторых заведениях общественного питания — несмотря на заявления некоторых специалистов о вредности алюминия для здоровья человека. Кроме того, такие приборы со временем теряют привлекательный вид из-за царапин и форму из-за мягкости алюминия.
Из алюминия делают посуду для армии: ложки, котелки, фляжки.
Стекловарение
В стекловарении используются фторид, фосфат и оксид алюминия.
Пищевая промышленность
Алюминий зарегистрирован в качестве пищевой добавки Е173.
Алюмогель — студенистый осадок, образующийся при быстром осаждении гидроксида алюминия из солевых растворов, не имеющий кристаллического строения и содержащий большое количество воды используется в качестве основы для антацидных, обезболивающих и обволакивающих средств (алгелдрат; в смеси с гидроксидом магния — альмагель, маалокс, гастрацид и др.) при заболеваниях желудочно-кишечного тракта.
Военная промышленность
Дешевизна и вес металла обусловили широкое применение в производстве ручного стрелкового оружия, в частности автоматов и пистолетов.
Алюминий и его соединения в ракетной технике
Алюминий и его соединения используются в качестве высокоэффективного ракетного горючего в двухкомпонентных ракетных топливах и в качестве горючего компонента в твёрдых ракетных топливах. Следующие соединения алюминия представляют наибольший практический интерес как ракетное горючее:
- Порошковый алюминий как горючее в твёрдых ракетных топливах. Применяется также в виде порошка и суспензий в углеводородах.
- Гидрид алюминия.
- Боранат алюминия.
- Триметилалюминий.
- Триэтилалюминий.
- Трипропилалюминий.
Триэтилалюминий (обычно в смеси с триэтилбором) используется также для химического зажигания (как пусковое горючее) в ракетных двигателях, так как он самовоспламеняется в газообразном кислороде. Ракетные топлива на основе гидрида алюминия, в зависимости от окислителя, имеют следующие характеристики:
| Окислитель | Удельная тяга (Р1, с) | Температура сгорания, °С | Плотность топлива, г/см³ | Прирост скорости, ΔV ид, 25, м/с | Весовое содержание горючего, % |
| Фтор | 348,4 | 5009 | 1,504 | 5328 | 25 |
| Тетрафторгидразин | 327,4 | 4758 | 1,193 | 4434 | 19 |
| ClF3 | 287,7 | 4402 | 1,764 | 4762 | 20 |
| ClF5 | 303,7 | 4604 | 1,691 | 4922 | 20 |
| Перхлорилфторид | 293,7 | 3788 | 1,589 | 4617 | 47 |
| Фторид кислорода | 326,5 | 4067 | 1,511 | 5004 | 38,5 |
| Кислород | 310,8 | 4028 | 1,312 | 4428 | 56 |
| Пероксид водорода | 318,4 | 3561 | 1,466 | 4806 | 52 |
| N2O4 | 300,5 | 3906 | 1,467 | 4537 | 47 |
| Азотная кислота | 301,3 | 3720 | 1,496 | 4595 | 49 |
Алюмоэнергетика использует алюминий как универсальный вторичный энергоноситель. Его применения в этом качестве:
- Окисление алюминия в воде для производства водорода и тепловой энергии.
- Окисление алюминия кислородом воздуха для производства электроэнергии в воздушно-алюминиевых электрохимических генераторах.
Механические свойства алюминия
Что такое механические свойства?
Механические свойства алюминия, как и других материалов – это свойства, которые связаны с упругой и неупругой реакцией материала на приложение к нему нагрузки, в том числе, зависимость между напряжениями и деформациями. Примерами механических свойств являются:
- модуль упругости (при растяжении, при сжатии, при сдвиге)
- предел прочности (при растяжении, при сжатии, при сдвиге)
- предел текучести
- предел усталости
- удлинение (относительное) при разрыве
- твердость.
Механические свойства часто ошибочно относят к физическими свойствам.
Механические свойства материалов, в том числе, алюминия и его сплавов, которые получают путем испытания материала на растяжение, например, модуль упругости при растяжении, прочность при растяжении, предел текучести при растяжении и относительное удлинение называют механическими свойствами при растяжении.
Модуль упругости
Модуль упругости, который часто называют модулем Юнга – это отношение напряжения, которое приложено к материалу, к соответствующей деформации в том интервале, когда они являются прямо пропорциональными друг к другу.
Различают три типа напряжений и соответственно три типа модулей упругости для любого материала, в том числе для алюминия:
- модуль упругости при растяжении
- модуль упругости при сжатии
- модуль упругости при сдвиге (сдвиговый модуль упругости).
Таблица — Модули упругости при растяжении алюминия и других металлов [1]
Прочность при растяжении
Отношение максимальной нагрузки перед разрушением образца при испытании его на растяжение на исходную площадь поперечного сечения образца. Также применяются термины «предел прочности при растяжении» и «временное сопротивление разрыву».
Предел текучести
Напряжение, которое необходимо для достижения заданной малой пластической деформации в алюминии или другом материале при одноосной растягивающей или сжимающей нагрузке.
Если пластическая деформация под воздействием растягивающей нагрузки задается как 0,2 %, то применяется термин «предел текучести 0,2 %» (Rp0,2).
Рисунок — Типичная диаграмма напряжение-деформация для алюминиевых сплавов
Удлинение (при разрыве)
Часто называется «относительным удлинением». Увеличение расстояния между двумя метками на испытательном образце, которое возникает в результате деформирования образца при растяжении до разрыва между этими метками.
Величина удлинения зависит от размеров поперечного сечения образца. Например, величина удлинения, которая получена при испытании алюминиевого листового образца будет ниже для тонкого листа, чем для толстого листа. Тоже самое относится и к прессованным алюминиевым профилям.
Удлинение А
Удлинение в процентах после разрыва образца при исходном расстоянии между метками 5,65 · √ S
0, где S0 – исходная площадь поперечного сечения испытательного образца. Устаревшее обозначение этой величины А5 в настоящее время не применяется. Аналогичная величина в русскоязычных документах обозначается δ5.
Легко проверить, что для круглых образцов это расстояние между исходными метками вычисляется как 5·d.
Удлинение А50мм
Удлинение в процентах после разрыва образца по отношению к исходной длине между метками 50 мм и постоянной исходной ширине испытательного образца (обычно 12,5 мм). В США применяется расстояние между метками в 2 дюйма, то есть 50,8 мм.
Сдвиговая прочность
Максимальное удельное напряжение, то есть максимальная нагрузка, разделенная на исходную площадь поперечного сечения, которую выдерживает материал при испытании на сдвиг. Сдвиговая прочность обычно составляет 60 % от прочности при растяжении.
Сдвиговая прочность является важной характеристикой качества заклепок, в том числе, алюминиевых.
Коэффициент Пуассона
Отношение между продольным удлинением и поперечным сокращением сечения при одноосном испытании. Для алюминия и всех алюминиевых сплавов во всех состояниях коэффициент Пуассона обычно составляет 0,33 [2].
Твердость
Сопротивление металла пластическому деформации, обычно измеряемое путем отпечатка.
Твердость Бринелля (HB)
Сопротивление проникновению сферического индентора при стандартизированных условиях.
Для алюминия и алюминиевых сплавов твердость НВ приблизительно равна 0,3·Rm, где Rm – предел прочности при растяжении, выраженный в МПа [2].
Если применяется индентор из карбида вольфрама, то применяется обозначение HBW.
Твердость Викерса (HV)
Сопротивление проникновению алмазного индентора в виде квадратной пирамиды при стандартизированных условиях. Твердость HV приблизительно равна 1,10·HB [2].
Усталость
Тенденция металла разрушаться при длительных циклическом напряжении, которое значительно ниже предела прочности при растяжении.
Усталостная прочность
Максимальная амплитуда напряжения, которую может выдерживать изделие при заданном количестве циклов нагружения. Обычно выражается как амплитуда напряжения, которая дает 50%-ную вероятность разрушения после заданного количества циклов нагружения [2].
Усталостная выносливость
Предельное напряжение, ниже которого материал будет выдерживать заданного количество циклов напряжения [2].
Механические свойства алюминия и алюминиевых сплавов
В таблицах ниже [3] представлены типичные механические свойства алюминия и алюминиевых сплавов:
- предел прочности при растяжении
- предел текучести при растяжении
- удлинение при растяжении
- усталостная выносливость
- твердость
- модуль упругости
Механические свойства представлены отдельно:
- для алюминиевых сплавов, упрочняемых нагартовкой.
- для алюминиевых сплавов, упрочняемые термической обработкой.
Эти механические свойства — типичные. Это означает, что они годятся только для сравнительных целей, а не для инженерных расчетов. В большинстве случаев они являются средними значениями для различных размеров изделий, их форм и методов изготовления.
Источник:
- Материалы Алюминиевой ассоциации Германии
- Global Advisory Group GAG – Guidance «Terms and Definitions» – 2011-01
- Aluminium and Aluminium Alloys. — ASM International, 1993.
aluminium-guide.ru
Токсичность
Отличается незначительным токсическим действием, но многие растворимые в воде неорганические соединения алюминия сохраняются в растворённом состоянии длительное время и могут оказывать вредное воздействие на человека и теплокровных животных через питьевую воду. Наиболее ядовиты хлориды, нитраты, ацетаты, сульфаты и др. Для человека токсическое действие при попадании внутрь оказывают следующие дозы соединений алюминия (мг/кг массы тела): ацетат алюминия — 0,2-0,4; гидроксид алюминия — 3,7-7,3; алюминиевые квасцы — 2,9. В первую очередь действует на нервную систему (накапливается в нервной ткани, приводя к тяжёлым расстройствам функции ЦНС). Однако свойство нейротоксичности алюминия стали изучать с середины 1960-х годов, так как накоплению металла в организме человека препятствует механизм его выведения. В обычных условиях с мочой может выделяться до 15 мг элемента в сутки. Соответственно, наибольший негативный эффект наблюдается у людей с нарушенной выделительной функцией почек.
Норматив содержания алюминия в воде хозяйственно-питьевого использования сотавляет 0,2 мг/л. При этом данная ПДК может быть увеличена до 0,5 мг/л главным государственным санитарным врачом по соответствующей территории для конкретной системы водоснабжения.
Источники
- https://www.RusCable.ru/info/general/aluminium/
- https://chemege.ru/aluminium/
- https://TheMineral.ru/metally/alyuminij
- https://chem.ru/aljuminij.html
- https://himsnab-spb.ru/article/ps/al/