Почему ржавеет нержавейка? Причины коррозии нержавеющей стали
Возникновение ржавчины на нержавеющей стали ставит в ступор многих людей. Если материал носит название «нержавеющая сталь», то почему же нержавейка может окисляться, темнеть, чернеть и ржаветь? На самом деле, при неправильной обработке детали или при нарушенной эксплуатации, ржавчина может появиться даже на самой качественной нержавеющей стали.
Если в составе нержавейки не больше 10% хрома, то исключить появление коррозии практически невозможно. Даже на поверхности аустенитной стали, в которой находится 20% хрома и 8% никеля, может образоваться ржавчина. Для того чтобы продлить срок службы детали из нержавеющей стали, необходимо понять, как правильно пользоваться материалом и исключить возникновение дефектов структуры.
Какая «нержавеющая» сталь не будет ржаветь
Снизить риск и недопустить ржавление на нержавеющей стали можно при добавлении специальных химических элементов в состав сплава: это могут быть хром, никель, вольфрам, ванадий, молибден, кремний, марганец, титан. Такая сталь будет называться легированной. Изменение состава сплава приводит к улучшению физических свойств стали. Легированный материал приобретает качества, которых нет у обычной углеродистой стали, и избавляется от ее недостатки. При должной эксплуатации такая нержавейка не будет ржаветь. Готовые изделия из нержавейки безопасны для применения даже в пищевой и медицинской сфере, такая продукция экологична и отвечает всем требованиям безопасности.
В зависимости от пропорций содержания добавок выделяют низколегированную, среднелегированную и высоколегированную сталь. Высоколегированная сталь является наиболее популярным вариантом для применения в разных сферах промышленности. Сплав противостоит возникновению коррозии нержавейки в агрессивных средах и атмосфере. Улучшенные качества металлу придают легирующие добавки, в первую очередь это хром и никель. От процента содержания химических элементов зависит марка нержавеющей стали, ее антикоррозийные свойства и внешний вид.
Аустенитная нержавеющая сталь.
Стали этой группы широко используют в промышленности для изготовления крепежных деталей. Сплав немагнитный. Хорошо подвергается сварке и тепловой обработке. В составе может быть 15-20% хрома и 5-15% никеля. Процентное содержание добавок зависит от марки нержавейки.
Ферритные марки нержавейки.
За счет низкого содержания углерода ферритные стали становятся более мягкими и пластичными. Сплавы этой группы обладают магнитными свойствами. Их часто применяют для изготовления деталей, взаимодействующих с агрессивной средой, т.к. ферритные сплавы имеют высокий уровень устойчивости к образованию коррозии.
Мартенситные марки нержавейки.
Группа сплавов с повышенным содержанием углерода, что делает сталь наиболее прочной и твердой. Некоторые марки могут быть магнитными. Эта группа наименее коррозионностойкая. Используется, например, для изготовления столовых и режущих приборов.
Комбинированные марки.
Эта группа сталей сочетает в себе достоинства сразу нескольких групп.
Преимущества нержавеющих сталей:
- Долгий срок службы при правильной эксплуатации;
- Простота изготовления;
- Устойчивость к коррозии;
- Прочность;
- Гигиеничность и экологическая безопасность;
- Эстетичный внешний вид.
В каких сферах промышленности используется нержавеющая сталь:
- Архитектура и строительство;
- Изготовление бытовых приборов;
- Пищевая промышленность;
- Целлюлозно-бумажное производство;
- Нефтехимическая и химическая промышленность;
- Домашнее хозяйство;
- Энергетика;
- Охрана окружающей среды;
- Машиностроение.
К
Коррозионная стойкость нержавеющих сталей зависит от структурного состояния.
Наибольшей коррозионной стойкостью обладают твердые растворы, легированные хромом и никелем. Все факторы, увеличивающие неоднородность структуры нержавеющих сталей с образованием карбидов, нитридов и интерметаллидов хрома, приводят к уменьшению концентрации хрома в твердом растворе и снижению коррозионной стойкости нержавеющих сталей. Коррозионная стойкость нержавеющих сталей определяется устойчивостью пассивной пленки и зависит от природы агрессивной среды.
Как правило, в окислит, средах нержавеющие стали обладают высокой коррозионной стойкостью, а в неокислительных водных средах скорость коррозии нержавеющих сталей высока и возрастает с повышением содержания хрома, т. к. хром в этих условиях термодинамически неустойчив вследствие разрушения пассивной пленки. Т. о., нержавеющие стали устойчивы в растворах азотной к-ты, различных нейтральных и слабокислых растворах при доступе кислорода и неустойчивы в соляной, серной и плавиковой к-тах.
В последнее время установлено, что нержавеющие стали теряют также свою устойчивость в сильноокислит, средах вследствие разрушения пассивных пленок при высоком окислительно-восстановит. потенциале среды.
Пассивное состояние нержавеющих сталей возникает при определ. потенциалах и скоростях катодной реакции.
Для возникновения пассивного состояния любого металла, в т. ч. и нержавеющих сталей, необходимо, чтобы окислительно-восстановит. потенциал среды, а следовательно, потенциал катодной реакции превышал значения первого критич. анодного потенциала пассивации металла и чтобы катодный ток (скорость катодного процесса) превышал значение плотности критич. анодного тока пассивации. Несоблюдение этих условий приводит к активному состоянию, и нержавеющая сталь интенсивно растворяется. Условия пассивности нержавеющих сталей обеспечиваются в окислит, средах, а условия активного состояния — в восстановительных или слабоокислит. средах, что соответствует экспериментальным Данным по коррозионной стойкости нержавеющих сталей в различных средах. Чем выше содержание хрома, тем отрицательнее потенциал пассивации и ниже плотность тока анодной пассивации нержавеющих сталей. Указанные электрохимические параметры характеризуют склонность нержавеющих сталей к пассивации.
При переходе из активного состояния в пассивное на сталях может быть отмечено неустойчивое состояние, при этом в зависимости от влияния различных факторов металл может достигнуть полной пассивности или вновь перейти в активное состояние. Полная пассивность сталей достигается при более высоких потенциалах, к-рые зависят от состава сталей, а в ряде случаев от состава раствора (напр., присутствия активаторов). Установлено, что пассивное состояние нержавеющих сталей может быть нарушено путем анодной поляризации при высоком потенциале или созданием сильноокислит, условий с высоким окислительно-восстановит. потенциалом среды.
Различные состояния нержавеющих сталей (активное, пассивное, неустойчивое и состояние перепассивации) могут быть хорошо показаны с помощью потенциостатич. диаграмм скорости коррозии— потенциал или плотность анодного тока — потенциал, при этом имеется в виду ток эквивалентный скорости коррозии без учета тока, расходуемого на выделение водорода в области сильно отрицат. потенциалов или выделение кислорода в области сильно положительных потенциалов.
В активной области и области перепассивации скорость коррозии нержавеющих сталей возрастает с увеличением потенциала в соответствии с законом электрохимич. кинетики. В неустойчивой области, наоборот, скорость коррозии нержавеющих сталей уменьшается с увеличением потенциала, что связано с постепенной пассивацией поверхности нержавеющих сталей. При достижении полной пассивации скорость коррозии нержавеющих сталей практически не зависит от потенциала.
Коррозионная стойкость нержавеющих сталей определяется величиной стационарного потенциала и его расположением по отношению к значениям критич. потенциалов. Значение стационарного потенциала соответствует точке пресечения катодной кривой с кривой анодной поляризации. С помощью поляризац. диаграммы могут быть показаны все три осн. состояния (активное, пассивное, состояние перепассивации), определяющие электрохимич. й коррозионное поведение нержавеющей стали.
Скорость коррозии зависит не только от состава стали, но и от значения рН, природы и концентрации активаторов, внутренних и приложенных извне напряжений, темп-ры, присутствующих ингибиторов. В зависимости от этих факторов изменяются значения критич. потенциалов, а также плотности анодного тока, эквивалентные скорости коррозии, т. е. потенциостатич. диаграммы могут смещаться в координатах; скорость коррозии — потенциал. Так, с увеличением концентрации активаторов и темп-ры сужается область пассивного состояния и увеличивается скорость коррозии в пассивном состоянии. Увеличение темп-ры и концентрации водородных ионов приводит также к увеличению скорости коррозии нержавеющих сталей в активном состоянии. Анодные ингибиторы могут изменять скорость коррозии в пассивном состоянии и значение потенциалов полной пассивации и перепассивации, а также ток пассивации нержавеющих сталей.
Согласно современным представлениям, пассивное состояние металлов определяется адсорбционной или фазовой пленкой, образующейся на поверхности металла. Для нержавеющих сталей характерно образование фазово-адсорбционных пленок, при этом фазовые пленки могут образовываться как до погружения нержавеющих сталей в раствор («первичные пленки», возникающие на воздухе), так и при погружении в раствор, когда при глубокой пассивации (время, потенциал) адсорбц. пленки перерастают в фазовые пленки, обнаруживаемые электроннографич. и хи- мич. методами. Образующиеся фазовые пленки способствуют более глубокой пассивации нержавеющих сталей в порах
пленки и местах нарушения фазовой пленки вследствие эффекта самополяризации, при этом данные пленки выполняют функции эффективного катода, реагирующего на окислительно-восстановит. св-ва раствора. Строение пассивной пленки, образующейся на нержавеющих сталях, схематически представлено на рис. 8. В результате самополяризации кислород глубоко внедряется в металл.
Межкристаллитная коррозия аустенитных нержавеющих сталей
проявляется в сварном соединении и при неправильной термич. обработке нержавеющей стали (нагрев в интервале 500—800°). Явление межкристаллитной коррозии обусловлено тем, что зерна находятся в пассивном состоянии, а границы зерен — в активном состоянии. Условия пассивации тела зерна и границы зерен резко различаются вследствие образования по границам зерен карбидов хрома в виде непрерывной цепочки и участков, обедненных хромом (меньше 12% хрома), в то время как тело зерна сохраняет в твердом растворе высокое содержание хрома (более 12%), способное поддерживать зерно в пассивном состоянии. Вместе с тем при образовании карбидов и интерметаллидов по границам зерен возникают внутр. напряжения, также затрудняющие пассивацию границ зерен. Наибольшую склонность к межкристаллитной коррозии имеют аустенитные стали, нестабилизированные титаном или ниобием. В сварном соединении эффект межкристаллитной коррозии проявляется в осн. металле, в зоне влияния нагревов, на нек-ром расстоянии от сварного шва, где создаются благоприятные условия для образования карбидов хрома (нагрев до 450— 850°). Установлено, что с повышением содержания в стали углерода чувствительность к межкристаллитной коррозии хромоникелевых сталей резко возрастает, она зависит также от темп-ры и времени отпуска. Наибольшая чувствительность к межкристаллитной коррозии аустенитных хромоникелевых сталей проявляется после отпуска при темп-ре 650°. Существенное значение для межкристаллитной коррозии имеет и величина зерна; установлено, что чем меньше величина зерна, тем меньше чувствительность нержавеющих сталей к межкристаллитной коррозии. Чувствительность к межкристаллитной коррозии ферритных сталей также повышается с увеличением содержания углерода. Однако наибольшая чувствительность проявляется, в противоположность аустенитным сталям, после закалки или нормализации с высоких темп-р вследствие образования при охлаждении из пересыщенного твердого раствора а неравновесных железосодержащих карбидов и нитридов хрома.
В этих случаях также наблюдается обеднение хромом и усиление внутр. напряжений границ зерен. С применением высокого отпуска и в особенности отжига при 780—850° вследствие диффузии происходит выравнивание концентрации хрома по зерну и чувствительность стали к коррозии устраняется.
Для выявления склонности нержавеющих сталей к межкристаллитной коррозии наиболее быстрое испытание может быть проведено в растворах, где стационарный потенциал нержавеющей стали находится между потенциалом пассивации зерна и потенциалом пассивации границ зерна, что регулируется окислительно-восстано- вит. потенциалом среды. Согласно ГОСТ 6032—58, ускоренные испытания на меж- кристаллитную коррозию аустенитных нержавеющих сталей проводятся после провоцирующего отпуска при 650° в течение 2 час. В зависимости от состава сталей и их назначения применяется неск. методов ускоренных испытаний.
Для борьбы с межкристаллитной коррозией применяются след. эффективные методы: 1) Снижение содержания углерода, вследствие чего уменьшается карбидообразование по границам зерен. Обычно нержавеющие аустенитные и ферритные стали, содержащие менее 0,03% углерода, нечувствительны к межкристаллитной коррозии. 2) Применение закалки в воду с высоких темп-р для аустенитных сталей (тот же эффект для мн. сталей достигается и при нормализации с высоких темп-р). При этом карбиды хрома по границам зерен переходят в твердый раствор. 3) Применение стабилизирующего отжига при 750—900°. Вследствие процесса диффузии происходит выравнивание концентрации хрома как по зерну, так и по границам зерен. Этот способ особенно эффективен для ферритных хромистых сталей. 4) Легирование стали стабилизирующими карбидообразующими элементами — титаном, ниобием, танталом. Титан и ниобий являются более энергичными карбидообразователями, чем хром, при этом карбиды титана и ниобия образуются при более высоких темп-pax, чем карбиды хрома. Вместо карбидов хрома углерод связывается в карбиды титана или ниобия, а концентрация хрома в твердом растворе сохраняется одинаковой не только по зерну, но и по границам зерен. Содержание титана в нержавеющих аустенитных сталях должно быть в 5 раз, а ниобия в 8—10 раз больше углерода. Добавка титана устраняет также меж- кристаллитную коррозию ферритных хромистых сталей. 5) Создание двухфазных аустенито-ферритных сталей. Противоположные закономерности в поведении аустенитных и ферритных сталей хорошо сочетаются в аустенито-ферритных сталях, к-рые нечувствительны к межкристаллитной коррозии.
В некоторых средах обнаружен новый вид интенсивной локальной коррозии сварных швов нержавеющих сталей в зоне, непосредственно прилегающей к сварному шву («ножевая» коррозия). Этому виду структурной коррозии подвергаются также стали, стабилизированные титаном или ниобием. Такие явления связаны с высоким нагревом сталей при сварке (выше 1300°), когда карбиды титана или ниобия переходят полностью в твердый раствор. При последующем быстром охлаждении карбиды титана или ниобия не успевают выделиться, однако создаются благоприятные условия для образования карбидов хрома в непосредств. близости к сварному шву, вследствие чего возникают зоны, обедненные хромом; в этих зонах увеличиваются также внутр. напряжения. Все это приводит к быстрому разрушению стали в зоне, непосредственно прилегающей к сварному шву вследствие перехода ее в активное состояние. «Ножевая» коррозия
проявляется также и в состоянии перепассивации в сильноокислит, средах. По своей природе механизм «ножевой» коррозии аналогичен межкристаллитной коррозии. Осн. методами борьбы с «ножевой» коррозией являются: снижение содержания в стали углерода, стабилизирующий отжиг, увеличение содержания титана или ниобия против расчетного, применение двухфазных аустенито-ферритных сталей, изменение режима сварки с исключением воздействия критич. темп-р в пришовной области.
К коррозии под напряжением наиболее склонны мартенситные нержавеющие стали, обладающие высокой прочностью, а также (в нек-рых средах) аустенитные нержавеющие стали, хотя они и обладают высокой пластичностью. Легированйе титаном или ниобием не устраняет склонности к коррозии под напряжением аустенитных сталей. Коррозия под напряжением нержавеющих сталей связана с образованием надрезов вследствие из- бират. растворения границ зерен, блочных структур и др. неоднородных участков стали, в к-рых концентрируются напряжения и резко снижается анодная поляризуемость. При этом возникает большая разница в скоростях растворения осн. металла, находящегося в пассивном состоянии, и металла в надрезах, находящегося в активном состоянии. По окончании т. н. инкубац. периода вследствие интенсивной линейной коррозии в надрезах уменьшается рабочее сечение деталей. При этом прочность металла становится ниже приложенного напряжения, в связи с чем происходит спонтанное развитие трещины и разрушение детали. Чувствительность нержавеющих сталей к коррозии под напряжением определяется в кипящем 42% -ном растворе хлористого магния, в к-ром разрушение мн. сталей может происходить под влиянием внутр. напряжений. Установлено, что коррозия под напряжением аустенитных нержавеющих сталей сильно зависит от содержания никеля. Наивысшая чувствительность к коррозии под напряжением проявляется при содержании в стали никеля 9—14%, при дальнейшем повышении никеля чувствительность к коррозии под напряжением снижается и при содержании никеля более 40% сталь становится несклонной к коррозии под напряжением. Уменьшение содержания никеля (менее 9—14%) тоже приводит к резкому увеличению сопротивления коррозионному растрескиванию, что следует связать с образованием двухфазных аустенито-ферритных сталей, отличающихся высоким сопротивлением коррозии под напряжением. Особенно стимулируют коррозию под напряжением активаторы (хлор-ионы и др.), присутствующие в растворе.
Осн. методами борьбы с коррозией под напряжением являются: снижение приложенных напряжений извне; повышение содержания в стали никеля с целью создания стабильного аустенита; создание двухфазной аустенитно-ферритной стали за счет снижения никеля или легирования ферритообразующими элементами; применение термич. обработки (высокий отпуск для мартенситных сталей или стабилизирующий отжиг для аустенитных сталей); создание напряжения сжатия на поверхности сталей, напр. способом дробеструйной обработки; уменьшение концентрации активаторов.
Точечная и язвенная коррозия нержавеющих сталей часто встречается при эксплуатации в морской воде. В ряде случаев она может иметь перфорирующий характер (для листа и ленты). Механизм точечной и язвенной коррозии связан с адсорбцией хлор-ионов на нек-рых участках поверхности стали, вследствие чего происходит локализация коррозии. При эток осн. поверхность стали находится в пассивном состоянии, а участки с адсорбированными хлор-ионами — в активном состоянии; этому способствуют продукты коррозии. Точечная коррозия в присутствии хлор-ионов может быть вызвана пробоем пассивной пленки при высоком потенциале. Точечная и язвенная коррозия может также развиваться вследствие появления различных поверхностных дефектов (включения, интермета л л иды, повреждения пленки и т. п.).
При перемешивании морской воды сопротивление точечной коррозии всех нержавеющих сталей резко возрастает.
Легирование молибденом позволяет резко увеличить потенциал пробоя пассивной пленки в присутствии хлор-ионов и тем самым расширить область пассивности нержавеющей стали в присутствии хлор-ионов. Никель также понижает чувствительность нержавеющих сталей к точечной коррозии.
Для изделий из нержавеющих сталей сложных конструкций, имеющих щели, зазоры, карманы, характерен особый вид коррозии — щелевая коррозия. Механизм щелевой коррозии связан с затруднением диффузии кислорода или др. окислителя (как деполяризатора) или анодных замедлителей коррозии (ингибиторов) в труднодоступные участки конструкции, вследствие чего на этих участках резко
снижается анодная поляризация, снижается потенциал стали и нержавеющая сталь переходит в активное состояние.
Методы борьбы с щелевой коррозией сводятся в первую очередь к конструктивным мерам — устранению зазоров, щелей, карманов, контактов стали с неметаллич. материалами. Весьма эффективно также увеличение концентрации окислителя или анодных замедлителей, если они присутствуют в растворе.
Методы повышения коррозионной стойкости. Коррозионная стойкость нержавеющих сталей может быть в значит, степени повышена методами легирования, применения оптимальных режимов термич. обработки, соответствующей механич., химич. и электрохимич. обработки, применения анодной защиты. Наиболее эффективным является увеличение содержания хрома. С повышением его содержания расширяется область пассивного состояния нержавеющих сталей, т. к. в значит, степени снижаются потенциал и ток пассивации. При высоком содержании хрома нержавеющие стали устойчивы даже в слабоокислит, средах. Коррозионная стойкость нержавеющих сталей резко повышается при снижении содержания углерода, что особенно важно для борьбы со структурной коррозией и повышения коррозионной стойкости стали после высокого отпуска. Значительно повышается коррозионная стойкость нержавеющих сталей, особенно в слабоокислит. средах, при введении никеля, молибдена и меди. При этом, с одной стороны, повышается термодинамич. устойчивость сталей, а с другой — повышается их пассивируемость и защитные св-ва пассивных пленок. Исключительно эффективно влияние титана, ниобия, тантала как карбидообразователей для борьбы с межкристаллитной коррозией.
В работах последнего времени установлено благоприятное влияние легирования нержавеющих аустенитных и ферритных сталей небольшим количеством благородных металлов (палладий, платина) в слабоокислит. средах при высоких темп-pax, когда нержавеющие стали находятся в активном состоянии.
За счет снижения перенапряжения водорода потенциал сталей при легиро
Коррозионная стойкость нержавеющей стали мартенситного и аустенитного классов резко снижается после высокого отпуска. Наибольшую коррозионную стойкость стали мартенситного, мартенсито-феррит- ного и мартенсито-карбидного классов приобретают после закалки и низкого отпуска, а стали аустенитного и аустенито- ферритного класса после закалки в воду. При нагревах происходит распад твердого раствора а и у с образованием карбидов хрома в аустенитных сталях и ряда промежуточных структур в мартенситных сталях (троостит, сорбит, перлит). Если отпущенные аустенитные и мартенситные стали подвергать стабилизирующему отжигу при 780—900°, то скорость их коррозии понижается.
Коррозионная стойкость нержавеющих сталей определяется защитными св-вами поверхностной пассивной пленки, к-рые сильно зависят от состава стали и качества обработки поверхности. Как правило, нержавеющие стали с грубо обработанной поверхностью характеризуются пониж. коррозионной стойкостью. Наибольшая коррозионная стойкость в атм. условиях достигается в полированном состоянии. В целях повышения защитных св-в поверхностной пленки нержавеющие стали после механич. обработки, в т. ч. и механич. полирования, подвергают хи- мич. пассивации. В этом случае создается более совершенная пассивная пленка и удаляются следы железа, занесенные при обработке инструментом (следы железа на поверхности нержавеющих сталей становятся очагом коррозии). Пассивация производится в 20%-ном растворе HN03 при 45—55° в течение 16—30 мин., можно проводить пассивацию в 40%-ном растворе HN03 при комнатной темп-ре. Пассивация мартенситных сталей производится в растворе, содержащем 20% HNO, и 2% К2Сг207 при 45—55° в течение 15— 30 мин. Пассивация нержавеющих сталей может проводиться и в др. растворах, содержащих окислители.
С защитной целью для деталей небольших габаритов применяют электрополировку. Состав ванн и режим электрополировки зависят от состава и структуры нержавеющих сталей. В этом случае дополнит, химич. пассивация не проводится, т. к.- пассивная пленка образуется в процессе электрополировки.
В соответствии с теорией пассивности после перехода металла в пассивное состояние требуется очень незначит, ток для поддержания стали в пассивном состоянии. Поэтому в ряде случаев, напр. в химич. аппаратах, может быть использован эффект анодной защиты; так, сталь XI8H9, подверженная коррозии в серной к-те, особенно при повыш. темп-pax, может быть защищена путем анодной поляризации. Для перевода нержавеющей стали в пассивное состояние вначале требуется значит, плотность тока, однако после того как сталь будет переведена в пассивное состояние, требуется всего неск. мка/см2 для поддержания пассивного состояния.
Газовая коррозия нержавеющих сталей
и методы борьбы с ней. Нержавеющие стали при нагревании на воздухе или в среде кислорода подвергаются окислению с образованием окалины.
Добавки вольфрама и молибдена повышают жаропрочность, но ухудшают жаростойкость нержавеющих сталей. Добавки кобальта не снижают жаростойкости. Легирование хромом значительно повышает коррозионную стойкость сталей в сероводороде.
Коррозия нержавеющих сталей в расплавленных металлах и гидроокисях
. Характер взаимодействия жидких металлов с нержавеющими сталями не подчиняется общим закономерностям поведения их в водных растворах. Среди расплавленных металлов жидкий натрий, калий и их сплавы являются наименее активными в коррозионном отношении. Установлено, что до 650° и при перепаде темп-р не более 150° успешно могут использоваться аустенитные хромоникелевые стали с низким содержанием углерода; при этом содержание примесей кислорода не должно превышать 0,01—0,02%. При ^бо л ее высоком содержании примесей кислорода происходит охрупчивание аустенитных нержавеющих сталей уже при 350°. В целях борьбы с эрозией скорость движения расплавленного натрия, калия и их сплавов не рекомендуется превышать 8 м/сек. Требуется также высокая чистота жидкого металла по углероду, в противном случае будет происходить науглероживание нержавеющих сталей вследствие взаимодействия его с карбид ообразующими элементами, находящимися в стали (хром, ниобий и др.). Выше 650° в жидком натрии, калии и их сплавах наблюдается селективное растворение никеля в нержавеющих сталях и перенос его на холодные участки коммуникаций. Расплавленный литий является более агрессивным по отношению к нержавеющим сталям, особенно выше 760°. Выщелачивание никеля в расплавленном литии происходит гораздо интенсивнее, при этом поверхностный слой аустенитной стали превращается в феррит, поэтому для расплавленного лития при высоких температурах рекомендуются высокохромистые ферритные нержавеющие стали. Расплавленный литий взаимодействует с карбидами металлов. Исключительно агрессивным действием характеризуется нитрид лития Li3N, в связи с чем должны быть высокие требования к расплавленному литию по примесям азота. При более низких температурах и небольших перепадах температур в расплавленном литии могут применяться и хромоникелевые аустенитные нержавеющие стали. Борьба с кислородом в расплавленных металлах проводится путем введения небольших количеств кальция, бериллия, магния, циркония, титана и др. легко окисляющихся металлов, к-рые связывают кислород. Установлено, что аустенитные стали более чувствительны к примесям кислорода, чем ферритные нержавеющие стали. Весьма агрессивным действием характеризуются расплавленный висмут, свинец и их сплавы, сплавы висмута с индием и свинцом. В этих средах также более стойкими являются высокохромистые ферритные нержавеющие стали. Из расплавленных гидроокисей наиболее коррозионно-активным является гидроокись натрия. Гидроокиси калия, лития, стронция, бария в коррозионном отношении менее активны.
Лит.: Акимов Г. В., Основы учения о коррозии и защите металлов, М., 1946; его же, в сб.: Исследования по нержавеющим сталям, М.—JI., 1956 (Тр. Комис. по борьбе с коррозией металлов, в. 2); Акимов Г В. и Батраков В. П., «ДАН СССР», 1944, т. 45, № 3, с. 124; Акимов Г. В. и Гурвич Л. Я., «ИАН СССР. Отд. хим. наук», 1945, № 5, с. 412; Батраков В. П., Коррозия конструкционных материалов в агрессивных «редах. Справочник, М., 1952; Коррозия и защита металлов, Сб. ст., под ред. Р. С. Амбарцумяна, М., 1957; Коррозия и защита металлов. Сб ст., под ред. В. П. Батракова, М., 1962; Томашов Н. Д., Теория коррозии и защиты металлов, М., 1959; Химушин Ф. Ф., Нержавеющие, кислотоупорные и жароупорные стали, [2 изд.], М., 1945; Коломбье Л. иГохман И., Нержавеющие и жаропрочные стали, пер. с франц., М., 1958; Бабаков А. А., Нержавеющие стали, М., 1956; Медовар Б. И., Сварка хромоникелевых аустенитных сталей, 2 изд., Киев—М., 1958; Шварц Г. Л. иКристальМ. М., Коррозия химической аппаратуры. Коррозионное растрескивание и методы его предотвращения, М., 1958; Edeleanu С., «Nature», 1954, v. 173, № 4407, р. 739; Oliver R., International committee of electrochemical thermodynamics and kinetics.
Proceedings of the sixth meeting. 1954, L., 1955;Воi m e 1 A. undСa r i u s K., «Arch.Eisenhuttenwesen», 1961, Bd 32, H. 4, S. 237.
Теплостойкая нержавейка. Теплостойкий вид нержавеющей стали
КОРРОЗИЯ МЕТАЛЛОВ МЕЖКРИСТАЛЛИТНАЯ, продукты межкристаллитной …
| Особенно опасна межкристаллитная коррозия нек-рых |
Свойства нержавеющей стали. Нержавеющие стали хромистые …
| Наилучшую стойкость против коррозии имеют хромистая нержавеющая |
Коррозия стали и методы борьбы с ней. Цинковые и алюминиевые …
| Весьма стойки к атмосферной коррозии нержавеющие легированные |
Антикоррозионная защита металлов
| Коррозия металлов приводит не только к безвозвратным их потерям, |
Газовая коррозия, кавитационная коррозия
| Теплостойкая нержавейка. Теплостойкий вид нержавеющей стали … с его способностью … сталей во влажной среде, а также на сопротивление газовой коррозии . … |
Защита от коррозии металла
| Так, вводя в сталь хром и никель в количестве 12…20 %, получают |
Применение нержавеющей стали
| Еще одна трудность заключается в том, что малоуглеродистая сталь при соприкосновении с |
ЛЕГИРОВАНИЕ. Затвердевший раствор называют легированием
| Легирование стали повышает ее антикоррозионные свойства. Например, совершенную стойкость к атмосферной |
Условия и причины разрушения защитного слоя нержавеющей стали
Нержавейка получает свои улучшенные качества при добавлении легирующих элементов в состав сплава. В основном этими добавками служит хром, никель, молибден. В первую очередь за антикоррозийные свойства отвечает хром, чем больше его в составе, тем лучше формируется антикоррозийный слой на поверхности металла. Атомы хлора вступают в реакцию с кислородом, впоследствии чего образуется оксидная пленка.
Соответственно, больше всего подвержены коррозии те сплавы, в которых меньше легирующих добавок в составе, в частности хрома и никеля.
Внешний слой сплава может портиться от контакта с железом. Это возможно, например, при неправильной сварке, когда на поверхность попадают частички железа. Если после этого плохо провести обработку детали, на сварочном шве появятся коррозионные вкрапления, которые впоследствии будут увеличиваться.
Разрушение защитного слоя на нержавейке и возникновение коррозии обусловлено несколькими факторами:
- Неправильная обработка поверхности металла. При нарушенной технологии сварки или шлифовки детали образуются микродефекты, которые приводят к разрушению оксидной пленки.
- Использование некачественных материалов. Это относится к низкосортной стали, когда экономия денег сказывается на качестве сплава.
- Неправильная эксплуатация.
Во избежание возникновения ржавчины на нержавейке следует тщательно подходить к выбору предприятия, занимающимся изготовлением и продажей нержавейки. Обязательным критерием выбора должен послужить опыт работников и заключение договора с гарантийными условиями.
Если вам поступило предложение купить нержавейку по цене ниже рыночной, то стоит задуматься о качестве материала.
Виды коррозии нержавеющей стали
Основными разновидностями коррозии являются:
- Общая коррозия.
Данный вид характеризуется разрушением оксидной пленки на всей поверхности стали. В зависимости от характера распространения такая коррозия может быть равномерной или неравномерной. При проникновении галогенов (фтора, хлора, брома, йода) через защитный слой начинается активный процесс образования ржавчины на нержавеющей стали. Общая коррозия может возникнуть даже от простой водопроводной воды, ведь в ее составе присутствуют химические частицы, способные разрушить оксидную пленку. Поэтому при чистке нержавейки нельзя использовать хлорсодержащие средства. Для очистки поверхности нержавеющей стали следует применять только специальные чистящие средства. Они должны соответствовать требованиям СанПиН, СНиП и ГОСТ. Уровень рН должен находиться в пределах 7,2 — 7,6. - Щелевая коррозия.
Возникает при образовании небольшого зазора в деталях из нержавеющих сталей. Этот процесс можно заметить, например, при использовании крепежных элементов в морской воде. Хлор, содержащийся в жидкости, смывает оксидную пленку. При отсутствии кислорода процесс продолжается стремительно. - Питтинг
(он же язвенная коррозия, точечная коррозия). Проявляется при малейшем поражении защитного слоя и воздействии агрессивной среды на поверхность. В поврежденном месте сталь становится анодом, а пассивированная часть – катодом. В результате этого анод начинает быстрее растворяться, вызывая питтинговую коррозию нержавеющей стали. - Гальваническая коррозия.
Гальванокоррозия похожа на точечный вид образования ржавчины. Данная электрохимическая коррозия нержавеющей стали возникает во время контакта разного типа металлов в агрессивной токопроводящей среде. - Межкристаллитная коррозия
(она же мкк коррозия или транскристаллитная коррозия). Такой вид образования ржавчины возникает при сверхвысоких температурах, чаще всего при сварке. - Эрозионная коррозия.
Возникает в результате воздействия на поверхность нержавейки абразивной жидкости, разрушающей защитный слой и приводящей к эрозии.
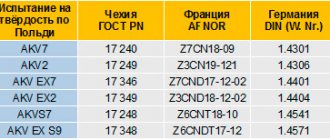
Пример недопустимых гальванических пар:
Гальваническое действие может возникнуть, если строительную конструкцию из нержавеющей стали скреплять оцинкованными болтами. В этой нежелательной паре пострадает высоко анодный крепеж, поскольку его электроны будут перемещаться в направлении катодной нержавеющей стали. Поэтому, крепежные детали должны быть изготовлены из менее гальванически активного металла, чем материал металлоконструкции.
На скорость течения гальванокоррозии оказывает влияние площадь поверхности анода и катода. Если большой по размеру анод соединить с маленьким катодом, то анод будет ржаветь медленно, а если сделать наоборот, то быстро. Например, используйте болты из нержавеющей стали для крепления алюминия, но не наоборот.
Степень интенсивности протекания контактной коррозии зависит и от условий эксплуатации соединения. В обычных атмосферных условиях процесс будет протекать менее быстро и возрастает в агрессивной электропроводной среде, например, растворах кислот и щелочей. Присутствие в воде других веществ увеличивает проводимость электролита и скорость коррозии. Поэтому при проектировании конструкций важна оценка окружающей среды.
Как бороться с коррозией нержавеющей стали?
В первую очередь, сталь должна храниться и изготавливаться по особой технологии. На металлургических заводах должны соблюдаться все требования, относящиеся к эксплуатации нержавейки. Должны предотвращаться ситуации, в ходе которых частицы нелегированного металла могут попасть на нержавеющую сталь.
В целях защиты нержавеющей стали от коррозии требуется исключить близкий контакт стали с обычным металлом. Это правило касается и других инструментов, применяемых для изготовления деталей. Запрещено использовать металлическую щетку для зачистки поверхности необработанного металла на легированной стали.
Использование нержавеющей стали в соляной и серной кислоте приводит к образованию ржавчины, следовательно, необходимо исключить применение сплава в агрессивных средах.
Также для защиты нержавейки от коррозии следует добавлять в сплав легирующие компоненты, это повысит антикоррозийные свойства стали. Чем больше их процентное содержание, тем выше стойкость к коррозии.
Не рекомендуется также использовать хлорсодержащие средства для обработки и чистки поверхности.
Как защитить конструкцию или узел от контактной коррозии?
Если по конструктивным соображениям невозможно избежать нежелательного контакта разнородных металлов, то можно попытаться уменьшить гальваническую коррозию с помощью следующих методов:
- окраска поверхностей в районе их стыка;
- нанесение совместимых металлических покрытий;
- изоляция соединения от внешней среды;
- электрическая изоляция;
- установка неметаллических прокладок, вставок, шайб в болтовых соединениях.
Практика показывает, что в тех случаях, когда пренебрегают требованиями к допустимости контактов разных металлов, приходится дорого за это расплачиваться. Неправильная компоновка контактных пар выводит из строя узлы крепления, металлоконструкции и может стоять человеческой жизни.
Полезные советы Обновлено: 29.09.2020 10:26:57